α-硫辛酸对帕金森病细胞模型内质网应激及细胞凋亡的影响
2018-10-10李艳霞李沛珊王玉玲杨新玲
李艳霞,高 华,王 丹,李沛珊,王玉玲,杨新玲*
(1新疆医科大学第二临床医学院康复医学科,乌鲁木齐 830063;2新疆医科大学第五临床医学院神经内科;3新疆医科大学第二临床医学院神经内科;4新疆医科大学第一临床医学院内科VIP病区;*通讯作者,E-mail:poplar862@sohu.com)
帕金森病(Parkinson’s diseases,PD)是目前仅次于阿尔兹海默病的一种常见的神经系统退行性疾病,在我国65岁以上人群的患病率为1 700/10万,并随年龄增长而升高,给家庭和社会带来沉重的负担[1]。该病是年龄老化、遗传缺陷和环境毒素相互作用的结果,其发病机制仍未完全明了,也无根本的防治措施[2]。其主要病理改变为黑质致密部多巴胺能神经元变性丢失、细胞内α-突触核蛋白(α-syn)等蛋白积聚和路易小体形成,蛋白积聚可诱发氧化应激和内质网应激(endoplasmic reticulum stress,ERS),并介导多种信号途径参与DA神经元变性[3]。但目前尚无针对PD氧化应激和内质网应激的治疗药物。
α-硫辛酸(ALA)已在临床上应用于多种与氧化应激增加相关的疾病[4]。一些研究表明,ALA在体内和体外的神经退行性疾病模型中发挥保护作用,包括阿尔茨海默病(AD)、黄斑变性和PD[5,6]。ALA可保护多巴胺神经元细胞,减轻由MPP++诱导产生的氧化应激反应及神经毒性的致凋亡作用[7]。ALA也可能同时降低内质网应激水平,降低模型细胞的凋亡率,减缓环境毒素对细胞造成的伤害。本实验将应用ALA干预6羟基多巴胺(6-OHDA)诱导PC12细胞造成的PD细胞模型,探讨ALA能否减轻PD细胞模型的内质网应激,降低模型细胞的凋亡率,对多巴胺神经元起到保护作用及其相关的机制。
1 材料与方法
1.1 主要试剂
高糖DMEM培养基、0.25%胰蛋白酶(Hyclone公司,美国);胎牛血清(Gibco公司,美国);AnnexinⅤ PE/7AAD凋亡试剂盒(BD公司,美国);6-OHDA(sigma公司,美国);CCK8细胞增殖及细胞毒性检测试剂盒(Dojindo,日本);RIPA裂解液、BCA蛋白浓度测定试剂盒(Thermo,美国);SDS-PAGE凝胶制备试剂盒(北京索莱宝公司,中国);BCIP/NBT碱性磷酸酶显色试剂盒(碧云天生物技术有限公司,中国);兔抗鼠GAPDH、CHOP、XIAP、Caspase3、α-syn多克隆抗体(武汉三鹰生物技术有限公司,中国);兔抗鼠Bip/Grp78单克隆抗体、HtrA2多克隆抗体(Abcam,美国);α-硫辛酸(史达德大药厂,德国)。
1.2 PC12细胞的培养
PC12细胞(大鼠嗜铬细胞瘤细胞)购自中国科学研究院上海细胞库,将冻存的细胞复苏,加入完全培养基,接种于25 cm2的培养瓶中,在含5%CO237 ℃的培养箱中培养,每2-3 d更换培养液,待细胞贴壁单层生长至80%-90%,用0.25%胰蛋白酶消化传代,在后续实验中使用10-20代细胞,给予细胞药物干预时均使用含2%血清的培养基配药。
1.3 6-OHDA PD细胞模型的建立
6-OHDA溶液的配制:将6-OHDA 1 mg溶于48.6 μl生理盐水(含0.2%抗坏血酸)中,配成100 mmol/L母液,用生理盐水现配成10 mmol/L的工作液,再按需要的终浓度配制药液。
将对数生长期细胞消化离心后计数,以30 000 cells/cm2密度接种于96孔板,细胞贴壁生长24 h,每孔加入100 μl不同终浓度(0-200 μmol/L)的6-OHDA溶液,继续培养24 h,更换细胞上清液为100 μl孔无血清培养基,加入10 μl/孔CCK-8溶液,继续培养2 h。使用酶联免疫检测仪检测450 nm处各孔的吸光度,以含2%血清的DMEM为溶剂对照孔,每组3个复孔,重复3次。选择相对细胞存活率约50%的6-OHDA浓度(60 μmol/L)为造模浓度。
1.4 ALA最佳浓度筛选
将细胞30 000 cells/cm2接种于96孔板,贴壁生长24 h,随机分为空白对照组、模型组、模型+不同终浓度ALA组,每组5个复孔。将121 mmol/L ALA原液用含2%血清的培养基稀释成不同终浓度(0.001,0.01,0.1,1,10,100 μmol/L)的药液预处理细胞1 h,在细胞上清液中加入使终浓度为60 μmol/L的6-OHDA共同作用24 h,更换细胞上清液为100 μl/孔无血清培养基,加入CCK-8溶液,10 μl/孔,继续培养2 h,检测各孔的吸光度,选择最佳的ALA浓度为1 μmol/L。将细胞用1 μmol/L的ALA预处理1 h,然后在37 ℃暴露于60 μmol/L 6-OHDA 24 h。
1.5 AnnexinⅤ-PE/7AAD试剂盒检测PC12细胞凋亡
将PC12细胞用6孔板以30 000 cells/cm2密度接种,分组:CON、6-OHDA组、ALA组、ALA+6-OHDA组,每组3个复孔,实验重复3次。细胞培养、接种、加药方法同上。加药后24 h收集细胞(包括细胞上清内细胞),每孔分别将细胞上清收集到离心管中,和胰酶消化下来的细胞一起1 000 r/min离心5 min,PBS洗两遍,每个样本加入100 μl PBS液、5 μl PE染液和5 μl 7AAD染液,室温避光孵育15 min,在每个样本中加入390 μl 1×buffer,筛网过滤转移至流式管中,2 h内流式细胞仪(BD FACSAriaTMⅡ,美国)检测,激发波长Ex=488 nm,发射波长Em=530 nm。
1.6 Western blot法检测蛋白表达
将PC12细胞用10 cm培养皿以30 000 cells/cm2密度接种,细胞分组、加药方法同上。加药24 h用胰酶消化、离心、收集细胞,每组细胞中加入100 μl细胞裂解液(RIPA ∶PMSF=100 ∶1),置于冰上裂解30 min,用混悬器混匀数次,4 ℃ 12 000 r/min离心15 min,吸取上清。按BCA蛋白浓度测定试剂盒(Thermo)说明书绘制标准曲线及测定蛋白浓度。按每孔30 μg蛋白上样量配制样品,-80 ℃保存。凝胶蛋白电泳约1.5 h,电转移100 V 2 h至PVDF膜,室温摇床5% BSA封闭2 h。用封闭液稀释兔GAPDH抗体(1 ∶9 000)、兔CHOP单克隆抗体(1 ∶500),兔Bip/Grp78单克隆抗体(1 ∶6 000),兔抗鼠Caspase3(1 ∶1 000),兔抗鼠XIAP(1: ∶1 000)、兔抗鼠α-syn(1 ∶500)、兔抗鼠HtrA2(1 ∶1 000),4 ℃摇床孵育过夜。用封闭液稀释AP标记羊抗兔IgG(1 ∶1 000),室温摇床避光孵育2 h。显色,拍照,使用Image J图像分析软件分析。每个实验重复3次。
1.7 统计学分析
采用SPSS17.0软件进行分析。计量资料以均数±标准差表示,均经正态性检验,符合正态分布、方差齐性,组间均数比较采用单因素方差分析Tukey HSD检验进行组间多重比较。P<0.05被认为差异有统计学意义。
2 结果
2.1 筛选造模浓度
20-200 μmol/L 6-OHDA作用于PC12细胞24 h,均可导致细胞活力相对正常对照组有不同程度的下降,且呈剂量依赖性下降(见图1),其中60 μmol/L 6-OHDA处理细胞24 h,细胞存活率为(47.58±2.401)%,细胞约半数存活,故选择60 μmol/L作为帕金森病细胞模型的造模浓度。
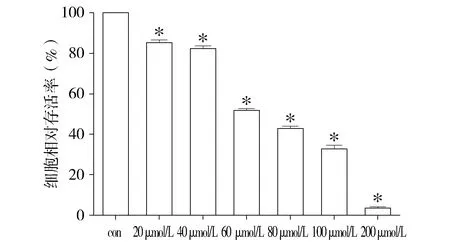
与对照组比较,*P<0.05图1 不同浓度6-OHDA作用PC12细胞后相对存活率 (n=5)Figure 1 Cell viability of PC12 after treatment by different concentrations of 6-OHDA (n=5)
2.2 ALA的最佳干预浓度
用0.001-1 000 μmol/L ALA预处理细胞1 h,给予60 μmol/L终浓度的6-OHDA共同作用细胞24 h,检测细胞的存活率。模型细胞存活率均较对照组明显下降,差异有统计意义(P<0.05),LA 0.1 μmol/L、1 μmol/L可使模型细胞的存活率明显升高,与模型组比较差异有统计意义(P<0.05,见图2),ALA 1 μmol/L使细胞活力改善较好,故后续实验采用ALA 1 μmol/L对模型细胞进行干预。
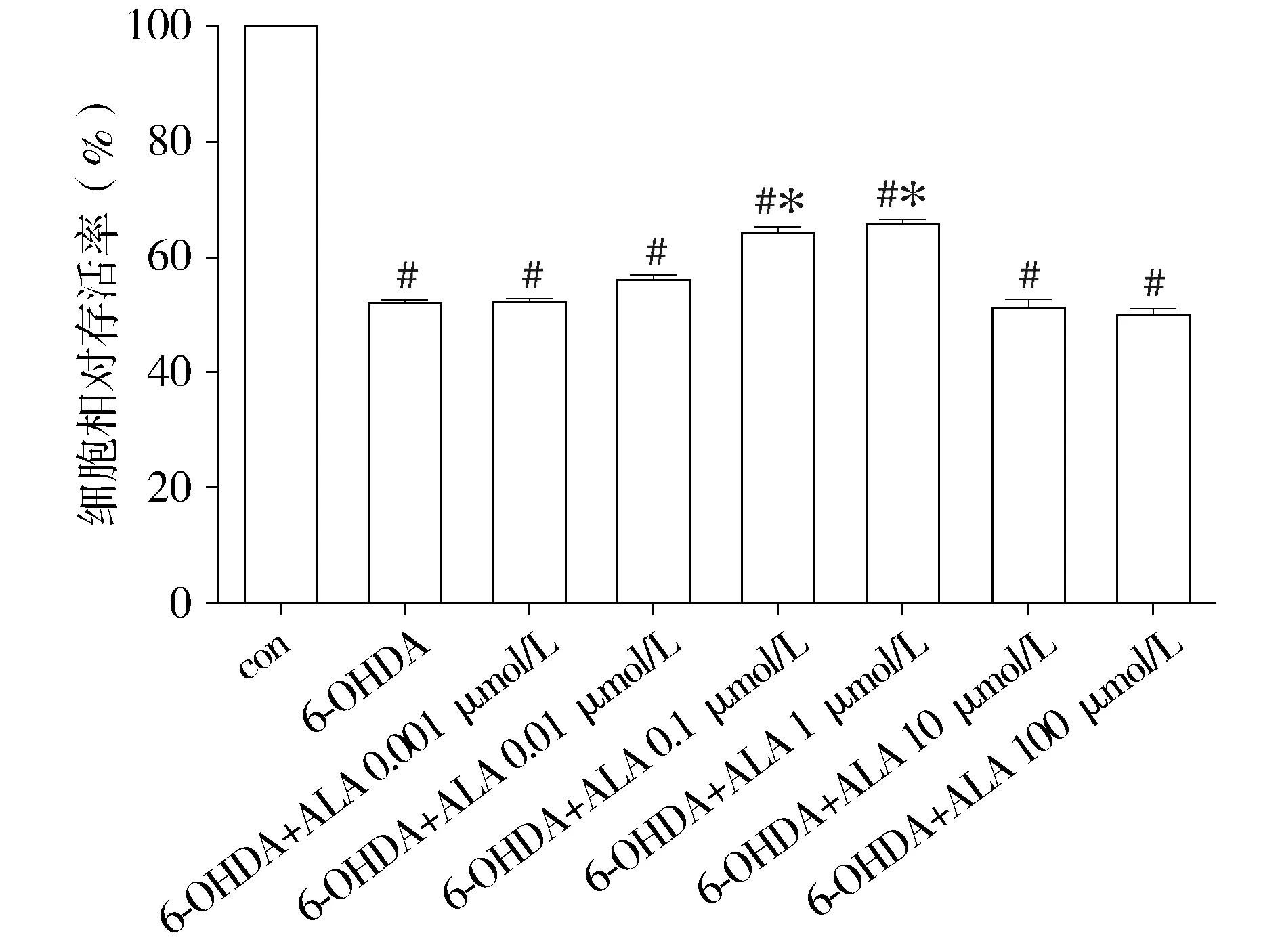
与对照组比较,#P<0.05;与6-OHDA组比较,*P<0.05图2 不同浓度ALA对模型细胞存活率的影响 (n=9)Figure 2 Effect of different concentrations of ALA on cell viability of model cells (n=9)
2.3 ALA对模型细胞凋亡的影响
各组细胞凋亡率:Con组(3.50±0.97)%,6-OHDA组(24.66±3.54)%,ALA组(4.77±1.03)%,ALA+6-OHDA组(15.59±2.97)%。与Con组比较,6-OHDA组细胞凋亡率升高,差异有统计学意义(P<0.05);与6-OHDA组比较,ALA+6-OHDA组凋亡率下降,差异有统计学意义(P<0.05,见图3)。
2.4 凋亡相关蛋白的表达
与对照组比较,模型组Active caspase3、HtrA2、α-syn的表达均明显升高,XIAP表达下降(P<0.05);与模型组比较6-OHDA+ALA组Active caspase3、HtrA2、α-syn的表达均有明显下降,XIAP表达升高,与对照组比较,6-OHDA+ALA组的HtrA2表达明显升高(P<0.05),Active caspase3、α-syn的表达,差异无统计学意义(P>0.05,见图4)。
2.5 内质网应激相关蛋白检测
与对照组比较,模型组细胞Bip/Grp78、CHOP表达明显升高,6-OHDA+ALA组CHOP表达明显升高,差异有统计学意义(P<0.05);与模型组比较,6-OHDA+ALA组Bip/Grp78、CHOP表达明显降低(P<0.05,见图5)。
3 讨论
帕金森病(PD)是多巴胺神经元变性,细胞内α-突触核蛋白(α-syn)等蛋白积聚或包涵体(lewy body,LB)形成。蛋白积聚可诱发氧化应激和内质网应激(endoplasmic reticulum,ERS)[8]。ER应激介导的细胞凋亡已被证明与神经退行性疾病的发病机制有关,包括帕金森病[9,10]。内质网(endoplasmic reticulum,ER)是细胞内重要的细胞器,主要参与调节蛋白质合成以及合成后蛋白质的折叠等。病理刺激(如氧化应激、脂质积聚等)会引起未折叠蛋白或错误折叠蛋白在内质网的聚集,产生ERS,激活未折叠蛋白反应(unfolded protein response,UPR)来保护由ERS引起的损伤,严重的ERS可以启动凋亡程序。葡萄糖调节蛋白78(Bip/Grp78)和C/EBP同源蛋白(CHOP)是ER应激的分子标志物,它们的水平增加提示ER应激诱导;Zinszner等[11]发现CHOP途径是ER应激诱导细胞凋亡的主要调节因子,因为当面临ER应激时,CHOP-/-细胞表现出较少的程序性细胞死亡。且CHOP是触发细胞凋亡通路的最初信号,它抑制Bcl-2基因的启动子,并使细胞对促凋亡作用敏感[12]。
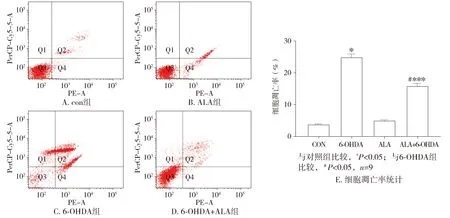
图3 各组细胞凋亡率比较Figure 3 Comparison of apoptosis rate among four groups

与对照组比较,*P<0.05;与6-OHDA组比较,#P<0.05图4 凋亡相关蛋白的表达 (n=3)Figure 4 The expression of apoptosis-related proteins (n=3)
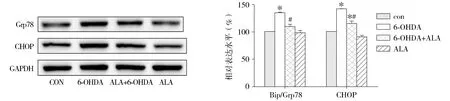
与对照组比较,*P<0.05;与6-OHDA组比较,#P<0.05图5 内质网应激相关蛋白表达 (n=3)Figure 5 The expression of ER stress-related proteins after different treatment (n=3)
PC12细胞是大鼠嗜铬细胞瘤细胞克隆的细胞株,它能够表达酪氨酸羟化酶并合成多巴胺,常被用来作为研究多巴胺能神经元的有利工具,目前应用PC12细胞建立PD细胞模型已经得到广泛公认。6-OHDA是一种类似多巴胺的嗜神经毒素,通过形成羟自由基和抑制线粒体氧化呼吸链复合物Ⅰ和Ⅳ,干扰ATP合成,选择性引起多巴胺能神经元死亡,常用于诱导PD的动物和细胞的实验模型[13]。6-OHDA诱导SH-SY5Y细胞产生内质网应激,Bip/Grp78和CHOP表达增加,细胞活力降低,提示ER应激在6-OHDA诱导的SH-SY5Y细胞死亡中起着潜在的作用[9]。本研究采用浓度为60 μmol/L的6-OHDA诱导24 h致接近半数细胞死亡,成功建立PC12帕金森细胞模型。
α-硫辛酸(ALA)是一种天然的二硫醇化合物,它是由辛酸和半胱氨酸在线粒体中酶促合成的。它在体内和体外一系列病理生理损害中的保护活性已多有报道[14]。本研究中,与对照组比较,PD模型细胞的凋亡率明显增高,GRP78、CHOP、α-syn的表达水平明显增加,提示6-OHDA可能诱导产生α-syn的蛋白集聚,刺激产生的ERS可能参与了PD模型细胞的凋亡,在PD的发展中起重要作用。给予ALA干预模型细胞后,与PD细胞模型组相比,GRP78、CHOP、α-syn表达水平明显下降,凋亡率明显下降,提示ALA可能通过减少了α-syn蛋白的集聚,减轻ERS从而减少了细胞凋亡。
哺乳动物细胞某些线粒体蛋白,如细胞色素c、caspase二级线粒体激活蛋白Smac、内核酸酶G (endoG)、凋亡诱导因子(AIF)和Omi/HtrA2等,在凋亡刺激因素作用下从线粒体内外膜间释放到细胞浆或细胞核中,激活caspase或抑制凋亡抑制蛋白(IAP)促进细胞凋亡。由于IAP分子的BIR结构域能够结合并抑制caspase-9和caspase-3,X染色体编码的IAP(XIAP)通过竞争性结合活化的caspase-3阻断凋亡途径[15]。Omi/HtrA2分子是一种寡聚丝氨酸蛋白酶,既定位于线粒体内膜,也定位于内质网,在生理条件下能矫正折叠蛋白的错误构像,或利用其蛋白酶活性将其裂解,防止细胞内α-syn等蛋白积聚。在应激介质诱导时其保护功能转变为促凋亡功能,导致细胞损伤[16]。因此,本研究选择active caspase3和XIAP两个相互拮抗的蛋白及Omi/HtrA2,了解6-OHDA和ALA对PC12细胞的促凋亡和抗凋亡的关系。与对照组比较,PD模型细胞的active caspase3、Omi/HtrA2的表达水平明显增加,XIAP的表达明显下降,提示线粒体的caspase途径也参与了PD模型细胞的凋亡。给予ALA干预模型细胞后,与PD细胞模型组相比active caspase3、Omi/HtrA2的表达水平明显下降,XIAP的表达明显升高,提示ALA可能通过减少了α-syn蛋白的集聚,下调Omi/HtrA2的表达,XIAP表达增高阻断caspase3的激活减轻模型细胞的凋亡。
本实验研究提示,ALA可能通过以下2种机制减轻PD模型细胞的凋亡,保护多巴胺神经元:降低α-syn未折叠或错误折叠蛋白在内质网的积聚,减少ERS,下调GRP78的表达,抑制CHOP的转录,防止细胞凋亡通路的触发;下调Omi/HtrA2的表达,增加XIAP的表达,抑制Caspase 3的激活,抑制模型细胞的凋亡。综上所述,ALA可能是通过减少PD模型细胞α-syn集聚,抑制内质网应激启动的细胞凋亡途径,以及下调Omi/HtrA2抑制线粒体caspase凋亡途径,从而对多巴胺神经元退行性改变起到一定的保护作用。
