浆细胞瘤转化迁移基因1在结直肠癌患者血浆中的表达与临床意义
2018-10-09周改周朦冯雯杨萧天顾漱溟章美婷徐岷
周改, 周朦, 冯雯, 杨萧天, 顾漱溟, 章美婷, 徐岷
(江苏大学附属医院 1. 消化内科; 2. 呼吸内科, 江苏 镇江 212001)
结直肠癌是近几十年来发病率和死亡率在大多数国家和地区上升最快的肿瘤之一[1]。结直肠癌早期症状不明显,一般会经历7~10年的从正常黏膜组织—腺瘤—早期癌—进展期癌的演变过程。如果患者在疾病的早期阶段或癌前腺瘤阶段得到明确诊断,超过95%的结直肠癌患者可通过手术治愈[2]。长链非编码RNA(long non-coding RNA,lncRNA)是一类转录本长度超过200个核苷酸的RNA分子。研究发现,lncRNA可作为诊断和预后的生物学标志物,可在组织、血清和尿液中检出[3-4]。浆细胞瘤转化迁移基因1(plasmacytoma variant translocation gene 1,PVT1)是近几年发现的定位于染色体8q24区的lncRNA,在结直肠癌组织及细胞中呈高表达[5],但在结直肠癌患者外周血中的表达情况尚不清楚。为此,本研究旨在检测PVT1在结直肠癌患者血浆中的表达并分析其与临床病理参数的关系,并将结直肠癌患者术前及术后血浆中PVT1的表达水平进行比较。
1 材料与方法
1.1 临床资料
选取自2016年5月至2017年7月在江苏大学附属医院住院的结直肠腺瘤患者30例和结直肠癌患者90例。结直肠腺瘤患者中,男20例,女10例;年龄45~84岁,平均(62.40±10.83)岁。结直肠癌患者中男45例,女45例;年龄38~86岁,平均(66.98±10.65)岁。所有患者均经组织病理学确诊,且术前均未接受任何抗肿瘤治疗。另选择同期本院体检中心的健康体检者42例作为对照组,其中男23例,女19例;年龄37~85岁,平均(64.43±10.31)岁。
为明确及进一步判断血浆PVT1表达水平能否有效鉴别早期结直肠癌患者与健康对照者,将结直肠癌患者进一步划分为TNM Ⅰ/Ⅱ期(早期)及TNM Ⅲ/Ⅳ期(进展期)2组。TNM分期按照国际抗癌联盟(UICC)第七版标准进行:Ⅰ/Ⅱ期40例,Ⅲ/Ⅳ期50例。本研究经江苏大学附属医院伦理委员会批准,所有标本采集前均征得受试者知情同意。
1.2 主要试剂和仪器
Trizol试剂(美国Life公司);ChamQTM SYBR®qPCR Master Mix(Low ROX Premixed) 试剂盒、反转录酶M-MLV(H-)Reverse Transcriptase(R021- 01)试剂盒购自诺唯赞生物科技有限公司;lncRNA PVT1与内参基因5S RNA引物由上海生工生物工程有限公司合成。主要仪器包括NanoDrop 2000 紫外分光光度仪(美国Thermo公司),7500型实时荧光定量PCR仪(美国ABI公司)。
1.3 样本收集
采集患者、健康体检者以及接受外科病灶切除手术治疗2~3周后配对的同一结直肠癌患者(29例)清晨空腹头臂静脉血约5 mL,置于EDTA-K2抗凝真空管中;3 h内于4 ℃,16 000×g,离心10 min;取上清液于无RNA酶的1.5 mL EP管中;4 ℃ 1 600×g再次离心10 min彻底去除细胞成分;重新收集上层血浆至新的无RNA酶的EP管中,-80 ℃保存备用。
同时收集患者及健康体检者的临床及随访资料用于病理参数分析。
1.4 总RNA的提取与反转录
将血浆置于冰上解冻后,取400 μL按照试剂说明书使用Trizol试剂提取总RNA。用紫外分光光度仪测定提取RNA的浓度和纯度。选取D(260 nm)/D(280 nm)在1.8~2.0的样品进行反转录,反应程序:25 ℃ 10 min,42 ℃ 45 min,70 ℃ 15 min。cDNA样本置于-20 ℃保存备用。
1.5 荧光定量PCR(qPCR) 检测血浆中 PVT1的表达
以反转录获得的cDNA为模板,采用qPCR检测PVT1及内参5S RNA的表达水平。PVT1引物序列:上游5′-AGCCAGTCTTGGTGCTCTGT-3′,下游5′-GCCTCAGTGAACTCCTCAGC-3′。内参5S RNA引物序列:上游5′-GTCTACGGCCATACCACCCTGAA-3′,下游5′-AAGCCTACAGCACCCGGTATTCC-3′。反应程序为95 ℃ 1 min;95 ℃ 10 s,60 ℃ 30 s,40个循环;95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。最后得到扩增曲线和熔解曲线,读取各样本中目的PVT1及内参5S RNA的循环阈值(Ct值),即扩增产物量达到临界阈值时所对应的循环数。通过ΔCt方法计算各目的基因的相对表达值,作为评估目的lncRNA在疾病组和健康对照组中表达差异的指标,ΔCt值越小表示该目的lncRNA的相对表达水平越高[6],以对照组为参照,低ΔCt值表明其在血浆中表达上调;高则下调。此外,采用2-△△Ct方法计算结直肠癌患者术前和术后血浆中PVT1的相对表达水平[7]。ΔCt=CtPVT1-Ct5S RNA,△△Ct=△Ct疾病组-△Ct对照组,疾病组包括术前患者组和术后患者组。实验中以96孔板进行样本筛选,每个样本设3个复孔,结果取平均值。
1.6 统计学分析
采用SPSS 23.0统计软件进行统计学处理。相应的实验数据图采用GraphPad Prism 5.0软件绘制。数据分析采用非参数统计学方法,两组间比较采用非参数Mann-WhineyU检验,多组间比较采用Kruskal-WallisH检验,数据以中位数(四分位数)[M(P25,P75)]表示。术前与术后血浆中PVT1表达水平的比较采用配对样本t检验。利用受试者工作特征曲线(receiver operator characteristic curve,ROC)评价PVT1、癌胚抗原及二者联合检测对结直肠癌的诊断效能,同时计算其相应的灵敏度、特异度。Youden指数(灵敏度+特异度-1)用于确定最佳截断值。P<0.05(双侧)为差异有统计学意义。
2 结果
2.1 PVT1在结直肠腺瘤、结直肠癌患者血浆中的表达
如图1所示,与健康对照组相比,PVT1在结直肠腺瘤组(Z=-3.324,P<0.01)及结直肠癌组(Z=-5.135,P<0.01)的表达明显升高,且PVT1在结直肠癌组的表达明显高于结直肠腺瘤组(Z=-2.188,P=0.029)。此外,PVT1在TNM Ⅰ/Ⅱ期结直肠癌患者血浆中的表达较健康对照组明显升高(Z=-4.184,P<0.01);但TNM Ⅰ/Ⅱ期和Ⅲ/Ⅳ期二组间PVT1的表达差异无统计学意义(P>0.05)。
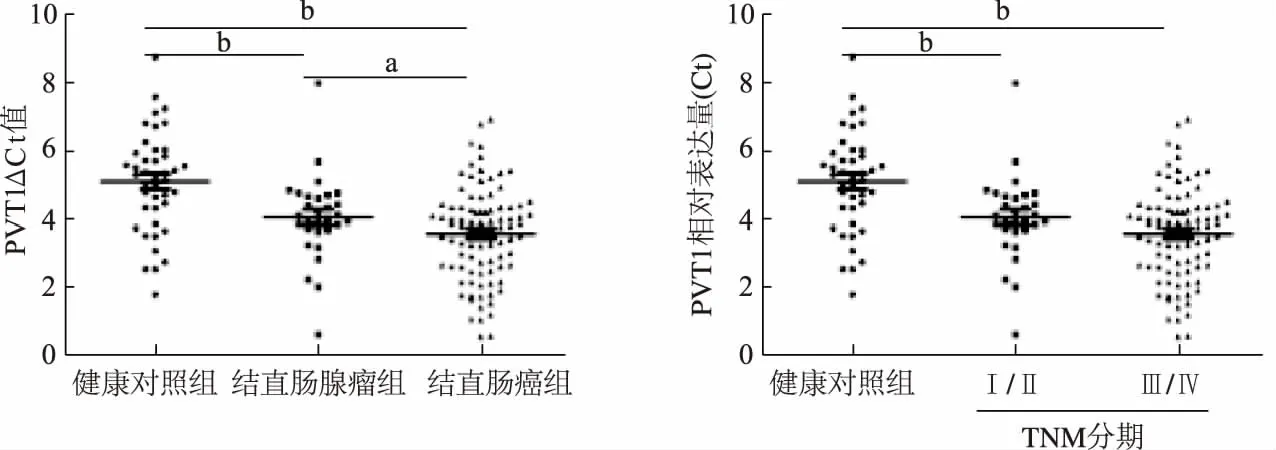
a:P<0.05, b: P<0.01;ΔCt值越小代表表达量越高
2.2 结直肠癌患者术前及术后血浆中PVT1的表达
如图2所示,结直肠癌患者术后血浆PVT1的表达水平(1.35±0.87)较术前表达水平(3.64±3.15)明显降低(t=4.258,P<0.01)。
2.3 结直肠癌患者血浆中PVT1表达水平与临床病理参数的关系
分析结果显示,结直肠癌患者血浆中PVT1相对表达量与患者年龄、性别及肿瘤部位、大小、分化程度,有无淋巴结转移及远处转移等临床特征无明显相关性(P均>0.05)。见表1。

图2 结直肠癌患者术前及术后血浆中PVT1表达水平的比较
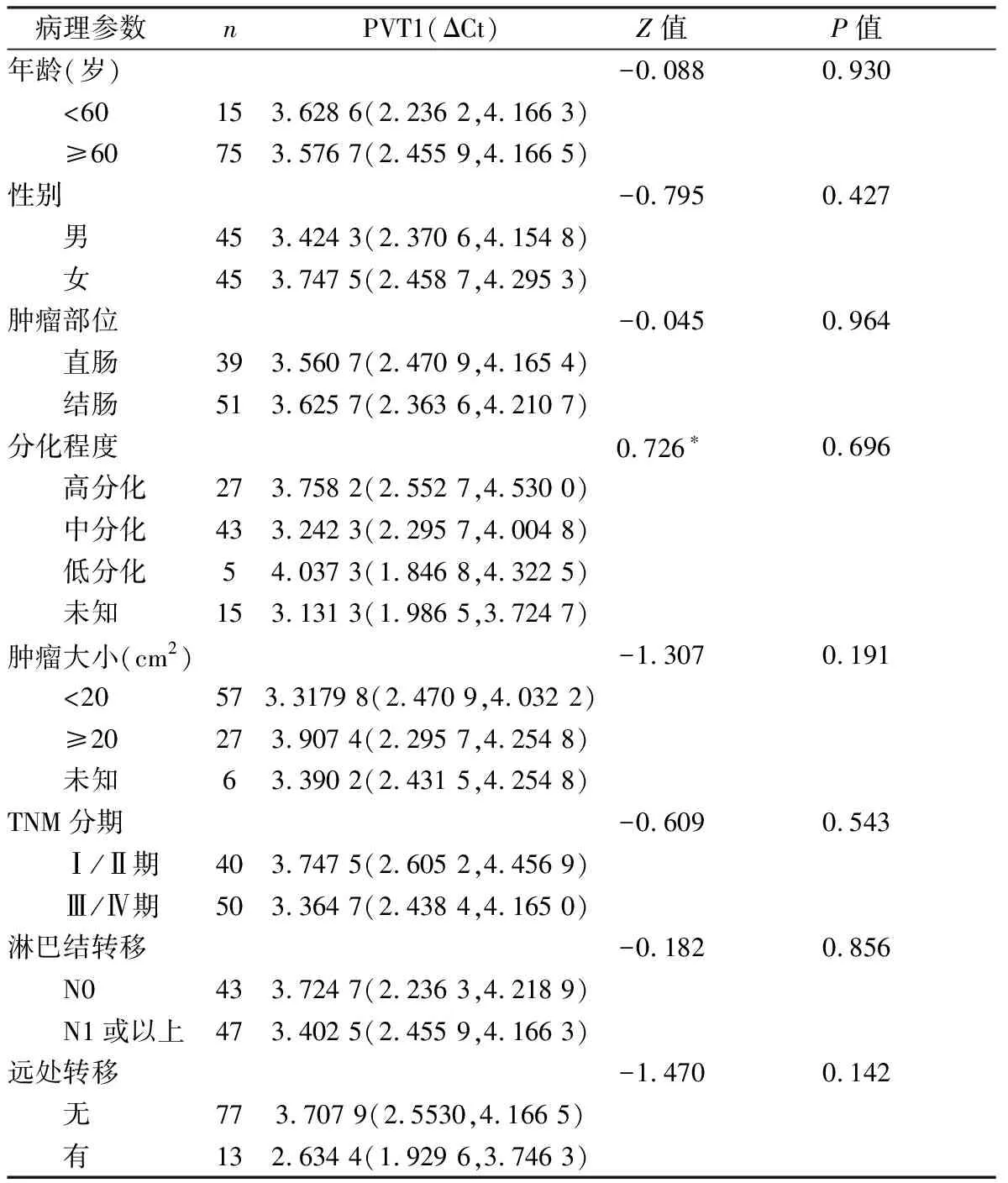
表1 结直肠癌患者血浆中PVT1的表达水平与临床病理参数的关系 M(P25, P75),n=90
*:Kruskal-WallisH检验
2.4 血浆PVT1对结直肠癌的诊断价值分析
ROC曲线分析显示(图3),血浆PVT1诊断结直肠癌,特别是TNM Ⅰ/Ⅱ期结直肠癌的AUC值(0.781,0.768)均高于传统肿瘤标志物癌胚抗原(0.745,0.733)。尽管在最佳截断点血浆PVT1诊断结直肠癌及TNM Ⅰ/Ⅱ期结直肠癌的特异性(71.4%,76.2%)均低于癌胚抗原(97.6%,90.5%),但其对结直肠癌及TNM Ⅰ/Ⅱ期结直肠癌的诊断敏感性(78.6%,71.1%)较癌胚抗原均显著升高。此外,血浆PVT1联合癌胚抗原后诊断结直肠癌及TNM Ⅰ/Ⅱ期结直肠癌的AUC值分别为0.863和0.854,较单独检测PVT1或癌胚抗原均升高,且二者联合后对结直肠癌的诊断特异性较单一指标PVT1明显升高,对TNM Ⅰ/Ⅱ期结直肠癌的诊断敏感性也明显提高。见表2和表3。
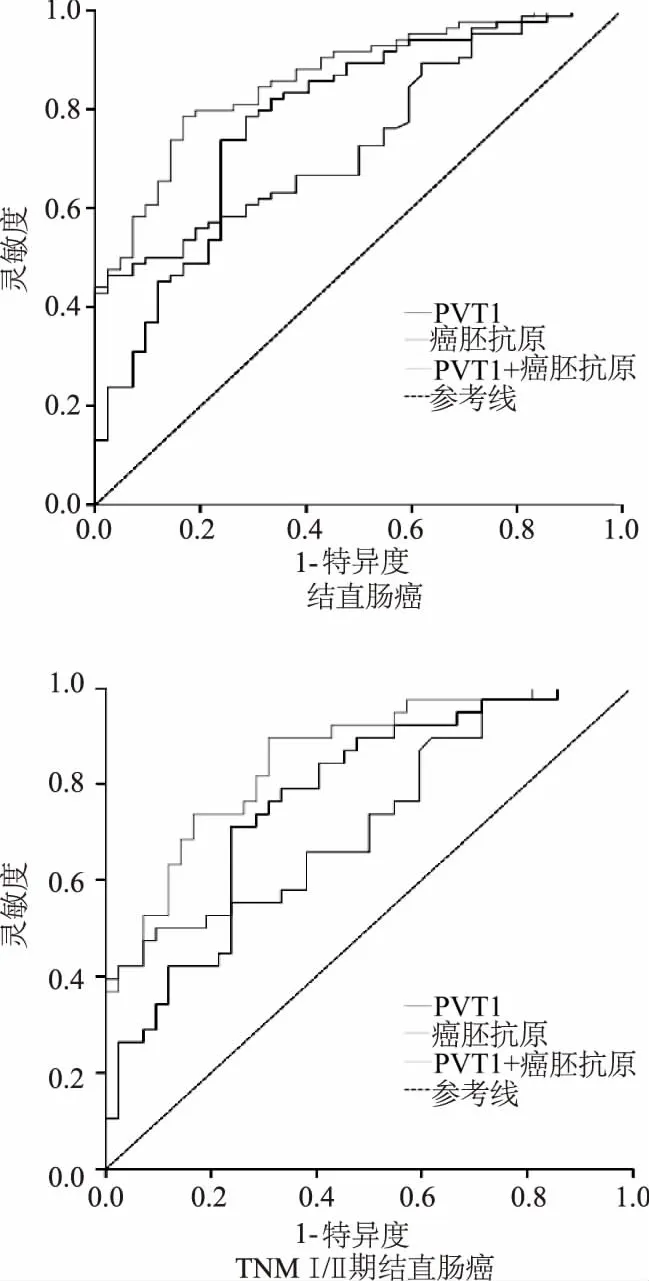
图3 血浆PVT1与肿瘤标志物癌胚抗原单独及联合后诊断结直肠癌的ROC曲线比较

指标AUC灵敏度(%)特异度(%)截断值P值95% CIPVT10.78178.671.40.500<0.010.693~0.869癌胚抗原0.74546.497.60.440<0.010.661~0.830PVT1+癌胚抗原0.86378.683.30.619<0.010.799~0.926

表3 血浆PVT1在TNM Ⅰ/Ⅱ期结直癌中的效能评价
3 讨论
已证实lncRNA在肿瘤的发生发展中具有重要作用,包括结直肠癌[8-10],大量研究表明,即使经过长时间的室温放置、反复冻融、强酸、强碱或RNA酶A的消化处理,在血清或血浆中仍可检测到稳定的循环lncRNA存在[4,11-12]。已证实lncRNA PVT1在恶性肿瘤如胃癌[13]、肝癌[14]、宫颈癌[15]、黑色素瘤[16]等患者的血清/血浆中呈差异性表达。本研究结果显示,PVT1在结直肠腺瘤及结直肠癌患者血浆中的表达均明显升高,且在结直肠癌组的表达较癌前病变组升高明显,这有利于临床诊断中根据PVT1的相对表达水平判断结直肠疾病的严重程度,有助于早期发现腺瘤性息肉患者,从而通过早期切除息肉将大大降低结直肠癌的发病率,改善结直肠疾病患者的预后。此外,PVT1在TNM Ⅰ/Ⅱ期及TNM Ⅲ/Ⅳ期结直肠癌患者血浆中表达均高于对照组,但TNM Ⅰ/Ⅱ期及TNM Ⅲ/Ⅳ期间表达差异无统计学意义,这种循环lncRNA在癌前病变及癌变患者血浆中存在差异性表达,却并不随肿瘤恶性程度增高而表达量增高的现象,可能与lncRNA的分泌及其在癌前病变及癌症患者外周血中存在的机制不同有关;此外,还可能与肿瘤患者间存在的异质性有关,但具体机制还有待进一步研究。
循环中的lncRNA可能主要来自肿瘤细胞或组织,待肿瘤切除后,外周血中特定lncRNA的水平将恢复至正常[17-18]。例如,胃癌患者术后15 d血浆中lncRNA-a174084的表达水平明显低于术前[19]。本研究结果显示,结直肠癌患者术后血浆中PVT1的表达水平较术前明显降低,表明PVT1可作为结直肠癌患者术后疗效监测的指标。外周血中异常表达的lncRNA与肿瘤患者的临床病理参数有关[20],而本研究中尚未发现血浆lncRNA表达水平与结直肠癌患者临床病理参数间的相关性,这可能与疾病的异质性、部分分组数量较少、组间偏倚较大等因素有关。
通过对ROC曲线及对AUC分析发现,血浆PVT1表达水平对结直肠癌,特别是相对早期的TNM Ⅰ/Ⅱ期结直肠癌均有较好的诊断价值。相比于传统肿瘤标志物癌胚抗原,PVT1诊断结直肠癌,特别是早期结直肠癌的敏感性更高,因此可用于结直肠癌高危人群的大规模筛查。鉴于肿瘤和人类均具有异质性,往往很难确定一个性能优异的单一理想生物标志物。癌胚抗原最初提取自结肠腺癌组织,但其不仅在胃肠道恶性肿瘤中呈高表达,在乳腺癌、肺癌等其他恶性肿瘤以及吸烟、妊娠、糖尿病、肝硬化等情况中也呈高表达[21]。研究表明,循环miRNAs与传统肿瘤标志物结合后可提高对癌症疾病的诊断能力[22]。仅仅采用一种循环lncRNA作为疾病诊断标志物往往缺乏特异性。研究证实,循环lncRNA与常规肿瘤标志物癌胚抗原、CA72-4等的联合应用对患者的诊断和预后有更好的提示作用[23]。本研究结果显示,血浆PVT1联合肿瘤标志物癌胚抗原后对结直肠癌以及其中的TNM Ⅰ/Ⅱ期结直肠癌的诊断效能均较单独检测PVT1或癌胚抗原升高。特别是二者联合检测后对TNM Ⅰ/Ⅱ期结直肠癌的诊断灵敏度提高,这将有利于在早期筛查出更多的肿瘤患者,从而改善预后。
由此得出,在结直肠癌患者血浆中异常高表达的lncRNA PVT1可作为结直肠癌早期诊断及术后疗效监测的潜在循环分子标志物。此外,血浆PVT1与传统肿瘤标志物癌胚抗原联合检测将更加有利于结直肠癌高危人群的早期筛查,从而降低结直肠癌发病率,改善患者生活质量。
