放置不同时间果核微量生物物证的提取
2018-10-08
(广州市番禺区公安司法鉴定中心,广东 广州 511400)
近年来,犯罪分子反侦察意识增强,留下的常规生物物证越来越少,DNA检验的主要对象逐渐转变为一些存在形式特殊、类型多样的非常规生物检材,即接触DNA。目前,接触DNA检验是法医DNA检验的难点和热点,其中接触DNA的发现和提取是影响检验成功率的主要因素之一[1]。本研究将苹果果核在自然环境下放置不同时间,采用擦拭法收集果核不同部位的微量DNA样本,对各样本的STR分型结果进行分析比较,旨在为基层单位微量生物物证的提取检验提供参考。
1 材料与方法
1.1 主要仪器与试剂
KingFisherTMFlex自动纯化系统(美国Thermo Fisher Scientific公司),9700型 PCR 仪、3130xl基因分析仪(美国AB公司),生物检材采集与保存套管(广州浩源实验器材科技有限公司),翻转式过滤管(长春市博坤生物科技有限公司)。ML-超微量磁珠法DNA提取试剂盒(长春市博坤生物科技有限公司),PowerPlex®21试剂盒(美国Promega公司)。
1.2 实验样本
样本准备:已知DNA分型的实验人员3名。第1周每人每天9时各啃食一个苹果,把果核置于自然环境(温度 18~26℃,湿度 40%~80%)下。1周后,每天获取的3枚果核相当于分别放置了1~7d。
样本采集:第2周周一9时对上述果核的咬痕部位和果皮部位(图1)用生物检材采集与保存套管内的棉签进行擦拭提取。每个部位提取两处,分为甲乙两组,同时保证每处的采集质量。
样本处理:甲组样本在采集后立即进行DNA检验;乙组样本置于套管中在自然环境(温度18~24℃,湿度43%~72%)下放置1周,于第3周周一进行DNA检验。

图1 放置4d的果核
1.3 检验方法
DNA提取:剪取各样本棉签的尖端,置于0.5mL翻转式过滤管中,加入160 μL消化液和14 μL蛋白酶K,颠倒混匀5次,置于56℃温浴1h,漩涡振荡混匀,以离心半径6cm,12000r/min,离心2min,将上清液加入KingFisherTMFlex自动纯化系统中,DNA洗脱体积为20μL,运行“BKHFZ160_ML”程序提取上述检材的DNA。
STR复合扩增及检测分析:使用PowerPlex®21试剂盒在9700型PCR仪上对21个STR基因座进行扩增。采用10μL扩增体系,包含:DNA模板3μL,去离子水3μL,反应混合物2μL,引物混合物2μL。所有扩增产物均取1 μL,使用3130xl基因分析仪进行毛细管电泳分离,GeneMapperTMID v3.2软件进行数据分析。完整的21个STR基因座包括20个常染色体STR基因座及Amelogenin基因座,本研究以检出11个及以上STR基因座和Amelogenin基因座为“有效检出”。分型成功的图谱要求获得的等位基因峰高大于100RFU,杂合子两个等位基因峰的峰面积比值大于70%[2],无或少杂峰等干扰因素。
1.4 统计学分析
采用SPSS 22.0软件对检出的果核咬痕部位和果皮部位甲乙两组的等位基因峰高均值分别进行单因素随机区组的方差分析,检验水准α=0.05。
2 结 果
2.1 果核形态学改变
随着放置时间的延长,果核咬痕部位颜色逐渐变深,果皮部位逐渐皱缩。放置2d后可见霉变、长出菌丝并散发果酸味,咬痕中间位置腐败较边缘位置严重。放置5d后腐败加剧并开始液化。
2.2 STR分型结果
放置不同时间果核不同部位DNA检出情况和等位基因峰高均值见表1~2。放置1~3d,果核咬痕部位均能检出21个基因座分型,但峰值逐渐降低,果皮部位也能检出21个基因座分型,但峰高均值较咬痕部位低。放置4~5d,咬痕部位部分基因座丢失,但仍能检出14~19个基因座分型(图2),果皮部位均能检出17~20个基因座分型(图3)。放置6~7d,咬痕部位未能检出有效基因型,果皮部位丢失基因座数量增加,可检出12~16个基因座分型,峰值较低。经统计学分析:果核咬痕部位和果皮部位在甲乙两组的等位基因峰高均值差异均无统计学意义(P>0.05)。
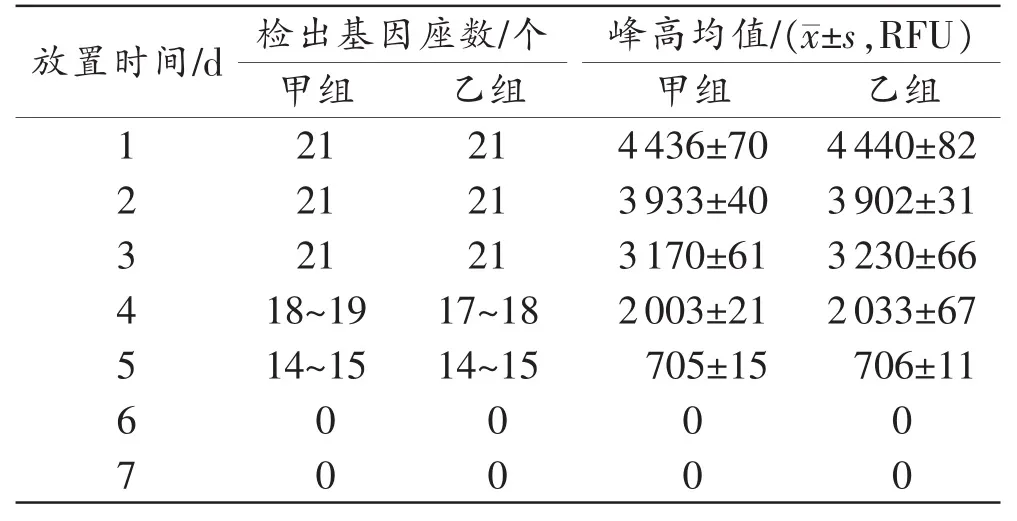
表1 果核咬痕部位STR分型结果 (n=3)

表2 果核果皮部位STR分型结果 (n=3)
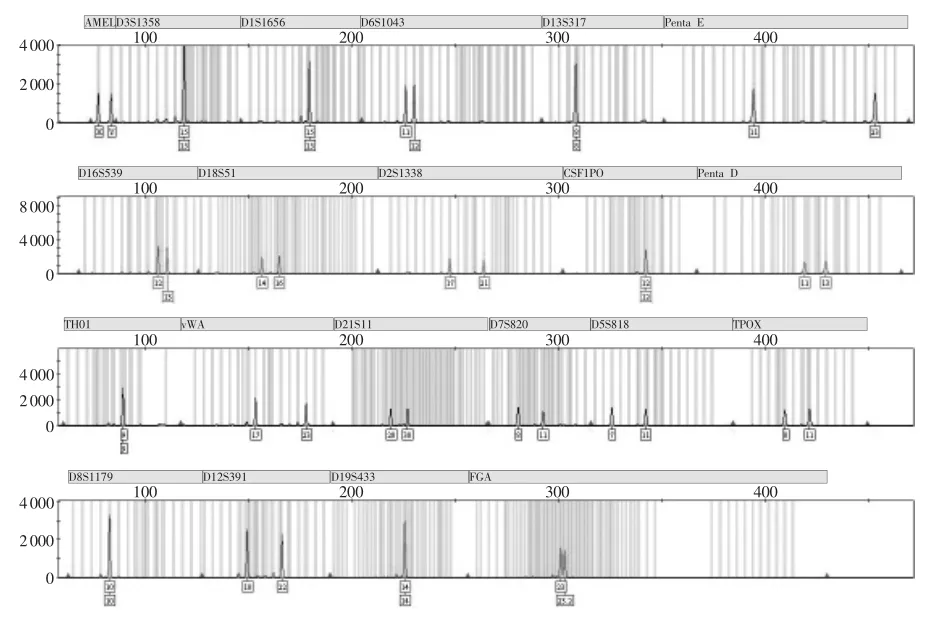
图2 放置4d果核咬痕部位STR分型结果
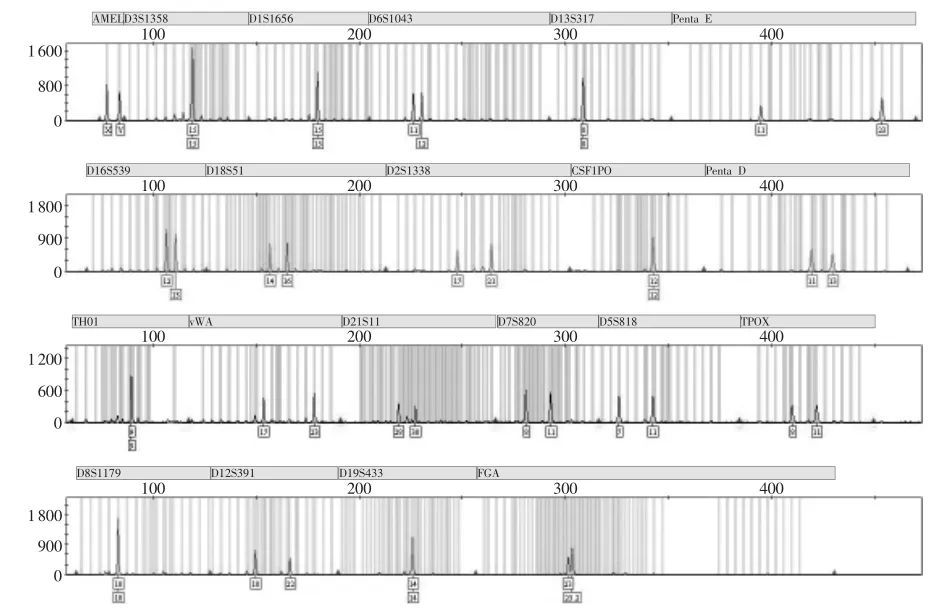
图3 放置4d果核果皮部位STR分型结果
3 讨 论
物质转移理论指出,凡是与人体接触过的各类客体都可能留下接触者的脱落细胞[3]。啃咬苹果等水果时,口腔黏膜和水果相互挤压摩擦,脱落细胞会留在果核上。由于口腔黏膜细胞多为有核的鳞状上皮细胞,含有完整的二倍体的核DNA基因组,因此果核完全可以作为生物检材用于DNA多态性检测分析[4]。
果核微量物证的采集质量决定其检验成功率的高低。苹果被啃咬后随着在空气中暴露时间的延长,植物细胞氧化分解作用加剧,果胶物质在酶的催化作用下进一步分解为果胶酸和甲醇。同时潮湿环境和水果含糖量高等因素,有利于细菌和霉菌生长繁殖,微生物分泌核酸酶,进一步加速了脱落细胞DNA的降解[5],从而导致检验成功率低。本研究观察到:果核咬痕位置较边缘位置湿润,且果肉损伤较大,导致其腐败速度快,脱落细胞DNA降解也更严重;果皮由于含有胶质成分,且位于边缘,易风干,不易腐败,脱落细胞DNA降解相对慢。同时,咬痕部位与唇黏膜接触时间长,脱落细胞留存的较多,而果皮表面光滑,口腔黏膜脱落细胞遗留相对少。上述可以解释果核放置相同时间咬痕部位的等位基因平均峰高高于果皮部位,而果皮在放置7d后仍能有效检出。马秀梓等[6]报道,果核上脱落细胞的采集使用棉签擦拭法提取检出率高。使用棉签擦拭果核时,应选取合适的部位旋转擦取,力度适中,范围适中,确保黏附尽量多的脱落细胞在棉签的某一点上,避免粘取到较多色素、果胶等杂质。
杨电等[7]研发的生物检材采集与保存套管内含有干燥剂,擦拭提取的棉签悬空密闭置于套管内,可有效防止检材霉变。本实验中果核同一部位采集的样本,采集后立即行DNA检验和在套管中保存1周后进行检验的STR分型结果差异无统计学意义,说明套管在自然环境下能较好地保存果核微量DNA。这适合基层单位现场果核微量DNA的提取保存,避免提取的检材因保存不当、送检不及时等造成污染、耗损及腐败等问题。
综上所述,基层单位现场勘验发现果核时,可根据其腐败程度选择提取部位,直接使用棉签擦拭法提取微量DNA并套管保存后送检,可改善DNA采集和保存质量,提高DNA检验效率。
