siRNA靶向沉默COX- 2对宫颈癌细胞VEGF、EGFR表达的影响
2018-09-18陈杰王莉王俊岭王慧
陈杰,王莉,王俊岭,王慧
周口市中医院妇产科,河南 周口4660000
宫颈癌是妇科常见的恶性肿瘤之一,发病率居所有女性恶性肿瘤的第2位,仅次于乳腺癌。近年来的调查显示,宫颈癌的发病率逐年升高,且呈年轻化趋势,对女性的健康造成严重的威胁[1]。宫颈癌的发病机制目前尚未统一,近年来以肿瘤血管作为切入点对肿瘤进行生物靶向治疗是目前研究的热点,其中表皮生长因子受体(epithelial growth factor receptor,EGFR)和血管内皮生长因子(vascular endothelial growth factor,VEGF)的靶向药物研究较多[2]。研究显示,EGFR和VEGF在肿瘤细胞中高度表达,在肿瘤细胞的增殖、转移、凋亡及细胞周期和血管生成等过程中发挥着重要作用[3]。本研究通过RNA干扰技术沉默HeLa细胞中环氧合酶-2(cyclo-oxygen-ase,COX-2)基因的表达,分析HeLa细胞中EGFR和VEGF的基因及蛋白表达水平,旨在为宫颈癌的治疗提供一定的理论依据,现报道如下。
1 材料与方法
1.1 材料、试剂与仪器
人宫颈癌HeLa细胞购自中科院细胞研究所。胎牛血清和0.25%胰酶溶液均购自美国Gbico公司;双抗(青霉素与链霉素)溶液、TBST溶液、DHanks溶液、聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜均购自美国Sigma公司;NIH3T3培养液、DMEM培养基和磷酸盐缓冲液(horseradish peroxidase,PBS)均购自美国Hyclone公司;鼠抗人COX-2、VEGF、EGFR单抗以及辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗鼠二抗均购自美国R&D公司;人COX-2siRNA、阴性对照siRNA均购自西宝生物科技(上海)股份有限公司。LipofectamineTM转染试剂盒、碘化丙啶(propidium iodide,PI)均购自美国Invitrogen公司;DAB显色试剂盒购自北京中杉金桥生物技术有限公司;RNA提取试剂盒和反转录试剂盒均购自北京天根生化科技有限公司;2×SYBR Mix和RT-PCR试剂盒均购自日本Takara公司;BCA蛋白浓度测定试剂盒购自美国Bio-red公司。CO2培养箱购自美国Thermo Scientific公司;低温高速离心机购自德国Beckman公司;Transwell小室以及半透明8 μm聚碳酸滤膜均购自德国Greiner公司;凝胶成像仪、PCR仪及电转仪均购自美国BioRad公司。
1.2 细胞复苏和培养
从-80℃超低温冰箱中取出冻存的HeLa细胞,室温下融化3 min后,加入含10%胎牛血清、50 U/ml双抗的DMEM培养液中,置于37℃、5%CO2培养箱中进行培养,每隔一日更换培养液,当细胞贴壁生长至80%时,加入0.25%胰酶消化1 min,随后加入2 ml含10%胎牛血清的DMEM培养液终止消化后,置于离心机中1000 r/min离心10 min,加入DMEM培养液进行传代培养,培养至第3代可用于后续研究。
1.3 COX- 2 siRNA转染
取生长至对数期的细胞,加入0.25%胰酶溶液进行消化,置于离心机中,1000 r/min离心10 min,收集细胞,在细胞培养板中培养细胞,将细胞浓度调整为2×105/L,置于37℃、5%CO2培养箱中进行培养,待细胞数量达到80%时,用于后续转染。用DMEM培养基漂洗细胞培养板,将已凋亡细胞去除,将7.5 μlCOX-2siRNA质粒(上游序列为5'-GGACUUAUGGGUAAUGUUA-3',下游序列为5'-CCUGAAUACCCAUUACAAU-3')和5 μl LipofectamineTM2000与DMEM培养液混匀作为转染组,室温下放置5 min,随后将两者混匀,室温下放置20 min为转染复合物,将制备好的转染复合物加入培养板中,随后再加入培养液定容至2 ml,同时设置空白对照组与阴性对照组,每组6个重复,空白对照组中仅加入细胞培养液,阴性对照组中加入阴性对照siRNA,置于37℃、5%CO2培养箱中培养。
1.4 RT-PCR法检测VEGF和EGFR基因的表达水平
应用RNA提取试剂盒提取HeLa细胞的总RNA,应用反转录试剂盒将RNA反转录为cDNA。VEGF上游序列为5'-AGCACGAGCTACCTCAG-3',下游序列为5'-TTTAGACATGCATGCATCGGCAGGAA-3';EGFR上游序列为5'-AGATAGTCGCCCAAAGTTCCG-3',下游序列为5'-GGGCACGAAGGCTCATCATT-3';COX-2上 游 序 列 为 5'-TTCAAATGAGATTGTGGGAAAATTGCT-3',下 游序列为5'-AGATCATCTCTGCCTGAGTATCTT-3'。以β-actin作为内参基因,上游序列为5'-AGCGAGCATCCCCCAAAGTT-3',下游序列为5'-GGGCACGAAGGCTCATCATT-3'。 反 应 体 系 :10 μl 2 ×SYBR Green Mix,上下游引物各 1 μl,ddH2O 8 μl,10×cDNA模板1 μl。反应条件:95 ℃ 3 min,94 ℃10 s,60 ℃ 20 s,72 ℃ 2 min,共30个循环,72 ℃10 min。利用CFX manager 3.0软件进行Cq值分析,以β-actin作为内参基因,按照2-ΔΔCq法计算基因的相对表达量。
1.5 Western blot检测VEGF和EGFR蛋白表达水平
采用D-Hanks溶液清洗细胞,加入蛋白裂解液在冰上裂解30 min,置于离心机中,1200 r/min离心10 min,收集上清液,利用BCA法测定蛋白浓度,随后制备8%分离胶和12.5%浓缩胶,蛋白上样量统一为30 μg,起始电压设置为80 V,样品进入分离胶后,电压调整为120 V,反应结束后将蛋白凝胶转移至PVDF膜上,4℃冰浴,电压设置为100 V,进行1 h转膜反应,加入TBST溶液进行清洗后,加入5%脱脂牛奶,37℃封闭1 h,清洗PVDF膜,每次10 min,共3次。加入一抗稀释液(COX-2、VEGF、EGFR),4℃振荡过夜,加入PBS溶液清洗3次,每次10 min,加入二抗稀释液(HRP标记的山羊抗鼠IgG抗体),室温下孵育2 h,PBS清洗后采用凝胶成像仪分析蛋白表达水平。
1.6 MTT法检测细胞增殖
将细胞置于37℃、5%CO2培养箱中分别培养12、24、48、72 h,培养结束后弃去原培养基,添加100 μl DMEM 溶液和 10 μl MTT 溶液 ,避光孵育4 h,弃去培养液后添加150 μl DMSO溶液,振荡10 min,使用酶标仪于570 nm波长下测定每孔的吸光度值。细胞增殖抑制率=(1-实验组吸光度值/对照组吸光度值)×100%。
1.7 流式细胞仪检测细胞的凋亡情况
细胞中加入0.25%胰酶进行消化,置于离心机中,1000 r/min离心10 min,收集下层细胞,加入含有10 μg/ml PI的 PBS 溶液 100 μl,重悬细胞后,在黑暗条件下染色30 min,采用细胞流式仪检测细胞的凋亡情况。
1.8 Transwell小室检测细胞的迁移和侵袭能力
采用24孔Transwell小室对细胞的迁移和侵袭能力进行评估,在小室下方加入NIH3T3细胞培养液作为趋化因子,并将小室插件如滤膜、底板等于小室下方固定好,在小室上方加入已培养24 h的3组细胞,每组设置6个复孔,将Transwell小室在37℃、5%CO2培养箱中培养8 h,将滤膜取出后,用棉签去除未迁移的细胞,在室温下加入70%甲醇固定40 min,采用苏木精染色,在显微镜下统计穿膜的细胞数目,采用Image Pro Plus 6软件分析细胞穿透率,细胞穿透率=穿膜数量/细胞总数×100%。
1.9 统计学方法
采用SPSS 21.0软件对数据进行统计学分析,计量资料以均数±标准差(±s)表示,两组间比较采用t检验,多组间比较采用单因素方差分析,以P﹤0.05为差异有统计学意义。
2 结果
2.1 COX- 2、VEGF、EGFR基因表达水平的比较
RT-PCR结果显示,转染组的COX-2、VEGF、EGFR基因表达水平均低于空白对照组和阴性对照组,差异均有统计学意义(P﹤0.05)。(图1)
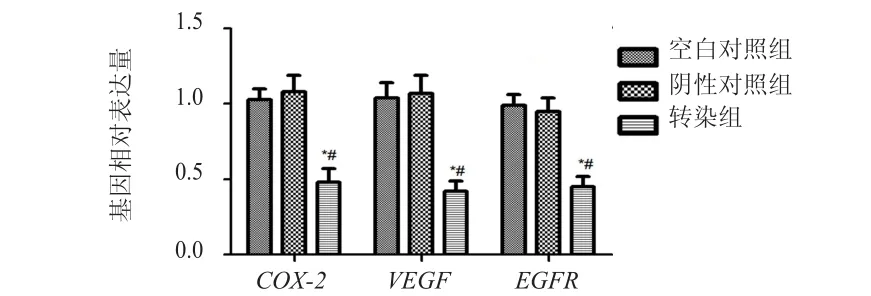
图1 3组HeLa细胞中COX- 2、VEGF、EGFR基因的相对表达量
2.2 COX- 2、VEGF、EGFR蛋白表达水平的比较
Western blot结果显示,空白对照组、阴性对照组及转染组的COX-2、VEGF、EGFR蛋白表达水平比较,差异均有统计学意义(F=40.399,P﹤0.01;F=51.649,P﹤0.01;F=51.765,P﹤0.01);转染组的COX-2、VEGF、EGFR蛋白表达水平均低于空白对照组和阴性对照组,差异均有统计学意义(P﹤0.05)。(图2、表1)
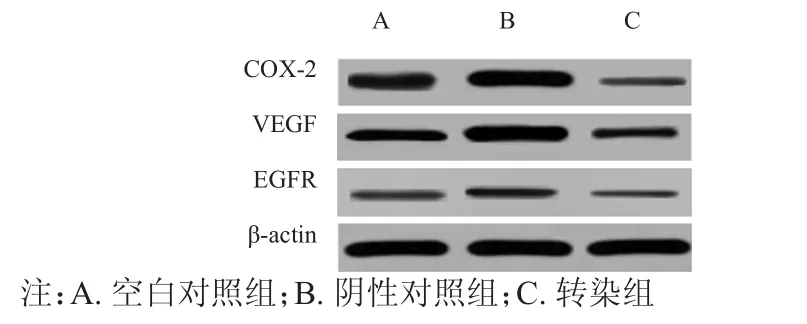
图2 Western blot结果图
表1 3组HeLa细胞的COX- 2、VEGF、EGFR蛋白表达水平(±s)
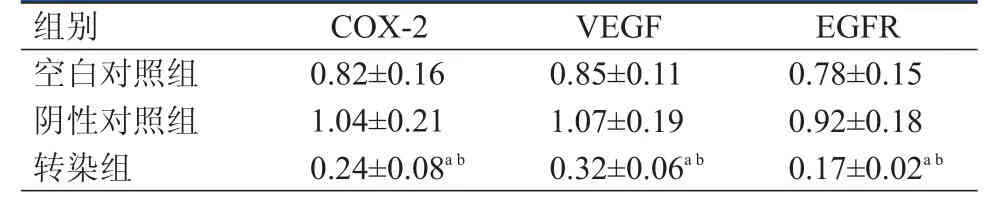
表1 3组HeLa细胞的COX- 2、VEGF、EGFR蛋白表达水平(±s)
注:a与空白对照组比较,P<0.05;b与阴性对照组比较,P<0.05
组别COX-2VEGF EGFR空白对照组阴性对照组转染组0.82±0.16 1.04±0.21 0.24±0.08a b 0.85±0.11 1.07±0.19 0.32±0.06a b 0.78±0.15 0.92±0.18 0.17±0.02a b
2.3 细胞增殖抑制率的比较
MTT检测结果显示,随着培养时间的延长,转染组的细胞增殖抑制率逐渐升高。不同时间点转染组的细胞增殖抑制率均高于空白对照组和阴性对照组,差异均有统计学意义(P﹤0.05)。(表2)
表2 3组HeLa细胞增殖抑制率的比较(%,±s)

表2 3组HeLa细胞增殖抑制率的比较(%,±s)
注:a与空白对照组比较,P<0.05;b与阴性对照组比较,P<0.05
组别12 h 24 h 48 h 72 h
2.4 细胞凋亡率的比较
流式细胞仪检测结果显示,转染组的细胞凋亡率为(31.08±4.03)%,高于空白对照组的(8.36±0.73)%和阴性对照组的(8.98±0.95)%,差异均有统计学意义(P﹤0.05)。(图3)
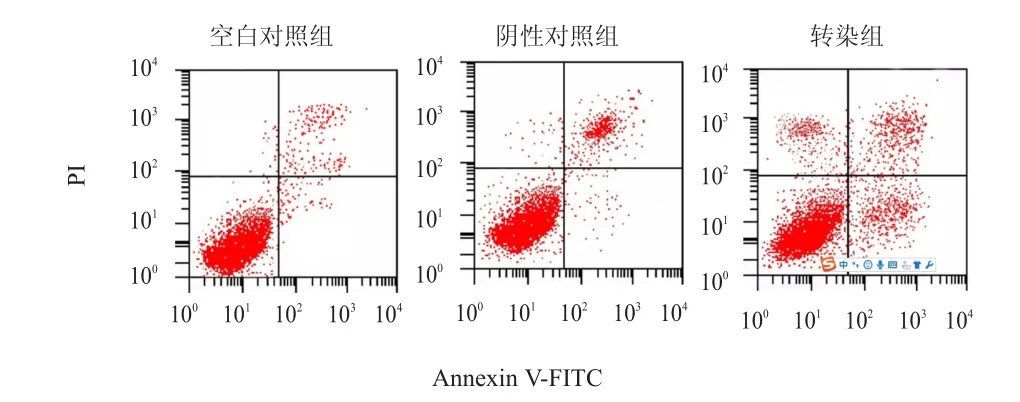
图3 流式细胞仪检测各组HeLa细胞的凋亡情况
2.5 细胞穿透率的比较
Transwell小室检测结果显示,空白对照组、阴性对照组及转染组的细胞穿透率比较,差异有统计学意义(F=20.003,P﹤0.01)。空白对照组与阴性对照组的细胞穿透率比较,差异无统计学意义(P﹥0.05);转染组的细胞穿透率低于空白对照组和阴性对照组,差异均有统计学意义(P﹤0.05)。(表3)
表3 3组HeLa细胞穿透率的比较(%,±s)

表3 3组HeLa细胞穿透率的比较(%,±s)
注:a与空白对照组比较,P<0.05;b与阴性对照组比较,P<0.05
组别 细胞穿透率
3 讨论
肿瘤的发生、发展较为复杂,至少涉及2种癌变基因相互协同发挥作用,共同促进细胞发生癌变。COX-2是机体前列腺素生成的关键限速酶,研究表明,COX-2在多种肿瘤组织中高表达,与肿瘤的发生和转移关系密切,同时在肿瘤细胞的迁移和侵袭中发挥重要作用[4]。研究表明,宫颈癌细胞中的COX-2能通过促进VEGF表达,进而促进肿瘤血管形成,实现肿瘤淋巴结的转移[5]。此外还有研究显示,EGFR可通过与含表皮生长因子(epidermal growth factor,EGF)的类纤维蛋白样细胞外基质蛋白 1(EGF-containing fibulin-like extracellular matrix protein 1,EFEMP1)结合,激活MAPK-VEGF信号通路,从而促进宫颈癌微血管生成[6]。因此,VEGF和EGFR可能为控制肿瘤细胞增殖及转移的重要靶点,如何降低VEGF和EGFR的表达,抑制肿瘤细胞增殖是目前的研究热点。
COX-2属于诱导酶,在正常组织中一般不表达,当细胞受到促癌剂、炎性介质、细胞因子及生长因子等的刺激后会出现高表达,其主要在转录水平上进行调控[7]。近年来的研究发现,COX-2过表达能够促进肿瘤血管形成,促进基质金属蛋白酶表达,进一步促进肿瘤的发展、侵袭和转移[8]。另有研究显示,COX-2在宫颈癌细胞中的表达异常升高,免疫组化染色结果说明COX-2主要在瘤变上皮细胞及恶性上皮细胞中表达,提示COX-2可能参与宫颈癌的发生[9-10]。此外还有研究显示,COX-2表达水平在淋巴结发生转移的宫颈癌患者中明显升高,表明COX-2与宫颈癌转移有关,且肿瘤复发患者中COX-2的表达水平高于未复发患者,提示COX-2与肿瘤细胞凋亡有关[11]。本研究结果显示,转染组的COX-2、VEGF、EGFR基因表达水平均低于空白对照组和阴性对照组,细胞增殖抑制率和凋亡率均高于空白对照组和阴性对照组,细胞穿膜率低于空白对照组和阴性对照组,差异均有统计学意义(P﹤0.05)。提示COX-2过表达在宫颈癌细胞的增殖、迁移及凋亡中具有重要意义。
VEGF在血管内皮生长及淋巴结转移中发挥着重要作用,尤其在胚胎发育时期高度表达,较多研究均证实VEGF表达上调能够促进肿瘤细胞增殖,增强肿瘤细胞的侵袭能力[12-13]。有研究报道,宫颈癌细胞中COX-2与VEGF的表达呈正相关[14]。相关学者将COX-2基因转染至人胃癌细胞中,进而诱导COX-2基因过表达,结果显示VEGF表达水平明显升高,当抑制COX-2基因表达时,VEGF基因的表达也受到抑制,提示COX-2基因能够调控VEGF基因表达[15]。研究显示,在乳腺癌以及大肠癌细胞中COX-2基因可以通过中间蛋白CCR-7调控VEGF表达,从而促进肿瘤细胞血管生成,提示两者在肿瘤细胞的形成中存在相互交叉的作用[16]。Deshpande等[17]研究显示,在头颈鳞癌细胞中COX-2过表达能够刺激VEGF的上调,进而促进淋巴血管生成。本研究结果显示,空白对照组和阴性对照组中VEGF均呈高表达,而转染COX-2siRNA后,VEGF的基因与蛋白表达水平均降低,且细胞穿膜率降低,增殖抑制率升高,表明siRNA干扰HeLa细胞中COX-2基因的表达后,COX-2基因表达水平降低,VEGF基因表达水平也降低,提示COX-2沉默后可能通过抑制VEGF的合成,抑制细胞迁移,进而诱导细胞凋亡。
EGFR属于跨膜蛋白,主要参与血管上皮形成,在细胞膜信号传递中发挥着重要作用。EGFR在多种肿瘤细胞的增殖、分化、迁移及侵袭中发挥重要作用,在胃癌、肝癌、乳腺癌、直肠癌及宫颈浸润癌中均呈现高表达。有研究显示,EGFR在鳞癌中呈强阳性表达,且与浸润深度呈正相关,与淋巴结转移呈正相关,表明EGFR在宫颈癌的浸润和转移中发挥重要作用,其过表达与宫颈癌细胞的高增殖、易转移有关,可作为宫颈癌患者预后的重要指标[18-19]。另有研究显示,EGFR参与肿瘤细胞血管生成,可以直接或间接刺激肿瘤细胞,EGFR为血管发生的受体,在肿瘤细胞血管表皮中表达[20]。本研究结果显示,EGFR在空白对照组和阴性对照组中均表达,转染COX-2siRNA后,EGFR的基因与蛋白表达水平均降低,且流式细胞仪检测结果显示,转染后能够明显诱导HeLa细胞凋亡,可能原因为COX-2基因沉默后通过下调EGFR基因表达,抑制HeLa细胞迁移,进而诱导HeLa细胞凋亡。
本研究采用细胞流式仪检测转染后HeLa细胞的凋亡情况,结果显示,转染组的细胞凋亡率高于空白对照组和阴性对照组,差异均有统计学意义(P﹤0.05);Transwell小室检测结果显示,转染组的细胞穿透率低于空白对照组和阴性对照组,差异均有统计学意义(P﹤0.05)。以上结果间接表明,COX-2能够促进肿瘤细胞的增殖和侵袭,可能是通过调控VEGF和EGFR的表达实现。
综上所述,siRNA靶向沉默HeLa细胞中的COX-2基因,能够抑制其基因及蛋白表达水平,同时使VEGF和EGFR的基因及蛋白表达水平降低,进一步降低HeLa细胞的迁移和侵袭能力,促进HeLa细胞凋亡。
