Shp 2对舌癌细胞恶性生物学行为的调控作用
2018-09-18张兵董斌封亚萍韩彦博杨新华于兵兵
张兵,董斌#,封亚萍,韩彦博,杨新华,于兵兵
1平顶山市口腔医院综合科,河南 平顶山467000
解放军第一五二中心医院2肿瘤科,3病理科,河南 平顶山4670000
口腔癌是中国目前发病率和病死率较高的恶性肿瘤之一,大部分属于上皮源性鳞状细胞癌,而在口腔鳞状细胞癌中,舌癌是发病率最高的口腔恶性肿瘤,与其他头颈部的恶性肿瘤相比,舌癌的浸润性强,恶化程度高,明显影响患者的咀嚼、吞咽、呼吸等重要功能,严重威胁着人类的生命健康[1]。目前,临床上主要采取以外科手术为基础的综合序列治疗方案,虽然越来越多的抗癌药物和靶向药物应用于舌癌治疗,但是由于舌癌具有高复发率和高远处转移率等特点[2],导致患者的5年生存情况并不理想,因此,寻找早期特异性肿瘤标志物对于提高对舌癌的早期诊断和预后评估能力具有十分重要的临床价值,是舌癌治疗领域长期研究的重点。舌癌的复发转移涉及诸多因素,是一个极其复杂的病理过程,Src同源磷酸酪氨酸磷酸酶2(Srchomology phosphotyrosinephosphatase2,Shp2)是参与调控细胞内蛋白质酪氨酸磷酸化水平的关键酶之一,广泛表达于细胞质中[3]。有研究显示,Shp2与多种肿瘤细胞的增殖、分化、侵袭、转移、凋亡等生物学行为密切相关[4],已经作为血液系统恶性肿瘤如白血病及实体肿瘤如乳腺癌、肺癌等临床诊断和预后评估的分子标志物[5]。但目前关于Shp2在舌癌组织中的表达及其可能的作用机制的研究尚未见明确报道。本研究通过探讨Shp2在舌癌组织中的表达及其对舌癌细胞恶性生物学行为的影响,为舌癌的临床诊断、预后提供新的研究思路,为临床治疗提供潜在的分子靶点,现报道如下。
1 材料与方法
1.1 标本来源
收集2017年1月至2018年2月于解放军第一五二中心医院病理科存档的石蜡包埋舌癌组织标本45例(由病理科医师对组织切片复检)和癌旁正常组织标本13例。舌癌组织标本取自29例男性患者和16例女性患者,患者的年龄为31~79岁,平均年龄为(58.7±7.9)岁。纳入标准:所有舌癌组织标本均经镜下病理组织检查证实;患者均为首次诊断,术前均未接受放化疗或其他相关抗肿瘤治疗。排除标准:合并其他部位的恶性肿瘤患者,合并其他严重干预本实验结果的重大疾病患者。
1.2 材料
人舌癌Cal-27细胞株购自中国科学院上海细胞库。Shp2抗体购自美国Abcam公司,LipofectamineTM2000脂质体转染试剂购自Invitrogen公司,聚合酶链式反应(polymerase chain reaction,PCR)引物和干扰小RNA(small interfering RNA,siRNA)干扰靶序列均由上海生工生物工程有限公司合成并提供,免疫组织化学染色试剂盒和二氨基联苯胺(diaminobenzidine,DAB)显色试剂盒均购自北京中杉金桥生物技术有限公司,质粒抽提试剂盒、cDNA合成试剂盒、荧光定量PCR试剂盒和细胞凋亡试剂盒均购自美国OMEGA生物公司,Opti-MEM、高糖DMEM培养基均购自美国GIBCO公司,0.25%胰蛋白酶-乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)细胞消化液购自北京钮因华信科技发展有限公司,胎牛血清(fetal bovine serum,FBS)和链霉素-青霉素双抗均购自美国Thermo Fisher公司,Trizol试剂购自美国Invitrogen公司,焦碳酸二乙酯(diethyl pyrocarbonate,DEPC)购自美国Sigma公司,磷酸盐缓冲液(phosphate buffer saline,PBS)、氯仿、异丙醇和无水乙醇均购自国药集团化学试剂有限公司,生理盐水购自安徽双鹤药业有限责任公司。
HERAcell150i型CO2细胞培养箱购自美国Thermo Fisher Scientific公司,Eppendorf 5427 R台式高速冷冻离心机以及各种型号的移液器购自德国Eppndorf公司,DI-CJ-2ND超净工作台购自北京东联哈尔仪器制造有限公司,实时定量PCR仪、iMake多功能酶标仪、SDS-PAGE电泳仪和电转膜仪均购自美国Bio-Rad公司,CX41倒置光学显微镜购自日本OLYMPUS公司,电子分析天平购自上海玉研科学仪器有限公司,Amersham电泳仪购自瑞典Bioscience公司,恒温水浴摇床和YCZ-40D型转移电泳槽均购自北京六一仪器厂,流式细胞仪和Transwell小室均购自美国Becton Dickinson公司,LAS-4000 mini凝胶成像数码分析系统购自日本FujiFilm公司。
1.3 实验方法
1.3.1 免疫组织化学检测 按照即用型链霉菌抗生物素蛋白-过氧化物酶(streptavidin-peroxidase,SP)试剂盒说明书进行操作。随机选择10个视野,观察Shp2在Cal-27细胞的阳性表达情况。Shp2的阳性着色表达于细胞浆,呈棕黄色表达。染色结果判定标准:根据细胞的染色强度评分,0分为无染色,1分为弱染色,2分为中度染色,3分为强染色,然后计算10个视野的平均染色分值。同时根据视野中阳性细胞所占百分比评分,阳性细胞数目所占比例为0计0分,阳性细胞数目所占比例﹤25%计为1分,阳性细胞数目所占比例为25%~50%计为2分,阳性细胞数目所占比例为51%~75%计为3分,阳性细胞数目所占比例>75%计为4分。两项积分相乘总分≤1分为“—”表达,2~5分为“+”表达,6~10分为“++”表达,﹥10分为“+++”表达。
1.3.2 细胞培养 将Cal-27细胞培养于含10%FBS的高糖DMEM培养基中,于含5%CO2、37℃的细胞培养箱中进行培养,24~48 h更换培养基,并观察细胞状态。每隔48 h传代1次。
1.3.3 Shp 2慢病毒干扰载体构建 选择pGMLVSB1 RNAi慢病毒载体,由上海吉玛公司构建并提供慢病毒重组质粒,并转染至感受态细胞DH5α中。挑取单个菌落,进行小量摇菌培养。采用质粒抽提试剂盒提取慢病毒重组质粒和包装质粒,并转染至293T细胞中,测定慢病毒滴度。
1.3.4 细胞转染 转染前1天,以5×105/孔细胞接种于6孔板中,培养24 h后,待细胞融合度达到50%~60%时,按照脂质体Lipofectamine 2000转染说明书进行转染操作。实验细胞分为3组:对照组,只加入LipofectamineTM2000,不进行转染;阴性组:转染siRNA-NC;Shp2-siRNA组:转染Shp2-siRNA。在EP管中分别加入5 μl预先配置的Shp2 siRNA或对照siRNA溶液,以及250 μl的无血清Opti-MEM培养基,混匀,室温放置10 min;另外,在5 μl LipofectamineTM2000 脂质体溶液中加入 250 μl的无血清Opti-MEM培养液,振荡混匀后,室温放置10 min;将上述两种溶液吹打混匀,室温放置30 min;将脂质体-质粒DNA复合液滴加至孔板细胞表面,置于37℃、5%CO2的细胞培养箱中培养24~48 h。提取细胞RNA及蛋白,验证目的基因的表达情况及转染效率。
1.3.5 噻唑蓝法检测 采用噻唑蓝(methylthiazolyldiphenyl-tetrazolium bromide,MTT)法检测细胞增殖能力。将3组Cal-27细胞(1×104/孔)单层接种至96孔板中,置于37℃、5%CO2的细胞培养箱中进行培养,每组设置8个平行孔,分别培养24、48、72、96 h后,加入20 μl的MTT,置于37 ℃、5%CO2的细胞培养箱中孵育4 h后,弃除上清液,每孔加入 200 μl的 二 甲 基 亚 砜(dimethyl sulfoxide,DMSO)溶液,孵育振荡反应5 min,置于显微镜下观察无紫色结晶物。采用全自动酶标仪在450 nm波长处检测细胞的光密度(optical density,OD)值,计算细胞增殖活性。实验重复3次。
1.3.6 Transwell实验 采用Transwell小室检测细胞的侵袭和迁移能力。将3组Cal-27细胞(1×104/孔)单层接种至Transwell小室内;从小室的侧空采用移液器加入500 μl含有10%FBS的高糖DMEM培养基;将Transwell小室置于37℃、5%CO2的细胞培养箱中培养48 h。苏木素染色,Transwell小室滤膜;置于倒置光学显微镜中计数。实验重复3次。
1.3.7 划痕实验 先用marker笔在6孔板背后,用直尺均匀地划横线,每隔0.5~1.0 cm划一道,横穿过孔。每孔至少穿过5条线;每孔加入约5×105个细胞;次日,待细胞贴壁后,标记划痕;用PBS洗细胞3次,去除划下的细胞,加入无血清培养基;置入37 ℃、5%CO2的细胞培养箱中培养。按0、6、12、24 h取样,拍照。实验重复3次。
1.3.8 流式细胞术检测 收集3组的Cal-27细胞,采用预冷的PBS洗涤细胞3次后,1000 r/min离心5 min,离心半径为19 cm。弃除上清液;加入500 μl的结合缓冲液重悬细胞,细胞数量约为1×104/ml;加入膜联蛋白V-异硫氰酸荧光素(annexin V-fluorescein isothiocyanat,Annexin V-FITC)5 μl,室温下避光孵育15 min;1000 r/min(离心半径19 cm)离心5 min,弃除上清液;加入500 μl的结合缓冲液重悬细胞;加入碘化丙啶(propidium iodide,PI)5 μl,室温下避光孵育15 min;1000 r/min离心5 min,离心半径为19 cm,弃除上清液;加入300 μl的结合缓冲液。根据细胞凋亡试剂盒的操作说明检测各组细胞的凋亡情况。实验重复3次。
1.3.9 蛋白质印迹法(Western blot) 收集对数期生长的细胞 1×107/ml,加入 100 μl的细胞裂解液,冰浴裂解30 min,3000 rpm离心15 min,取上清液;采用BCA试剂盒检测蛋白浓度。每孔道加入总蛋白50 μg,行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)约2 h。电转移至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜后,采用5%的脱脂奶粉封闭过夜,置于水平摇床中,4℃孵育一抗过夜(1∶500稀释),洗膜,加入辣根过氧化物酶标记的羊抗兔IgG(1∶10 000稀释),置于水平摇床中,室温下孵育1 h,洗膜,采用化学发光法检测膜上的蛋白表达条带,采用FluorChem FC3凝胶成像数码分析系统进行定量分析,以积分光密度(integral optical density,IOD)表示灰度值。
1.4 统计学方法
采用SPSS 19.0软件对数据进行统计分析。计量资料以均数±标准差(±s)表示,两组间比较采用t检验,多组间比较采用单因素方差分析;多组间两两比较采用q检验;计数资料以率(%)表示,组间比较采用χ2检验。以P﹤0.05为差异有统计学意义。
2 结果
2.1 不同组织中Shp 2的表达情况
舌癌组织中Shp2的阳性表达率为82.22%(37/45),明显高于癌旁正常组织的23.08%(3/13),差异有统计学意义(χ2=13.838,P﹤0.01)。
2.2 沉默Shp 2对Cal-27细胞增殖的影响
3组Cal-27细胞在不同时间点的OD值比较,差异有统计学意义(P﹤0.01)。空白对照组和阴性对照组Cal-27细胞在不同时间点的OD值比较,差异均无统计学意义(P﹥0.05);而Shp2-siRNA组中Cal-27细胞在各个时间点的OD值均低于空白对照组和阴性对照组,差异均有统计学意义(P﹤0.05)。(表1)
表1 沉默Shp 2后不同时间点Cal-27细胞OD值的比较(±s)
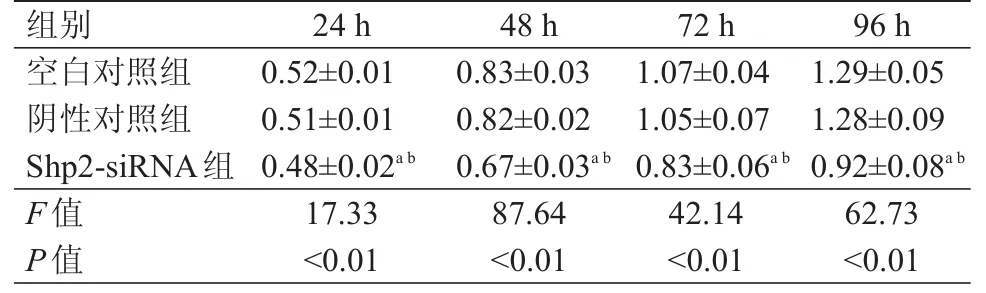
表1 沉默Shp 2后不同时间点Cal-27细胞OD值的比较(±s)
注:a与空白对照组比较,P<0.05;b与阴性对照组比较,P<0.05
组别24 h 48 h 72 h 96 h
2.3 Shp 2对Cal-27细胞体外侵袭能力的影响
空白对照组的侵袭细胞数量为(118.38±16.62)个,阴性对照组的侵袭细胞数量为(115.63±17.54)个,Shp2-siRNA组的侵袭细胞数量为(57.50±16.83)个,3组Cal-27细胞的侵袭细胞数量比较,差异有统计学意义(F=32.721,P﹤0.01)。空白对照组和阴性对照组Cal-27细胞的侵袭细胞数量比较,差异无统计学意义(P﹥0.05);而Shp2-siRNA组中Cal-27细胞的侵袭细胞数量低于空白对照组和阴性对照组,差异有统计学意义(P﹤0.05)。
2.4 沉默Shp 2对Cal-27细胞体外迁移能力的影响
3组Cal-27细胞在6、12、24 h的迁移率比较,差异均有统计学意义(F=7.75、16.62、106.72,P﹤0.01)。空白对照组和阴性对照组中Cal-27细胞在6、12、24 h的迁移率比较,差异均无统计学意义(P﹥0.05);Shp2-siRNA组中Cal-27细胞在6、12、24 h的迁移率均低于空白对照组和阴性对照组,差异均有统计学意义(P﹤0.05)。(表2)
表2 沉默Shp 2对Cal-27细胞迁移率的影响(%,±s)

表2 沉默Shp 2对Cal-27细胞迁移率的影响(%,±s)
注:a与空白对照组比较,P<0.05;b与阴性对照组比较,P<0.05
组别0 h 6 h 12 h 24 h
2.5 沉默Shp 2对Cal-27细胞凋亡的影响
干扰72 h后,Shp2-siRNA组Cal-27细胞的凋亡率为(16.14±3.17)%,空白对照组Cal-27细胞的凋亡率为(3.96±2.29)%,阴性对照组Cal-27细胞的凋亡率为(4.35±2.68)%,3组比较,差异有统计学意义(F=51.17,P﹤0.01)。与空白对照组比较,Shp2-siRNA组和阴性对照组的Cal-27细胞凋亡率均有所升高,差异均有统计学意义(P﹤0.05)。
2.6 沉默Shp 2对Cal-27细胞中凋亡相关蛋白p53、Bax和Bcl- 2表达的影响
3组Cal-27细胞中的p53、Bax和Bcl-2蛋白表达水平比较,差异均有统计学意义(F=21.59、21.56、18.22,P﹤0.01)。Shp2-siRNA 组中的 p53、Bax蛋白表达水平均高于空白对照组和阴性对照组,Bcl-2蛋白表达水平低于空白对照组和阴性对照组,差异均有统计学意义(P﹤0.05)。阴性对照组与空白对照组Cal-27细胞中p53、Bax和Bcl-2蛋白的表达水平比较,差异均无统计学意义(P﹥0.05)。(表 3)
表3 不同组别Cal-27细胞中 p53、Bax和Bcl- 2蛋白表达水平的比较(±s)
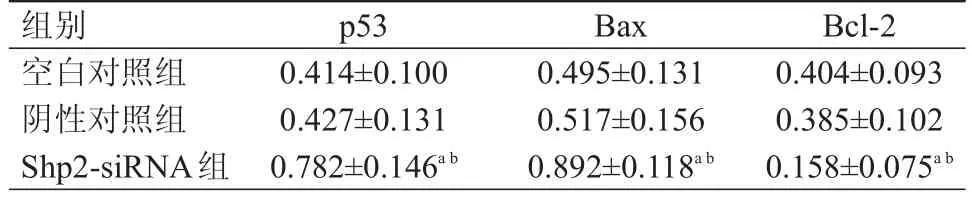
表3 不同组别Cal-27细胞中 p53、Bax和Bcl- 2蛋白表达水平的比较(±s)
注:a与空白对照组比较,P<05;b与阴性对照组比较,P<05
组别空白对照组阴性对照组Shp2-siRNA组p53 0.414±0.100 0.427±0.131 0.782±0.146a b Bax 0.495±0.131 0.517±0.156 0.892±0.118a b Bcl-2 0.404±0.093 0.385±0.102 0.158±0.075a b
3 讨论
目前,临床上关于头颈部恶性肿瘤仍以外科手术切除为主,配合化疗和放疗辅助治疗,寻找能够反映患者生理状况和细胞变化的生物标志物对于准确诊断疾病和评估预后具有十分重要的临床价值[6]。舌癌是常见的头颈部恶性肿瘤之一,恶化程度较高,预后差,尤其是晚期舌癌患者,易出现局部复发和远处转移,是治疗失败的主要原因[7],因此,早诊断、早治疗是改善患者预后、延长患者生存期的主要手段[8]。Shp2是由PTPN11基因编码的、广泛存在于细胞质中的非受体型酪氨酸磷酸酶,在多种肿瘤组织中呈过度活化状态[9-10]。本研究发现,舌癌组织中Shp2的阳性表达率明显高于癌旁正常组织(P﹤0.01),表明Shp2可能参与肿瘤的发生和发展过程。但是也有研究发现,Shp2在肝癌组织中呈低表达,发挥类似抑癌基因的作用[11]。因此,在不同的肿瘤细胞中,Shp2可能表现不同的生理活性。目前,国内外关于探讨Shp2在舌癌组织中的表达水平及其对肿瘤细胞恶性生物学行为的调控作用的研究尚少,因此,本研究着重探讨了Shp2在舌癌组织和癌旁正常组织中的表达及其对舌癌Cal-27细胞体外增殖、侵袭、迁移和凋亡的影响,探讨Shp2在舌癌中表达的临床意义。
本研究发现,Shp2在癌旁正常组织中呈低表达。另外,本研究结果显示,Shp2表达于细胞浆中,与有关研究结果类似[12],提示Shp2可作为舌癌诊断和治疗的潜在分子靶点。但是Tassidis等[13]通过免疫组织化学检测Shp2在前列腺癌细胞中的表达情况,结果发现,Shp2不仅在细胞质中的表达上调,而且在细胞核中也呈高表达,据推测,不同肿瘤组织中Shp2的表达部位有可能存在差异,因此,Shp2发挥的病理生理作用也可能不同。
RNA干扰技术是目前较为成熟的研究靶基因功能的实验室手段,可特异性剔除或关闭某种靶基因的表达;慢病毒载体是一类转染率较高的逆转录病毒载体,本研究通过采用RNA干扰(RNA interference,RNAi)技术,构建Shp2慢病毒干扰载体,探讨Shp2在Cal-27细胞中增殖、迁移、凋亡等体外生物学过程中的作用。细胞具有增殖、分化、衰老、凋亡等方面的特性,通过相互协调,共同维持正常的生理活动[14]。增殖失控和凋亡受到抑制是肿瘤细胞不同于正常细胞的生物学特点,即细胞增殖和凋亡失衡导致细胞数量异常增加,从而为肿瘤的形成提供关键的病理基础[15]。因此,肿瘤既是细胞增殖和分化异常的疾病,也是凋亡性疾病。本研究结果显示,Shp2基因沉默后,Cal-27细胞的增殖活性受到抑制,凋亡率增加,提示Shp2在促进舌癌细胞增殖和抑制细胞凋亡过程中发挥着重要的类似癌基因的作用。另外,Bax/Bcl-2、p53蛋白等是参与细胞凋亡的主要蛋白分子,其中,Bcl-2位于细胞凋亡调控通路的终末端,是最重要的促癌基因,具有抗凋亡作用。Bax是p53蛋白转录的靶基因,可作用于线粒体膜上的电压依赖性离子通道,具有促凋亡作用。p53通过上调Bax的表达,下调Bcl-2的表达共同完成促进肿瘤细胞凋亡的作用。本研究为了证实Shp2对细胞凋亡的影响,通过Western blot法检测了沉默Shp2基因后对Bax、Bcl-2、p53蛋白表达的影响。结果显示,转染Shp2siRNA干扰载体后,Cal-27细胞中p53和Bax的表达水平升高,而Bcl-2表达水平下降,提示Shp2抑制肿瘤凋亡的作用机制可能与p53调控的Bax/Bcl-2比例变化有关。另外,肿瘤细胞的侵袭和转移是舌癌患者预后不良的主要因素。有研究显示,Shp2在乳腺癌的侵袭和转移过程中具有正向调控作用,并通过调控细胞的黏附能力为乳腺癌细胞的侵袭和转移提供有利的条件[16]。本研究通过Transwell小室和划痕实验证实,Shp2基因沉默后,Cal-27细胞迁移能力降低,推测Shp2促进舌癌细胞侵袭和迁移的作用机制可能与抑制细胞凋亡、促进增殖及增加细胞黏附能力有关。
综上所述,Shp2在舌癌组织中的阳性表达率明显高于癌旁正常组织,采用慢病毒介导Shp2基因沉默后,Cal-27细胞的增殖、侵袭、迁移能力受到抑制,同时,凋亡能力增强,凋亡相关蛋白Bax、p53的表达上调,Bcl-2的表达下调,提示Shp2在舌癌组织中具有促癌基因的活性,可作为舌癌早期诊断、预后评估的分子标志物以及潜在的基因治疗靶点。
