沉水植物对阿特拉津胁迫的毒理响应
2018-09-17瞿梦洁朱锋李慧冬刘伟朱端卫
瞿梦洁,朱锋,李慧冬,4,刘伟,朱端卫,2,*
1. 华中农业大学资源与环境学院生态与环境工程研究室,武汉 430070 2. 生猪健康养殖协同创新中心,武汉 430070 3. 齐鲁工业大学(山东省科学院),山东省分析测试中心,山东省中药质量控制技术重点实验室,济南 250014 4. 山东省农业科学院农业质量标准与检测技术研究所,济南 250100
阿特拉津是种植玉米、高粱、甘蔗等农作物过程中控制与去除阔叶杂草和禾本科杂草的除草剂[1-2]。在使用过阿特拉津地区的土壤、饮用水、表层水和地下水中都已检测到该物质的残留。美国五大湖沉积物中检出的阿特拉津含量范围为0.01~1.7 ng·g-1[3]。在美国德克萨斯州、新墨西哥州和奥克拉荷马州湿地以及意大利亚得里亚海北部沿岸泻湖均有阿特拉津检出[4-5]。我国松花江流域和长江流域阿特拉津的检出率均为100%,长江中下游地区湖泊沉积物中阿特拉津含量为0.001~0.114 mg·kg-1[6-7]。阿特拉津会对水生生物造成一定的生态风险,地表水的除草剂污染已成为水生生态系统植物种群退化和消亡的主要因素之一[8]。
植物对环境的耐受力与各种抗氧化酶和抗氧化剂关系紧密,各种逆境胁迫都可诱发植物细胞内活性氧浓度的增加而导致氧化胁迫[9]。作为植物体内一种重要的非酶抗氧化剂和氧化还原物质,谷胱甘肽(还原型谷胱甘肽GSH或氧化型谷胱甘肽GSSG)是抗氧化系统的重要组成部分。谷胱甘肽S-转移酶(GST)能催化谷胱甘肽的共轭反应。还原型GSH能有效去除由污染物产生的超氧自由基对植物细胞的伤害[10]。为了抵消对还原型GSH的消耗,谷胱甘肽还原酶(GR)能在NADPH的作用下,催化氧化型GSSG重新生成还原型GSH[11]。有研究表明,除草剂嗪草酮和丙草胺均能促进玉米植株的氧化应激效应[12]。目前,对除草剂诱导水生植物中氧化应激效应的生态毒性测试很少。因此,研究阿特拉津胁迫下沉水植物的氧化应激效应对植物的耐受性研究具有重要意义。
水体中的沉水植物既是沉积物及其上覆水水质量的感受者,又是这一环境的改造者,植物对污染物的耐受性在维持淡水生态系统功能和结构的稳定中起着关键作用[13-14]。本实验选择沉水植物中的冬季优势种菹草(Potamogeton crispus)和夏季优势种穗花狐尾藻(Myriophyllum spicatum)为供试植物,探讨阿特拉津对沉水植物生长的影响,并深入研究阿特拉津胁迫下沉水植物的谷胱甘肽代谢途径对阿特拉津胁迫的应答。
1 材料与方法(Materials and methods)
1.1 实验材料
供试沉积物:采自武汉市武昌汤逊湖(N30°25′57″, E114°22′34″)。沉积物采回后过10目筛,以去除各种杂质,覆水静置备用。沉积物的pH值为6.74,有机碳含量为1.83%,阳离子交换量为7.89 cmol·kg-1。
供试植物:作为长江中下游地区最常见的2种沉水植物,菹草和穗花狐尾藻分别属于冬季优势种和夏季优势种[15-16]。本实验沉水植物菹草和穗花狐尾藻采自武汉市植物园,选用生长状态良好的成熟植株,采回后放入经太阳暴晒过的水中备用。
实验培养箱:用135 mm× 165 mm× 105 mm (内径×外径×高)的PVC盆放置沉积物并种植植物,再将PVC盆置于680 mm× 520 mm× 390 mm (长×宽×高)的熟胶材质水箱模拟天然水体环境。
阿特拉津:标准品购于德国Dr. Ehrenstorfer公司,纯度≥ 99.5%;称取100 mg阿特拉津,溶于1 L甲醇,配制成100 mg·L-1的阿特拉津-甲醇溶液。
高效液相色谱-串联质谱仪:Triple TOFTM4600 LC/MS/MS (AB SCIEX, USA)。
色谱柱:AlltimaTMC18 (250 mm × 4.6 mm × 5 μm) (上海安谱科学仪器有限公司,上海)。
1.2 实验设计
南湖沉积物中阿特拉津最高测定浓度为0.10 mg·kg-1[7],为保证阿特拉津对植物保持高浓度的逆境胁迫,快速得到阿特拉津对植物的毒理响应数据。将100 mg·L-1的阿特拉津-甲醇溶液分别取0、15、30和60 mL加入3 kg的沉积物中,机械混合,使沉积物中阿特拉津浓度分别达到0、0.5、1.0和2.0 mg·kg-1。分别取阿特拉津处理后沉积物1 kg加至PVC盆中,每个浓度处理设置3个重复。在沉积物中种植沉水植物,将种植植物后的PVC盆放置于水箱中,每个水箱中放置9盆相同阿特拉津浓度处理的植物,再以虹吸法加入暴晒后的自来水进行培养,使整个培养体系的水量达到120 L,并定期补充上覆水抵消蒸发。每盆种植的植物鲜重为12 g,各植株长度为20 cm。在培养的第30、60和90 天分别采集菹草和穗花狐尾藻鲜样,每次取3盆植物。
1.3 测定方法
1.3.1 植物体中阿特拉津定量测定及其衍生物定性分析
前处理:将植物鲜样冷冻干燥,称取2.00 g植物干样于50 mL离心管中,加入5 mL二氯甲烷振荡30 min,以4 000 r·min-1的转速离心5 min,取上清液后过0.22 μm的有机滤膜,经LC-18 (300 mg/3 mL, Supelco)固相萃取小柱纯化氮吹后待进样[7]。
样品采用Triple TOFTM4600 LC/MS/MS (AB SCIEX, USA)质谱仪测定,用Analysts软件控制程序。注射5 μL样品到C18 (AlltimaTM,250 mm × 4.6 mm, 5 μm)色谱柱中,保持35 ℃柱温,流动相速度为0.3 mL·min-1。流动相组成为(A) 水 (100%),(B) 甲醇 (100%);样品注入色谱柱之后,分析物用梯度洗脱程序洗脱:0 min (100% A), 0.5 min (90%A, 10%B), 6.0 min (10%A, 90%B),8.2 min (90%A, 10%B)。其中气体温度设置为325 ℃,气体流速为6 L·min-1,压力为45 psi,鞘气(高纯液氮)加热器为375 ℃,鞘气气流量为11 L·min-1,正极采用4 000 V毛细血管,用500 V电压充电。阿特拉津的出峰保留时间为6.90 min,阿特拉津与谷胱甘肽脱去谷氨酸(Cys-β-Ala)的配合物的出峰保留时间为5.95 min。
1.3.2 植物体中谷胱甘肽、GR和GST的测定
在冰浴条件下,称取0.5 g植物鲜样于3.0 mL的缓冲液(1 mmol·L-1EDTA + 5%偏磷酸)中匀浆。在4 ℃条件下,将匀浆液以11 500 r·min-1的转速离心15 min,取上清液测定谷胱甘肽含量[17]。GSSG和GSH含量参照 Griffith的方法测定[18],GSH 含量为总谷胱甘肽(T-GSH)与 GSSG 的差值,单位为μmol·(g fw)-1。
称取0.5 g植物鲜样与50 mmol·L-1磷酸盐缓冲液(pH 7.0)、100 mmol·L-1氯化钾溶液、1 mmol·L-1抗坏血酸溶液、5 mmol·L-1巯基乙醇和10%甘油在预先冷却的研钵中混合匀浆。将匀浆液以11 500 r·min-1的转速离心15 min,取上清液测定GR和GST活性[19],酶活性单位为U·mg-1。以上指标测定每处理重复3次。
1.4 数据处理和分析
各项指标测定每处理重复3次。数据分析与处理采用Mrcrosoft Excel处理,再用OriginPro 8.5和SPSS 18.0软件进行绘图及统计分析,所有结果均表示为平均值 ± 标准差(mean ± SD),方差分析采用Tukey显著性检验,当不同处理间有显著差异时,先标注最小值,图中误差线表示标准差。
2 结果(Results)
2.1 沉水植物体内阿特拉津浓度动态分析
植物根系能直接吸收污染物,污染物随蒸腾流沿木质部、韧皮部传输至植物茎和叶[20-21]。由图1可知,当沉积物中阿特拉津初始浓度为0.5、1.0和2.0 mg·kg-1时,在第30 天,菹草和穗花狐尾藻均能吸收一定量的阿特拉津。在培养达到60 d时,不同浓度处理的菹草体内阿特拉津含量均在减少(P < 0.05),但在高浓度下穗花狐尾藻体内阿特拉津仍在增加。在培养达到90 d时,2种沉水植物体内阿特拉津浓度基本为0。
2.2 沉水植物对阿特拉津污染胁迫的生物量响应
当沉积物中阿特拉津初始浓度为0 mg·kg-1和2.0 mg·kg-1时,考察阿特拉津对不同生长时期植物生物量的影响。从表1可知,整个实验周期中,沉水植物的长势基本良好,鲜重皆呈上升趋势。在培养的前60 d,未添加阿特拉津的沉水植物鲜重显著高于2.0 mg·kg-1阿特拉津处理的沉水植物鲜重(P < 0.05)。在第90天,阿特拉津初始浓度为2.0 mg kg-1时,菹草和穗花狐尾藻的鲜重分别达到(45.51 ± 3.12) g和(57.32 ± 3.46) g,有无阿特拉津,培养的沉水植物鲜重无显著差异(P > 0.05)。
2.3 沉水植物体内总谷胱甘肽(T-GSH)含量、GSH/GSSG比值及其形态变化
阿特拉津胁迫下,植物体内的T-GSH含量始终高于对照组,如图2(A1-A2)所示,穗花狐尾藻体内的T-GSH含量变化程度显著大于菹草的T-GSH含量变化(P < 0.05)。在整个培养过程中,2 mg·kg-1阿特拉津胁迫下沉水植物体内T-GSH含量显著高于其他低浓度处理组。
植物体内GSH/GSSG比值反映了植物对阿特拉津的氧化应激效应趋势,如图2(B1-B2)所示,植物体内GSH/GSSG比值随阿特拉津浓度升高基本呈下降趋势。胁迫60 d后,各处理植物体内GSH/GSSG比值有所回升,菹草的GSH/GSSG比值变化范围为1.10 ± 0.23~2.43 ± 0.15,穗花狐尾藻的GSH/GSSG比值变化范围为1.19 ± 0.12~2.43 ± 0.23,均低于空白对照的3.31。在胁迫90 d后,各处理植物体内GSH/GSSG比值继续回升,1.0 mg·kg-1与2.0 mg·kg-1阿特拉津处理下植物体内的GSH/GSSG比值无显著差异。与此同时,通过质谱图(图3)对沉水植物体内阿特拉津形态的定性分析得出,谷胱甘肽脱去谷氨酸(Cys-β-Ala)后能与阿特拉津耦合形成配合物(atrazine+(Cys-β-Ala)-HCl)。值得注意的是,在本实验研究的沉水植物体内,并未直接检测到谷胱甘肽与阿特拉津配合物。
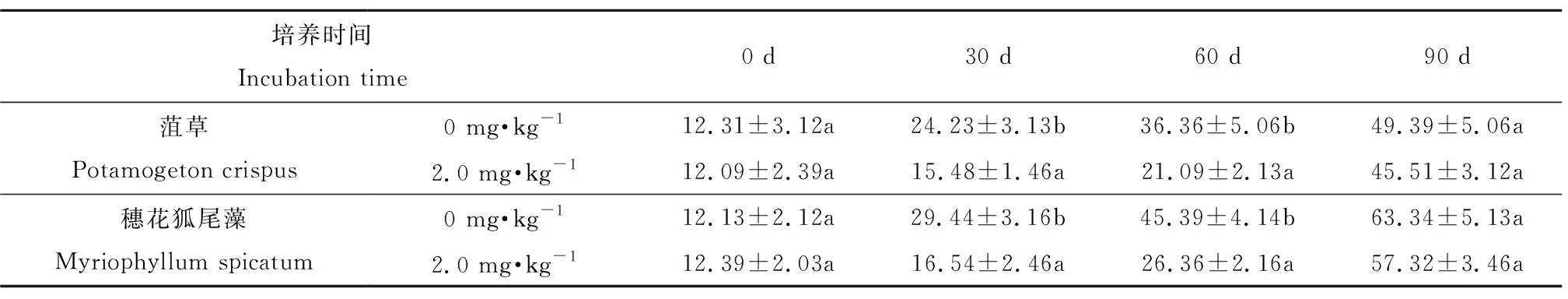
培养时间Incubation time0 d30 d60 d90 d菹草Potamogeton crispus0 mg·kg-112.31±3.12a24.23±3.13b36.36±5.06b49.39±5.06a2.0 mg·kg-112.09±2.39a15.48±1.46a21.09±2.13a45.51±3.12a穗花狐尾藻Myriophyllum spicatum0 mg·kg-112.13±2.12a29.44±3.16b45.39±4.14b63.34±5.13a2.0 mg·kg-112.39±2.03a16.54±2.46a26.36±2.16a57.32±3.46a
注:不同字母表示同列不同浓度处理间具有显著差异(P < 0.05)。
Note:The different letters indicate significant difference between treatments in the same column (P < 0.05).
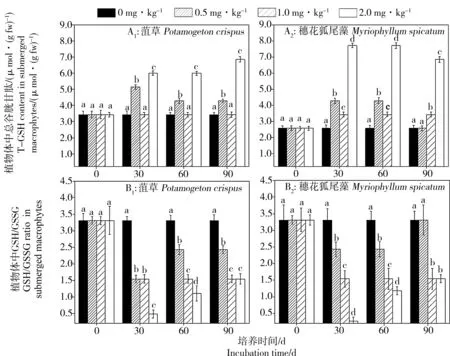
图2 阿特拉津胁迫下菹草和穗花狐尾藻体内T-GSH含量以及GSH/GSSG比值的变化注:图A1和图A2图柱中不同小写字母表示不同阿特拉津浓度处理间T-GSH差异显著(P < 0.05);图B1和图B2图柱中不同小写字母表示不同阿特拉津浓度处理间GSH/GSSG差异显著(P < 0.05)。Fig. 2 Effects of different levels of atrazine on T-GSH content and GSH/GSSG ratio of Potamogeton crispus and Myriophyllum spicatumNote: in Fig. A1 and A2 different lowercase letters represent significant differences among T-GSH contents in different atrazine treatments (P < 0.05); in Fig. B1 and B2 different lowercase letters represent significant differences among GSH/GSSG in different atrazine treatments (P < 0.05).
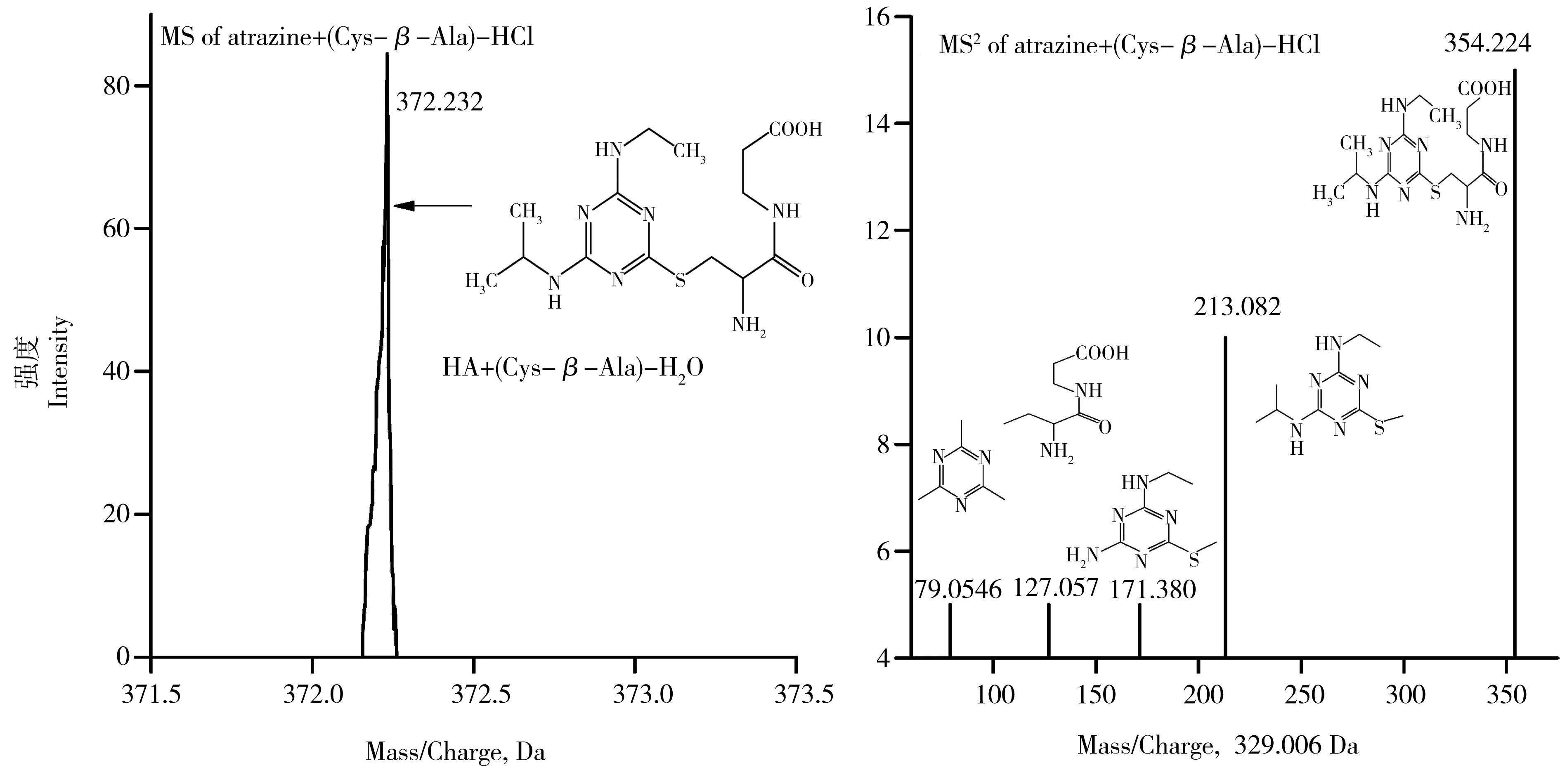
图3 阿特拉津与Cys-β-Ala配合物的一级与二级质谱图Fig. 3 MS and MS2 spectra of atrazine+(Cys-β-Ala)-HCl in plants from LC/MS/MS analysis
2.4 沉水植物体内的GR和GST活性动态变化
植物体内谷胱甘肽的形成主要受GR和GST活性的影响。从图4可知,阿特拉津的添加增加了GR在植物体内的活性。培养第30天时,在1.0和2.0 mg·kg-1阿特拉津处理下,菹草体内GR活性分别达到最大的(1.00 ± 0.05)和(1.14 ± 0.05) U·mg-1,穗花狐尾藻体内GR活性分别达到最大的(1.00 ± 0.03)和(1.43 ± 0.03) U·mg-1。不同于1.0和2.0 mg·kg-1阿特拉津处理下的GR活性变化,在60 d时,0.5 mg·kg-1阿特拉津处理下菹草和穗花狐尾藻体内的GR活性依旧保持增加,直到达到(0.86 ± 0.09)和(0.71 ± 0.08) U·mg-1的最大值。在90 d时,所有植株体内GR活性均达到整个培养阶段的最低值。
如图5所示,与GR活性变化类似,阿特拉津加强了GST在植物体内的活性,未添加阿特拉津的空白组GST活性保持(3.81 ± 0.65) U·mg-1不变。培养第30天时,在0.5、1.0和2.0 mg·kg-1阿特拉津处理下,菹草体内GST活性分别达到最大的(7.62 ± 0.99)、(15.24 ± 1.26)和(26.67 ± 2.35) U·mg-1,穗花狐尾藻体内GST活性达到最大的(7.62 ± 0.74)、(11.43 ± 0.86)和(22.86 ± 2.23) U·mg-1。在培养30~90 d时,草和穗花狐尾藻菹体内的GST活性逐渐降低。
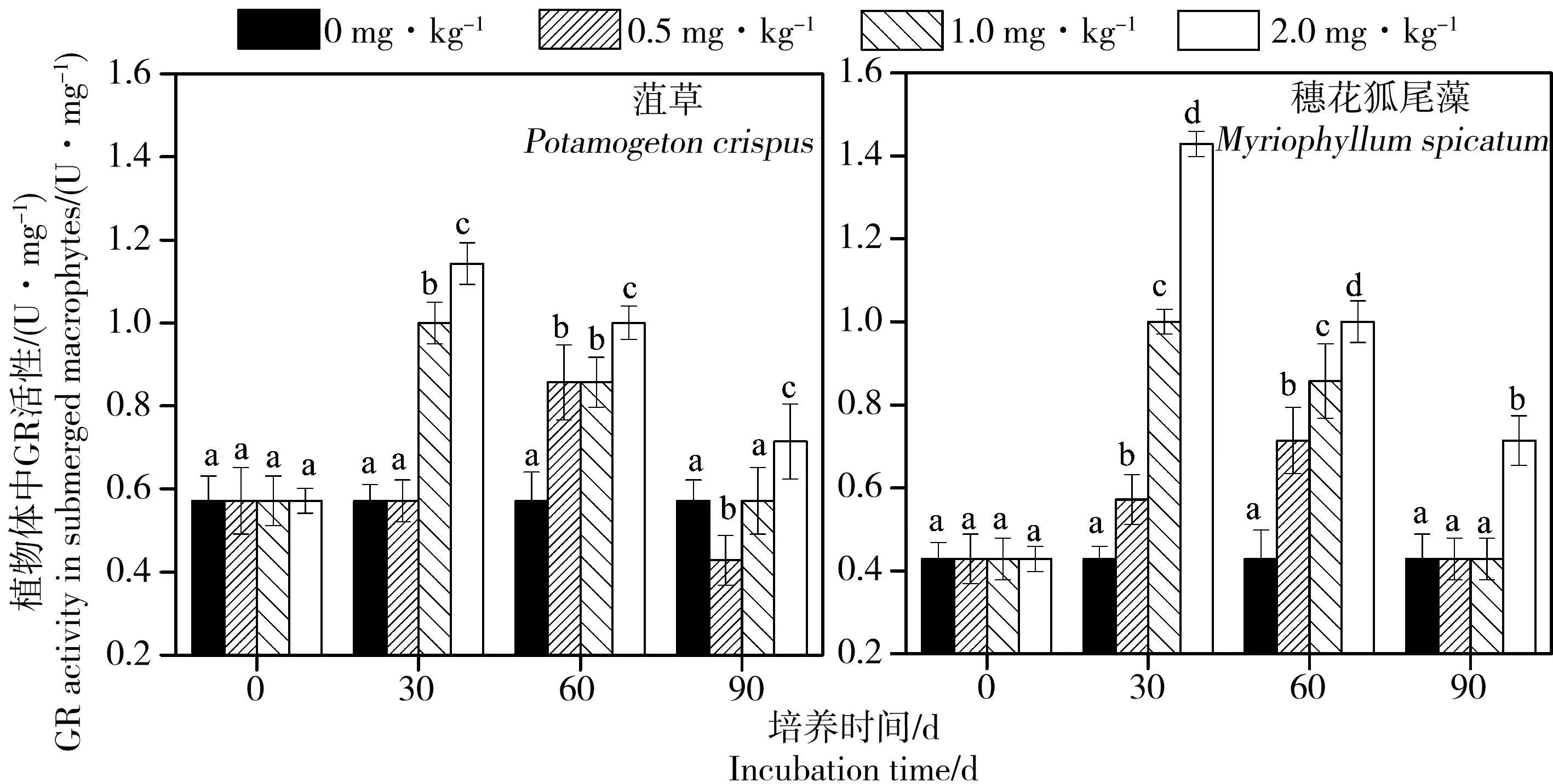
图4 阿特拉津胁迫下菹草和穗花狐尾藻体内GR活性的变化注:图中不同小写字母分别表示胁迫0、30、60和90 d时不同阿特拉津浓度处理间差异显著(P< 0.05)。Fig. 4 Effects of different levels of atrazine on GR value of Potamogeton crispus and Myriophyllum spicatumNote: Different lowercase letters represent significant differences among different atrazine treatments on days 0, 30, 60 and 90, respectively (P < 0.05).
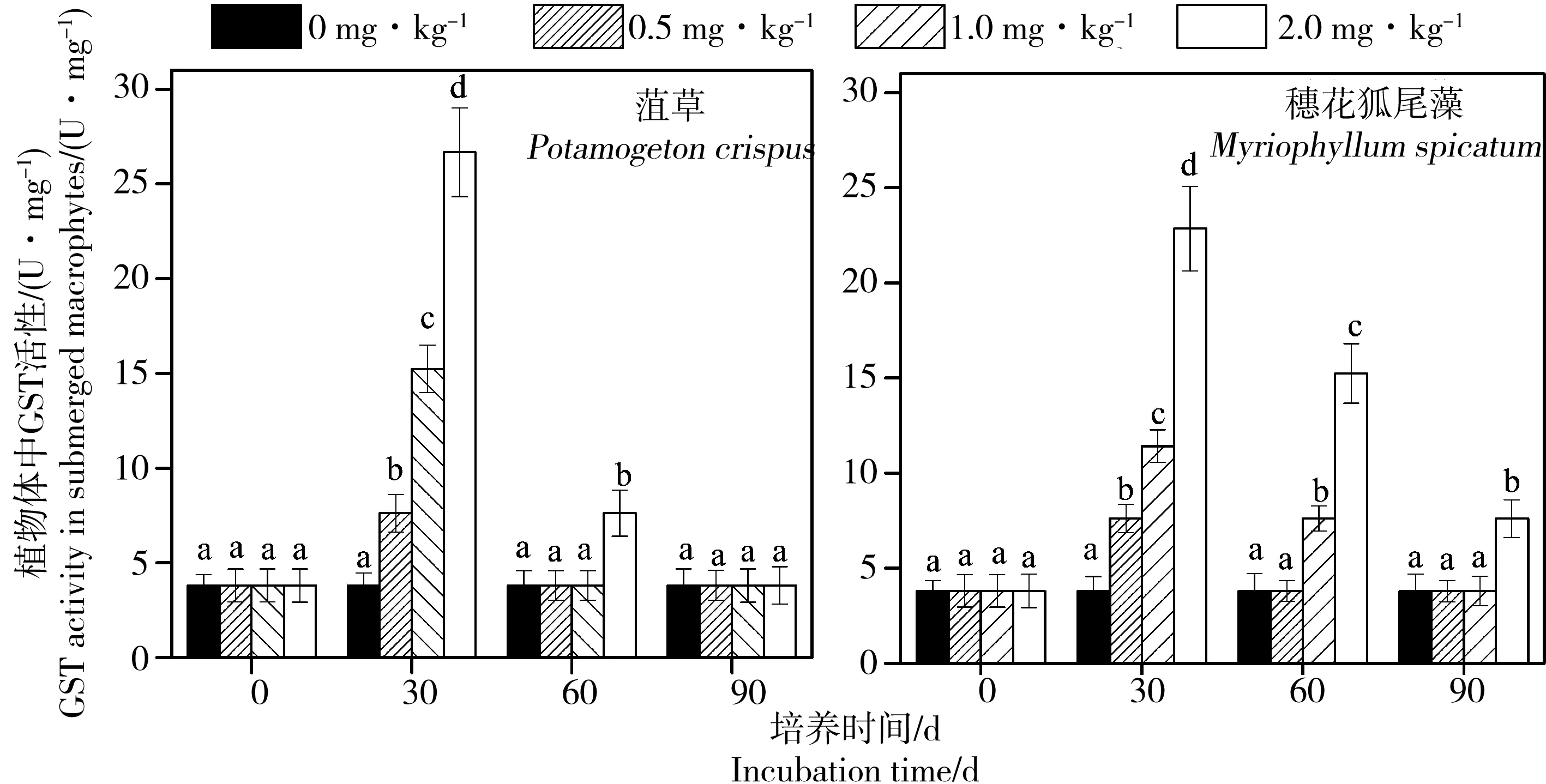
图5 阿特拉津胁迫下菹草和穗花狐尾藻体内GST活性的变化注:图中不同小写字母分别表示胁迫0、30、60和90 d时不同阿特拉津浓度处理间差异显著(P<0.05)。Fig. 5 Effects of different levels of atrazine on GST value of Potamogeton crispus and Myriophyllum spicatumNote: Different lowercase letters represent significant differences among different atrazine treatments on days 0, 30, 60 and 90, respectively (P < 0.05).
在第90天时,除2 mg·kg-1阿特拉津处理下穗花狐尾藻GST活性为(7.62 ± 0.99) U·mg-1,其他所有处理组的植物GST活性均为3.81 U·mg-1。
3 讨论(Discussion)
阿特拉津一旦从水相中进入沉积物,则很难解吸出来,使得水相中的阿特拉津浓度远低于沉积物中阿特拉津浓度[7]。因此,本文对水相中阿特拉津含量不予讨论。在培养的0~60 d内,植物体内的阿特拉津保持一定浓度,表明此阶段的阿特拉津对植物的胁迫作用较强,且沉积物阿特拉津初始浓度越高,植物体内阿特拉津浓度越高。在培养60~90 d时,不同浓度处理下植物体内阿特拉津迅速减少,因而阿特拉津的胁迫作用会相应减弱。有研究表明,植物体内除草剂浓度与植物生物量、GSH/GSSG比例和GST含量密切相关[12]。
菖蒲能在20 mg·L-1阿特拉津浓度下继续生长[22]。与此同时,Wang等[23]曾经报道菖蒲、千屈菜和水葱能在阿特拉津浓度< 8 mg·L-1的培养液中存活,随着时间的增加,阿特拉津对植物的负面影响会减弱。与报道的挺水植物类似,在前60 d内,本实验中添加的阿特拉津对2种沉水植物的生长均产生显著抑制作用,植物生物量的减少可能是由某些代谢过程的变化引起的[24]。在这一时期,阿特拉津可能诱导了植物体内的抗氧化物质的活性,从而在一定程度上保护了菹草和穗花狐尾藻[25]。在培养实验的末期,这种抑制作用逐渐减弱,植物重量有所回升,这与植物体内阿特拉津含量变化密切相关。
在培养第30 天时,菹草和穗花狐尾藻体内GSH的下降表明植物受到了阿特拉津及活性氧的毒害作用。作为大多数好氧生物抗氧化效应的关键组分,GSH的消耗会诱导植物对外源毒害出现更强的氧化应激效应[26]。随着培养时间增加,植物对阿特拉津的降解程度加大(2.1所示),GSH/GSSG比值回升,GSH含量增加,氧化应激效应减弱。除了与活性氧反应生成GSSG来降低阿特拉津的氧化毒性,GSH还可与阿特拉津耦合形成新的化合物。不同于水稻中GSH直接与阿特拉津耦合,菹草和穗花狐尾藻体内的谷胱甘肽脱去谷氨酸(Cys-β-Ala)后才能与阿特拉津耦合形成配合物(atrazine+(Cys-β-Ala)-HCl),这一过程可能降低了阿特拉津对植物的毒性[27]。
Alla和Hassan(2007)[26]认为,高剂量异丙隆会诱导氧化应激效应,并对GR活性产生一定的抑制作用。不同的是,本研究中GR活性随着GSH的下降而增加,我们可以理解为当植物体内GSH下降时,会诱导GR活性增加,虽然除草剂的存在会抑制GR的活性,但是这种抑制作用显著弱于诱导作用。有研究表明,植物对除草剂的抗性取决于GST催化作用下GSH的结合反应[28],在阿特拉津存在及GSSH含量增加的条件下,菹草和穗花狐尾藻体内的 GST活性得到了增加,加强了植物对除草剂的防御能力。菹草和穗花狐尾藻对阿特拉津的耐受性差异主要与GSH和GSH相关酶的差异诱导有关[29]。
