番茄灰霉菌啶酰菌胺抗性菌株生理特性初探
2018-09-05李培谦冯宝珍
李培谦,冯宝珍
(运城学院,山西 运城 044000)
灰霉菌(Botrytiscinerea)能够引起大田作物,水果蔬菜及园林花卉等1000多种植物的病害,在农业生产上造成严重的经济损失[1]。当前,灰霉病的防治是以化学防治为主。但是灰霉菌适应性强,繁殖快,易突变,很快对多种药剂产生抗药性,如:多菌灵、腐霉利、乙霉威等[2~3]。
啶酰菌胺属于琥珀酸脱氢酶抑制剂 (succinate dehydrogenase inhibitors) 类杀菌剂,由德国巴斯夫公司开发,可用于防治灰霉病菌核病锈病白粉病等[4]。自2006年开始在我国登记用于防治蔬菜灰霉病[5]。其作为新颖吡啶类杀菌剂,具有活性高、作用机理独特、杀菌谱较广、不易产生交互抗性、对作物安全等特点。然而,随着该药剂的推广使用,已有报道显示在部分地区有些作物上出现了抗性。余玲等[6]报道山西部分地市保护地蔬菜对啶酰菌胺产生了抗药性。石延霞等[3]发现我国主要蔬菜种植区的灰葡萄孢的抗性频率高达41%以上,并且高抗菌株占62%以上。这都表明灰葡萄孢对啶酰菌胺的抗性发展迅速,需要加强田间用药指导,规范合理用药。
植物病原菌出现抗药性,其生理生化特性也会发生改变。新型杀菌剂SYP-1620引起灰葡萄孢抗性菌株菌丝生长速率减慢,致病力下降但是没有引起菌丝干重变化[7]。氟啶胺引起灰葡萄孢呼吸速率下降及ATP酶活性升高等方面生理特征改变[8]。目前关于见关于番茄灰霉菌抗啶酰菌胺菌株生理生化特性方面的报道尚少,而该特性对探明菌株的抗药性机理及进行抗性风险评估具有重要意义。本研究以番茄灰霉菌敏感菌株和抗性菌株为研究对象,比较分析这两种类型菌株在苯丙氨酸解氨酶(PAL)、过氧化物酶(POD)、适应性评价及致病力等生理生化特性差异,以期为阐明病原菌的的抗药性机制提供一定的理论基础。
1 材料与方法
1.1 供试菌株
供试60个番茄灰霉菌株于2012-2016采于山东潍坊、泰安、济南,河南三门峡以及山西运城等地的番茄种植保护地。采用单孢分离法获得菌株,在PDA斜面培养5~7天,然后置于4 ℃冰箱保存。敏感性菌株采自未使用过啶酰菌胺的番茄植株。
1.2 供试药剂
试验所用啶酰菌胺(boscalid)水分散粒剂(96%),由上海源叶生物科技有限公司提供。96%丙酮(分析纯),由莱阳市康德化工有限公司生产。
1.3 番茄灰霉菌抗性水平测定
参照前人研究,利用菌丝生长速率法测定番茄灰霉菌对啶酰菌胺的敏感性[9]。
1.3.1 含药培养基制备
称取浓度为96%的啶酰菌胺原药166.67 mg,溶解于5 mL的丙酮溶液中,再加入少量乳化剂(吐温80),使其溶解更充分,最终制得浓度为32 g·L-1的啶酰菌胺母液。在无菌操作台上,用移液枪取一定量的啶酰菌胺药液于含有50 mL PDA培养基的锥形瓶中,再用移液枪吸打,使其与培养基充分混匀,乘热,倒入培养皿中,制备含药培养基。按上述方法,制备含药培养基终浓度分别为0(CK)、5、10、20、30 μg·mL-1。
1.3.2 抗性水平测定
然后将直径5 mm菌饼接种于上述培养基内,而后置于22 ℃的恒温培养箱中,培养5天左右,等到培养皿内菌丝生长到大约培养皿大小的四分之三时,测量其菌落直径。利用十字交叉法分别测量每个培养皿中的菌落直径,如果遇到椭圆形的或者形状不规则的要分别测量它们的最短直径和最长的直径,然后分别求其平均值,利用DPS软件分别求其菌丝生长抑制率及试验菌株的EC50值。啶酰菌胺抗药性水平标准参照Veloukas等[10]的方法。
1.4 酶活性分析
1.4.1 菌丝制备
选取抗性菌株R1和敏感菌株S1进行PAL和POD酶活性分析。先将这两个菌株在PDA培养基上于22 ℃黑暗培养3 d,于菌落边缘打取直径5 mm的菌饼。分别接入含有质量浓度为1.0、5.0、25.0μg·mL-1的啶酰菌胺的PDA液体培养基中,每瓶接入20块菌饼,然后于22 ℃恒温、120 r·min-1下分别振荡培养。并于0、1.5、6和24 h取样。菌丝体经四层纱布过滤,再用无菌水冲洗3次,吸水纸吸干水分后,放在-80 ℃备用。以0.1 μg·mL-1丙酮溶剂稀释液为对照,每个处理重复3次。
1.4.2 PAL活性分析
称取1 g样品,液氮研磨后转移至2 mL 离心管,加入无菌水制备粗酶液。参照前人研究方法[11],分别配制反应液:pH 8.7硼酸缓冲液和0.02 mol·L-1的L-苯丙氨酸溶液。试管中分别加入2.0 mL硼酸缓冲液、1 mL L-苯丙氨酸以及0.5 mL粗酶液,然后置于40 ℃水浴中反应60 min,后用0.5 mL 6 mol·L-1的盐酸终止反应。对照用0.5 mL硼酸缓冲液代替粗酶液。用紫外分光光度计测定290 nm处吸光度A290的变化。以每1 min内A290变化0.01为1个酶活力单位(μmol·min-1),实验重复3次。
1.4.3 POD活性分析
根据付丽等[12]的研究方法采用愈创木酚法,并略加改进。反应体系为: pH 5.8磷酸缓冲液2.0 mL,3% H2O21 mL,0.05 mol·L-11 mL、粗酶液1.0 mL。37 ℃水浴,反应15 min后迅速转入冰浴中,对照以磷酸缓冲液代替酶液。用紫外分光光度计在470 nm处测定反应3 min时的吸光度(A)。每隔30 s记录1次,共记6次,以每1 min内A470变化0.01为1个酶活力单位(μmol·min-1),实验重复3次。
1.5 适应性评价
1.5.1 菌丝生长速率测定
采用生长速率法对抗性菌株与敏感性菌株的生长情况进行了比较[13]。取直径5 mm的菌饼接种到PDA培养基上于22 ℃黑暗培养3 d,然后十字交叉法测定菌落直径大小。每个菌株做四个平板,试验重复两次。
1.5.2 产孢量测定
取直径5 mm的菌饼接种到PDA培养基上于22 ℃黑暗培养12 d,然后加入5 mL无菌水,两层纱布过滤后得到分生孢子悬浮液。然后在显微镜下计数,检测孢子数量。
1.5.3 菌株干重测定
根据liu 等[13]的方法对抗性菌株与敏感性菌株干重进行了测定。取10块直径5 mm的菌饼接种到250 Ml 三角瓶PDA液体培养基中,然后于22 ℃恒温、120 r·min-1下分别振荡培养3天。菌丝体经四层纱布过滤,再用无菌水冲洗3次,吸水纸吸干水分后,放在烘箱内80 ℃处理8 h,然后称重。每个菌株培养3瓶,实验重复2次。
1.6 致病性测定
将直径5 mm的菌饼接种番茄果实,于22 ℃黑暗培养,分别在第1、3、5 d测量病斑大小。每个菌株接种3个健康番茄果实,试验重复2次。
2 结果与分析
2.1 啶酰菌胺抗性菌株与敏感性菌株PAL活性比较
图1为抗性菌株R1和敏感性菌株S1在不同浓度(1、5、25 μg·mL-1)啶酰菌胺处理后体内PAL酶活性测定结果。在处理后24 h内,两菌株PAL活性变化趋势基本一致,均呈现为先上升后下降的趋势,并且随着药物浓度增高酶活性也相应升高。两菌株均在处理后1.5 h时PAL酶活性达到锋值,而后逐渐降低。很明显在各处理浓度下,抗性菌株R1的PAL活性均高于敏感菌株S1。当啶酰菌胺浓度25 μg·mL-1时,抗性菌株R1 PAL酶活达到118.75 μmol·min-1,为同条件下敏感性菌株S1 PAL(76.29 μmol·min-1)的1.56倍。

图1 不同浓度啶酰菌胺处理后抗性菌株和敏感性菌株体内PAL活性分析Fig.1 Analysis of PAL activity in the resistant strain and the sensitive strain after treatment with different concentration of Boscalida: 0 μg·mL-1; b: 1 μg·mL-1; c: 5 μg·mL-1; d: 25 μg·mL-1; R表示抗性菌株,S表示敏感性菌株a: 0 μg·mL-1; b: 1 μg·mL-1; c: 5 μg·mL-1; d: 25 μg·mL-1; R:resistant isolate R1,S: sensitive isolate S1
2.2 啶酰菌胺抗性菌株与敏感性菌株POD活性比较
不同浓度啶酰菌胺处理后,抗性菌株R1和敏感性菌株S1体内过氧化物酶(POD)的酶活力变化如图2所示。两菌株POD活力变化趋势基本一致,在24 h内酶活性不断升高,并且在24 h达到峰值。在各处理条件下,R1体内POD活力明显高于S1。在处理后24 h,抗性菌株酶活力增幅明显大于敏感性菌株。

图2 不同浓度啶酰菌胺处理后抗性菌株和敏感性菌株体内POD酶活性分析Fig.2 Analysis of activity of POD enzyme in the resistant strain and the sensitive strain after treatment with different concentration of Boscalida: 0 μg·mL-1; b: 1 μg·mL-1; c: 5 μg·mL-1; d: 25 μg·mL-1; R表示抗性菌株,S表示敏感性菌株a: 0 μg·mL-1; b: 1 μg·mL-1; c: 5 μg·mL-1; d: 25 μg·mL-1; R: resistant isolate R1,S: sensitive isolate S1
并且随着处理啶酰菌胺浓度增加(1、5、25 μg·mL-1),所检测的两个菌株体内POD活力也变大。当啶酰菌胺浓度25 μg·mL-1时,抗性菌株R1 POD酶活达到175.26 μmol·min-1,为同条件下敏感性菌株S1 POD(68.43 μmol·min-1)的2.56倍。
2.3 适应性评价
如表1所示,啶酰菌胺抗性菌株R1和敏感性菌株S1在菌丝生长、产孢量、菌丝干重以及对番茄果实的致病性方面没有明显的区别。
表1抗性菌株与敏感性菌株适应性评价
Table1 Adaptive evaluation of resistant strains and sensitive strains
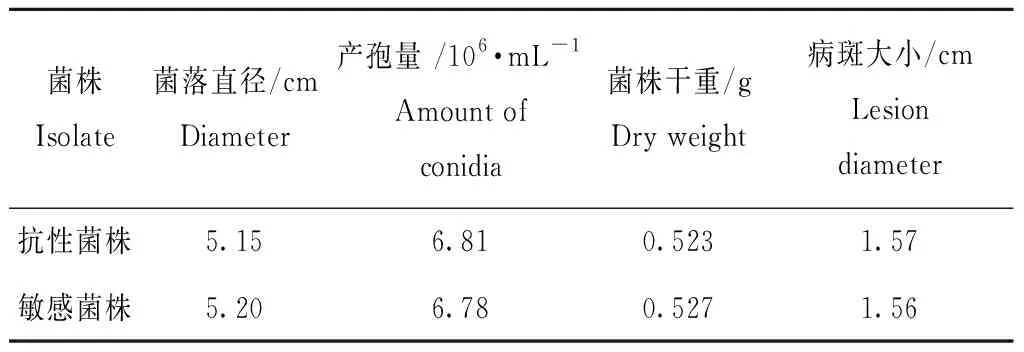
菌株Isolate菌落直径/cmDiameter产孢量 /106·mL-1Amount of conidia菌株干重/gDry weight病斑大小/cmLesion diameter抗性菌株5.156.810.5231.57敏感菌株5.206.780.5271.56
3 结论与讨论
灰霉病一直都是世界范围内蔬菜生产上的重要病害,因其寄主范围广、繁殖快、易变异等特点,给防治工作带来困难。本试验检测了啶酰菌胺抗性菌株R1和敏感性菌株S1的苯丙氨酸解氨酶(PAL)、过氧化物酶(PDD)的酶活力,并对两菌株适应性和致病性进行了分析。实验结果发现经不同浓度啶酰菌胺处理后,抗性与敏感性菌株0~24 h内两种类型菌株PAL和POD活性都有升高趋势,但是抗性突菌株PAL和POD活性上升幅度较敏感菌株高。适应性评价显示啶酰菌胺抗性菌株和敏感性菌株在菌丝生长速率、产孢量、菌丝干重以及对寄主植物的致病性方面没有明显的区别。本研究将为啶酰菌胺抗性菌株的抗药机理分析和田间科学用药提供理论依据。
苯丙氨酸解氨酶(PAL)是一类疏水蛋白,分子量一般在300~340 kDa,在生物体内普遍存在,在生物生长发育过程中及逆境条件下都会发生变化[14~16]。PAL与植物抗病性密切相关,受到病原物侵染后植物体内PAL活性明显升高[14]。已有研究报道称抗药性真菌的菌株中也发现了类似现象,比如葡萄白腐病菌多菌灵抗性菌株体内PAL活性一直高于敏感性菌株[17];草莓枯萎病菌戊唑醇抗性菌株体内PAL活性明显高于敏感性菌株[18];苹果轮纹病的抗戊唑醇菌株在药剂处理后1.5 h内酶活性最高[12]。本研究发现啶酰菌胺处理后,抗性菌株及敏感菌株体内PAL活性均先升高后下降,但是抗性菌株活性一直高于敏感菌株,这与前人研究结果类似。这说明PAL对真菌逆境条件下生存具有调节作用。
过氧化物酶(PDD)是一类同工酶,能够催化过氧化氢和有机过氧化物对各种有机物和无机物的氧化作用。POD广泛存在于动物、植物、真菌及细菌内,依据来源可分为胞内型、胞外型及分泌型,参与机体多种生理代谢功能[19]。POD参与真菌在逆境条件的生理代谢调节,保护细胞膜免受损伤[20]。本试验中,啶酰菌胺处理后24 h内,灰霉菌抗性菌株及敏感性菌株的POD活性呈升高趋势,并且明显比后者要高。这与前人研究结果一致,苹果轮纹病菌抗性菌株及敏感性菌株药剂处理后体内POD活性一直升高[12]。这说明POD活力大小与真菌抗药性的强弱有紧密关系,但是能否作为衡量抗性强弱的指征还需要更多的研究工作来证明。
生物适应性参数是影响一种病原菌抗药性形成的重要因子,通常包括菌丝生长速率、干重、产孢量以及致病性[21]。本研究发现啶酰菌胺抗性菌株的适应性参数值与敏感性菌株无明显差异。这与前人研究结果一致,有学者发现具有多种农药交叉抗性的灰霉菌株其适应性与敏感性无明显差别[22]。而研究者分析了来源不同寄主的灰霉菌对农药SYP-1620 的抗性和敏感性菌株的生物适应性发现,抗性菌株的适应性参数较低,但是差别不太明显[7]。这可能与菌株采集的背景有一定关系。
综上所述,啶酰菌胺处理后,番茄灰霉菌抗性菌株及敏感性菌体的生理生化特征都能发生显著变化,PAL及POD活力大幅升高,但是抗性菌株变化幅度更大。而适应性评价显示两类菌株无明显差异,这需要进一步的研究来阐述其原因。番茄灰霉菌是具有抗性风险的病原菌,容易对啶酰菌胺产生抗药性。新型化学农药的使用需要科学指导,否则防治效果会下降。
