2,4,6-三氯苯酚与人血清白蛋白相互作用的研究
2018-09-03霍彩霞何丽君杨天宇
霍彩霞, 何丽君, 杨天宇
(1.兰州城市学院化学与环境工程学院,甘肃兰州 730070;2.西北师范大学化学化工学院,甘肃兰州 730070)
氯酚类污染物2,4,6-三氯苯酚(TCP)结构稳定,溶解度大,降解性能极差,土壤等固体物质对其的吸附和固定作用很弱[1],在环境和生物体内有富集作用,容易引起生物体致癌和致突变等,被列为EPA129种优先污染物和我国68种优先监测污染物之一[2]。进入机体的TCP与蛋白质相互作用是决定其在体内运输、分配、致毒和代谢活性的主要因素,因此研究其与血清白蛋白相互作用,对于深入探索其致毒、代谢和解毒机制具有重要的科学意义和应用价值。然而目前对环境中TCP的检测和降解关注较多[3 - 6],而对其与人体中蛋白质的相互作用研究较少[7]。
本文在模拟人体生理条件下,运用荧光光谱、紫外吸收光谱、循环伏安法和分子对接技术,研究了TCP与人血清白蛋白(HSA)的相互作用,以及柠檬酸、维生素C等小分子介入对TCP与HSA相互作用的影响,为深入研究其在人体内致毒、代谢和解毒机制提供一定的实验基础。
1 实验部分
1.1 仪器与试剂
RF-5301PC荧光光度计,UV-2550紫外-可见分光光度计(日本,岛津公司);CH604电化学分析仪(上海晨华仪器有限公司),电化学实验采用三电极系统:玻碳电极(GEC)为工作电极,铂丝电极为对电极,饱和甘汞电极(SEC)为参比电极。
人血清白蛋白(HSA)(生化试剂,美国Sigma公司)溶液:用Tris-HCl缓冲溶液(pH=7.40)配成浓度为1.0×10-4mol·L-1的储备液,保存于4 ℃冰箱;2,4,6-三氯苯酚(TCP)(98%,阿拉丁(上海)化学试剂有限公司)溶液:用乙醇配制成浓度为2.676×10-4mol·L-1储备液;B-R缓冲溶液:pH=7.40;Tris-HCl缓冲溶液:含0.1 mol·L-1NaCl溶液维持离子强度,pH=7.40;无水乙醇、柠檬酸、维生素C等试剂均为分析纯。实验用水为二次蒸馏水。
1.2 实验方法
1.2.1荧光光谱测定于1 cm石英比色皿中,加入3.0 mL 1.0×10-6mol·L-1的HSA溶液,然后用滴定的方法依次加入10 μL的TCP(2.676×10-5mol·L-1),搅匀,放置7 min,设定λex=282 nm,在温度为300、305、310 和315 K下扫描荧光光谱和同步荧光光谱(310 K,Δλ=15 nm和Δλ=60 nm)。
取3.00 mL 1.0×10-6mol·L-1HSA溶液两份,分别加入10 μL 4.4×10-4mol·L-1的柠檬酸和维生素C溶液,依次滴入10 μL TCP(2.676×10-5mol·L-1)溶液,同样设置参数,测定310 K时体系的荧光光谱。
1.2.2紫外吸收光谱测定以pH=7.40的Tris-HCl缓冲溶液为参比,测定200~400 nm波长范围内等浓度HSA、TCP及TCP和HSA摩尔比为1∶1 溶液的紫外吸收光谱。
1.2.3电化学测试方法玻碳电极用电极抛光材料抛光至镜面,依次用无水乙醇和蒸馏水超声清洗。采用循环伏安法研究TCP、HSA及TCP-HSA在pH=4.70的B-R缓冲溶液中的电化学行为。
1.2.4计算机模拟分子对接实验TCP的构建在Chemoffice2008>ChemBioDraw Ultra11.0中完成,在Chemoffice2008>ChemBio3D Ultra11.0中加MM2力场完成初步优化,并保持化合物的手性构型。初步优化的TCP配体在Schrodinger>LigPrep中进行加电荷、质子化状态处理,HSA与warfarin复合物的三维结构取自PDB数据库(Protein Data Bank,PDB code:1H9Z)。对HSA的处理(加氢、添加偏电荷、调整质子化状态)所用的力场为OPLS-2005力场。在Schrodinger>Glide>Ligand Docking中将TCP对接到人血清白蛋白活性口袋中(PDB code:1H9Z),对接参数均采用软件缺省值。
2 结果与讨论
2.1 TCP与HSA相互作用机制
2.1.1TCP与HSA相互作用的光谱研究图1为TCP-HSA体系的荧光光谱图。随着TCP浓度不断增大,337 nm处HSA的荧光强度有规律地降低,且最大发射峰峰形未变,峰位有轻微蓝移,表明TCP与HSA发生了相互作用。TCP对HSA荧光猝灭的方式有静态猝灭和动态猝灭,动态猝灭常数可由Stern-Volmer方程求得[8]。在实验温度下的动态猝灭速率常数Kq见表1,在300~315 K范围内,TCP与HSA的Kq均在1013数量级,远大于猝灭剂对生物大分子的最大动态荧光猝灭常数2×1010L·mol-1·s-1[9],初步表明TCP与HSA的荧光猝灭作用为静态猝灭。
在模拟人体生理条件下,测得了TCP、HSA及TCP与HSA等摩尔比的紫外吸收光谱图(图2)。加入TCP后,HSA在280 nm处的吸收峰的强度降低且峰位发生蓝移,表明TCP与HSA作用形成基态复合物,从而导致HSA吸收光谱的改变,进一步证实了TCP与HSA相互作用机理为静态猝灭[10]。
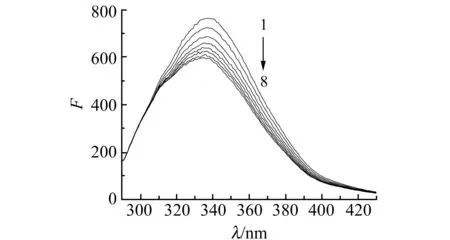
图1 TCP-HSA体系的荧光光谱图Fig.1 Fluorescence spectra of HSA in the presence of TCPλex=282 nm,T=310 K;cHSA=1.0×10-6 mol·L-1,cTCP:0,0.8890,1.772,2.636,3.521,4.386,5.247,6.102(×10-7 mol·L-1).
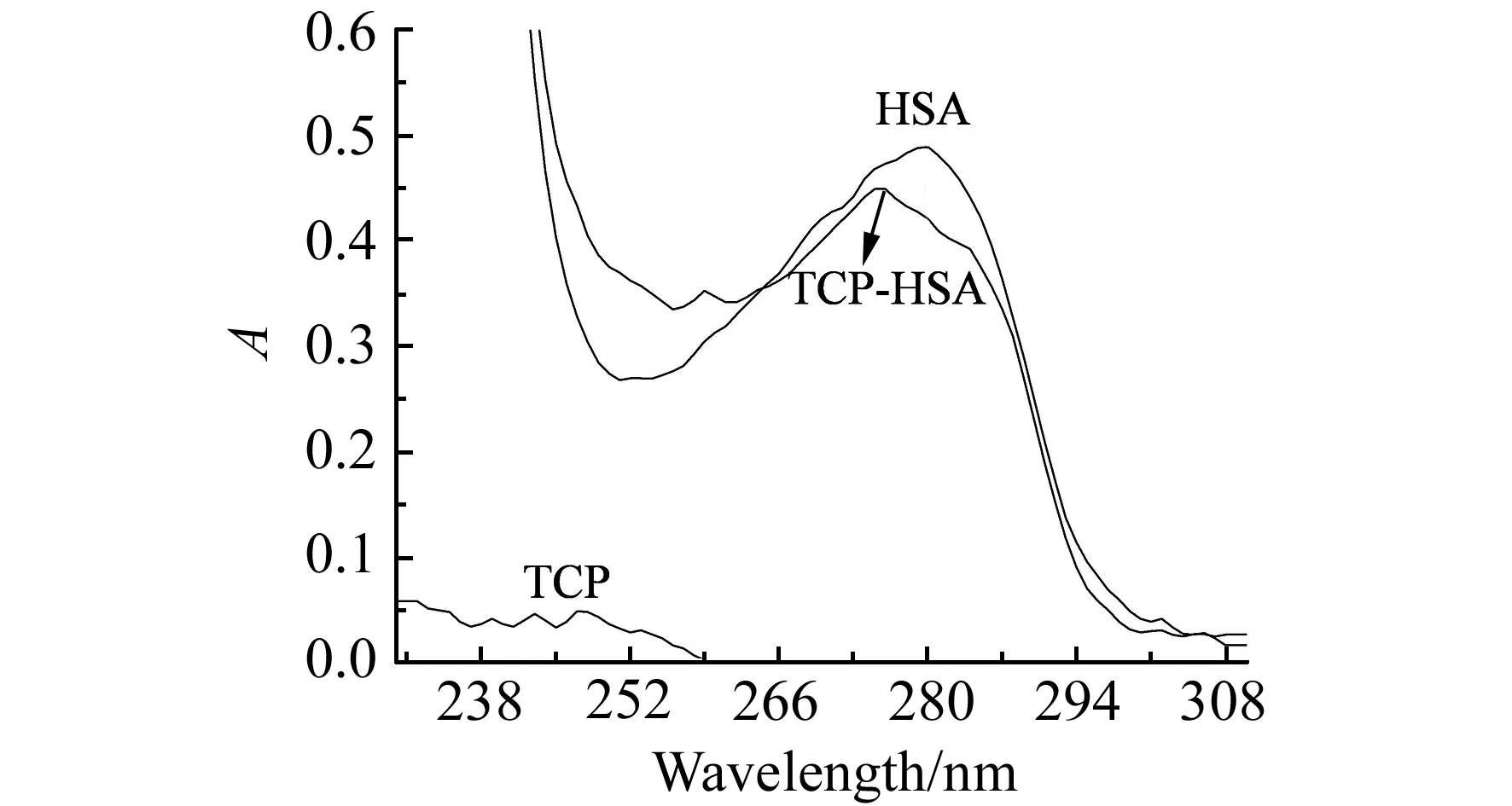
图2 TCP、HSA及TCP-HSA等摩尔混合体系的紫外(UV)吸收光谱图Fig.2 UV spectra of TCP,HSA and TCP-HSApH=7.40,T=310 K;cHSA=cTCP=1.0×10-5 mol·L-1.
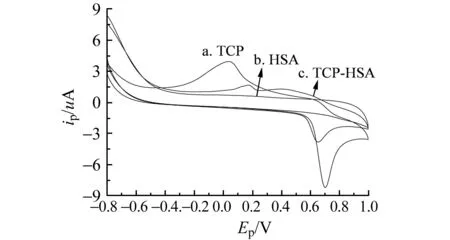
图3 TCP与HSA在玻碳电极上的循环伏安图Fig.3 Cyclic voltammetry of TCP and HSA on a glass carbon electrodeT=298 K,pH=4.70,scan rate:60 mV·s-1,cTCP=2.683×10-4 mol·L-1,cHSA=1.0×10-6 mol·L-1.
2.1.2TCP与HSA相互作用的电化学研究在-0.8~1.0 V电位范围内,采用循环伏安法研究了TCP、HSA及TCP-HSA在pH=4.70的B-R缓冲溶液中的电化学行为(图3)。结果TCP出现了一对氧化还原峰(曲线a),峰电位分别为:Epa=0.687 V、Epc=0.125 V,HSA未出现氧化还原峰(曲线b),而TCP中加入HSA后,体系的峰电位发生明显改变,峰电流随之降低(曲线c),表明TCP和HSA发生相互作用,形成了不具有电化学活性的复合物。
2.2 结合常数、结合位点数及作用力
TCP和HSA的猝灭机理为静态猝灭,其符合公式lg[(F0-F)/F]=lgKA+nlgc,以lg[(F0-F)/F]对lgc作图,依截距和斜率求得二者的结合常数KA和结合位点数n,结果见表1。结果表明:TCP与HSA相互作用的结合常数较大,约有1个结合位点。在模拟人体正常体温310 K时,王洋等[11]得到的2,4-二氯苯酚-HSA的KA为9.760×104L·mol-1,但比TCP-HSA的KA小,说明三氯酚与HSA的相互作用更强。根据表1中热力学参数和Ross等[12]的观点可推断出,ΔG<0,说明TCP与HSA之间结合反应是自发进行,ΔH<0、ΔS>0,表明两者间存在静电作用和疏水作用。
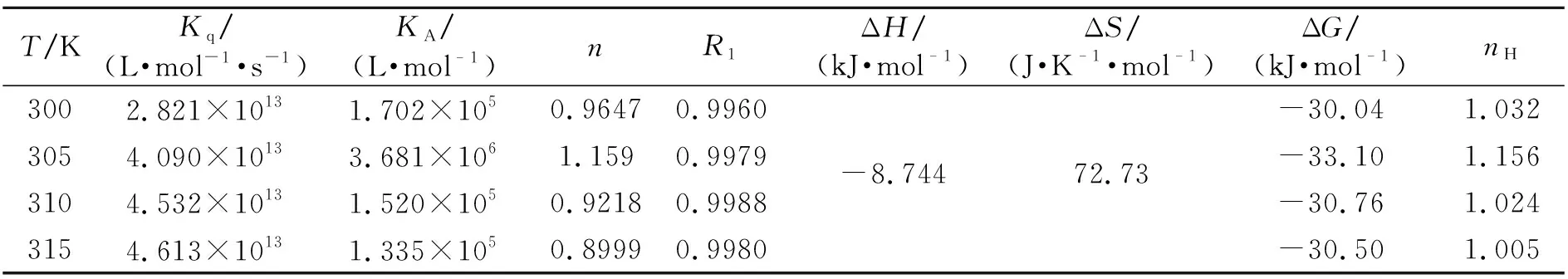
表1 TCP与HSA相互作用参数表
2.3 柠檬酸和维生素C对反应体系的影响
从表2可看出,在模拟人体生理条件下(pH=7.40,T=310 K),柠檬酸和维生素C的介入对TCP与HSA荧光的猝灭方式无影响,但二者的KA和n显著降低,TCP与HSA的结合能力大大减弱,说明可以通过食物适量摄入柠檬酸和维生素C等营养成分来降低TCP对人体的伤害。
表2 柠檬酸和维生素C存在下TCP与HSA相互作用参数
2.4 TCP的协同性考察
根据文献方法[13 - 14],通过Hill方程分析了具有多重结合部位的HSA与配体TCP结合过程中各结合部位之间存在相互影响作用的可能性。Hill系数nH表示二元体系中同类配体之间结合的影响,其余参数意义及求算方法见文献报道[13 - 14]。由表1可知,在研究温度下nH值略大于1,说明TCP与HSA结合过程中,TCP分子间呈现微弱的正协同作用,前一个TCP分子结合到HSA位点上后,对后一个TCP分子与HSA相互结合的促进作用较弱。
2.5 TCP与HSA作用的分子对接研究
研究发现华法林和布洛芬在血清白蛋白上的结合部位分别为亚螺旋域ⅡA和ⅢA[15]。以华法林和布洛芬为标记药物,通过竞争实验分析TCP与HSA相互作用的结合部位。在310 K测定一定浓度的竞争试剂(华法林和布洛芬)存在时TCP-HSA体系的荧光强度。结果表明,KA由原来1.520×105L·mol-1分别变为2.358×104和7.652×104L·mol-1,且华法林存在时变化更显著,说明TCP在亚螺旋域ⅡA与HSA发生作用。
图4是TCP与HSA的计算机模拟分子对接图。由于TCP体积较小,只占据氨基酸残基组成的一个ⅡA疏水空腔(图4A),它周围20 Å范围内的疏水残基(L238、L219、A291、I290、A261、I264、L260及V241)与TCP中的苯环间存在较强的疏水力,而TCP的pKa为6.15,在pH=7.40时,苯环上的羟基发生部分解离,带有负电荷,与HSA中带正电的氨基酸基团间有静电作用(图4B),二者共同作用使TCP与HSA结合形成了稳定的复合物。
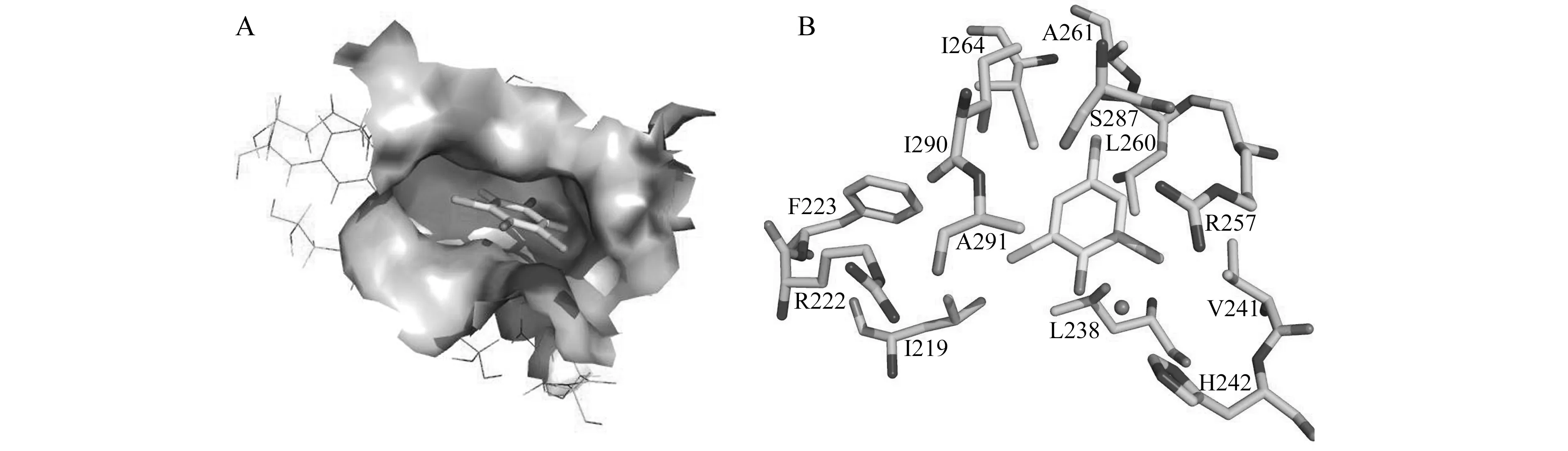
图4 TCP在HSA的结合口袋和分子对接图Fig.4 TCP combines pockets and molecular docking in HSA
2.6 TCP对HSA构象的影响
固定HSA的浓度,逐渐增加TCP的浓度,分别在Δλ=15 nm和Δλ=60 nm的条件下测定HSA的同步荧光光谱。由图5可见,随着TCP浓度增加,酪氨酸残基的发射峰峰位和峰高均未变(图5A),而色氨酸残基的荧光强度有规律地猝灭且峰位略有蓝移(图5B),表明TCP的加入使HSA的色氨酸残基的微环境发生了变化,导致HSA的荧光团所处环境的疏水性增加,极性减小,蛋白质趋于收缩,TCP对HSA的构象有一定的影响。
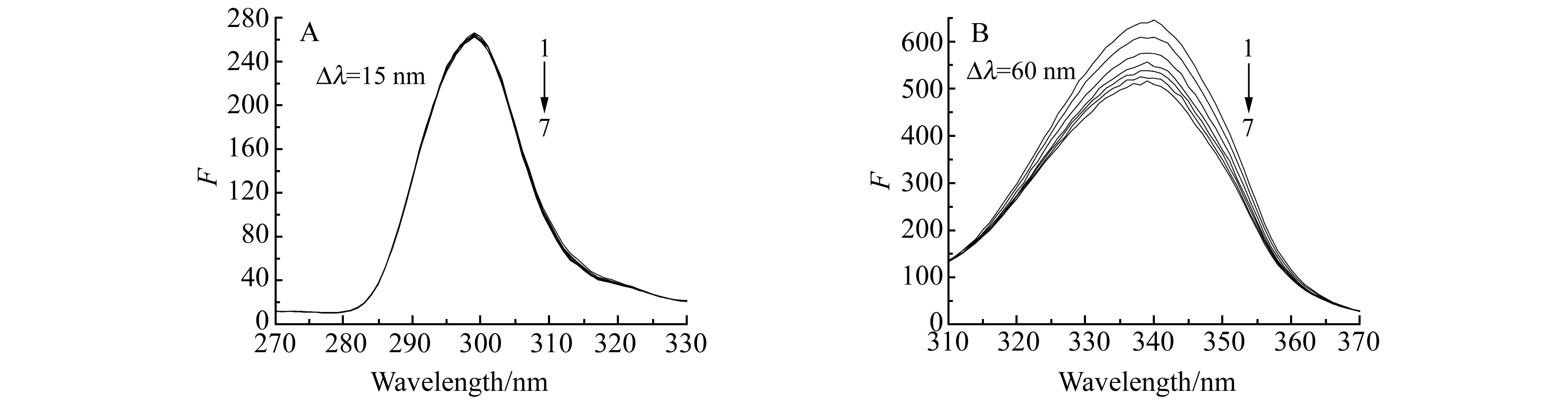
图5 TCP对HSA构象的影响Fig.5 Effect of TCP on the configuration of HSAλ ex=282 nm,T=310 K;cHSA=1.0×10-6 mol·L-1,cTCP(1-7):0,0.8890,1.772,2.636,3.521,4.386,5.247(×10-7 mol·L-1).
3 结论
本文运用荧光光谱、紫外光谱、循环伏安法和分子对接技术,研究了TCP与HSA间的相互作用。实验表明在人体生理条件下,TCP使HSA的荧光以静态猝灭形式发生作用,求得了结合常数、结合位点数和热力学参数,推断出相互作用力,进一步通过分子对接技术进行佐证,与实验结果推断一致;柠檬酸和维生素C的介入则对TCP与HSA的作用有显著影响,适当提高血液中柠檬酸和维生素C的浓度,有助于降低TCP对人体的伤害;nH值略大于1,说明TCP分子间呈现微弱的正协同作用;同步荧光则表明TCP对HSA的构象有一定影响。
