电化学-分光光度法联用技术检测水样中Cu(Ⅱ)
2018-09-03韩海涛王晨晨潘大为
陆 妍, 韩海涛, 王晨晨, 潘大为*
(1.中国科学院海岸带环境过程与生态修复重点实验室,中国科学院烟台海岸带研究所,山东烟台 264003;2.中国科学院大学,北京 100049)
铜作为一种人体必需微量元素,广泛参与生命活动,例如维持碳水化合物和脂质代谢,作为酶辅因子参与红细胞形成和血管活动等[1]。然而,高浓度的铜对生物机体组织也具有毒副作用[2]。自然水环境中过度的Cu(Ⅱ)也可能损害水生生物的肝脏,肾脏和神经系统[3]。人体摄取的铜主要是从水、食物及环境中获得,它可以通过食物链累积和传播[4]。因此,发展一种简单、快速、准确测定水样中Cu(Ⅱ)的分析方法对环境监测具有十分重要的意义。
到目前为止,检测Cu(Ⅱ)的方法包括原子吸收光谱法(AAS)[5]、电感耦合等离子体质谱法(ICP-MS)[6]、电感耦合等离子体发射光谱法(ICP-OES)[7]、紫外-可见分光光度法(UV-Vis)[8]、高效液相色谱法(HPLC)[9]和电化学方法[10 - 13]。在这些方法中,紫外-可见分光光度法不仅灵敏可靠,同时也因为明显的颜色变化使得检测更加简单直接。现有的水质测定Cu(Ⅱ)的国家标准方法是二乙基二硫代氨基甲酸钠分光光度法(HJ 485-2009)[14],然而,必要的预处理过程,特别是浑浊或有色水体,需要使用大量的化学试剂和繁琐的处理步骤,可能会导致环境的二次污染且操作费时,并可导致各种误差[15]。
电化学方法由于其固有的小型化、便携化、灵敏度高、分离性好以及简便等特点,将其作为预处理方法具有一定优势[16]。电极沉积过程增强了分析信号,减小了基质的干扰[17]。电化学作为前处理富集方法已被用来进行冷原子吸收光谱法[8]、阳极溶出伏安法[19]和ICP-MS法[20]等的分析。本文提出将电化学方法和分光光度法联用,检测浑浊或有色水样中的Cu(Ⅱ)。其中电化学方法作为样品预处理步骤,分光光度法作为Cu(Ⅱ)的定量分析方法。旨在改进和优化国家标准方法。检测结果表明建立的方法具有很好的特性,包括高效性,较好选择性、重复性和稳定性。
1 实验部分
1.1 仪器及试剂
所有电化学实验在 CHI660D 型电化学工作站(上海辰华仪器有限公司)上进行,三电极体系:玻碳电极为工作电极,Ag/AgCl电极为参比电极,Pt片为辅助电极;紫外检测在DU800型紫外-可见分光光度计(美国,Beckman Coulter)上进行;ELAN DRCⅡ型电感耦合等离子体质谱仪(美国,Perkin-Elmer Ltd.)。
所有试剂均购自上海国药集团化学试剂有限公司,且均为分析纯试剂,使用前无需进一步纯化处理;所有溶液均用去离子水(18.2 MΩ·cm)配制。所有实验均在室温(25 ℃)下进行。
1.2 实际水样处理
海水水样采自黄海的沿岸区域(山东省),经0.45 μm滤膜过滤后置于酸洗净的聚乙烯瓶中。河水水样取自烟台流入黄海的河流大沽夹河。电镀废水水样取自烟台本地污水处理厂。电沉积所用乙酸盐缓冲溶液均由相应的水样配制而成。
1.3 实验步骤
图1为此联用方法的原理图。步骤A是电沉积步骤,将三电极体系置于10 mL 0.1 mol/L乙酸盐缓冲溶液(pH=5.0)中,于-0.6 V下搅拌沉积600 s;步骤B是介质转移和电极清洗步骤,将沉积后的三电极体系转移至10 mL 0.1 mol/L NaCl溶液中,于0.6 V下搅拌清洗电极400 s;步骤C是Cu(Ⅱ)的二乙基二硫代氨基甲酸钠光度法测定。主要步骤如下:将清洗完电极的溶液转移至分液漏斗中,加入5 mL EDTA-柠檬酸铵溶液,25 mL NH4Cl-NH4OH缓冲溶液(pH=9.0)和2.5 mL 2 mg/mL二乙基二硫代氨基甲酸钠溶液,静置显色10 min后,加入5 mL四氯化碳,剧烈振荡2 min后,以萃取有色络合物用于吸光度测量。
2 结果与讨论
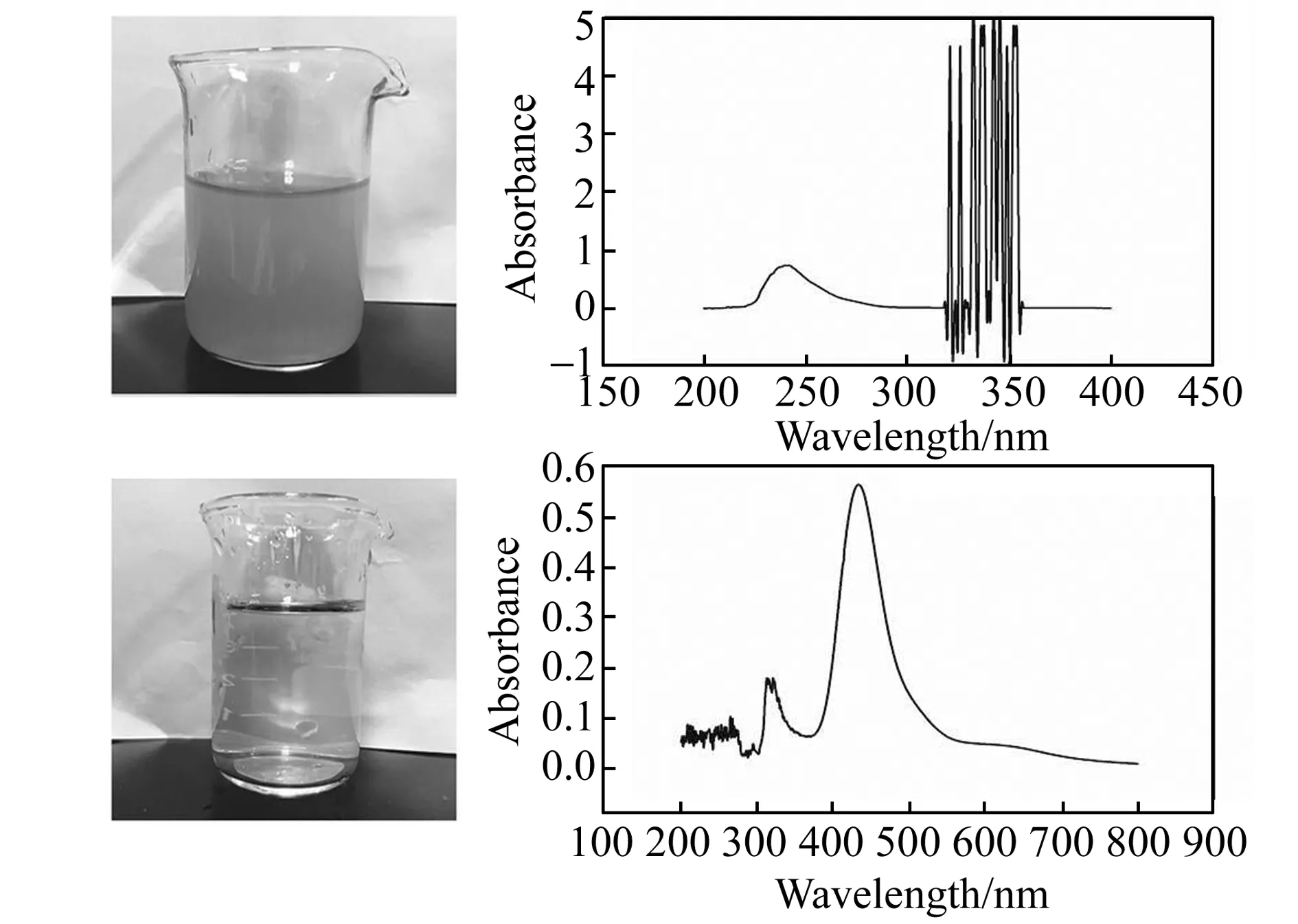
图2 浑浊有色介质(上)和干净转移介质(下)中紫外-可见(UV-Vis)分光光度法的信号对比Fig.2 A comparison of signals of UV-Vis spectrophotometry in the turbid,colored water(above) and the clean transferred medium(bottom)
2.1 不同水介质中紫外-可见吸收信号的比较
不同的水介质中紫外-可见分光光度法测定的信号比较如图2。添加相应的指示剂后,没有电化学预处理的浑浊有色介质中的信号杂乱无章且没有明显的可定量的峰,而转移介质后的干净介质中的信号峰峰形光滑突出并且很容易进行定量。表明这种联用方法可以有效避免水样浊度或颜色的干扰。
2.2 沉积电位的影响
探索了由电极上沉积的Cu(Ⅱ)溶出而产生的电流信号与沉积电位之间的关系。如图3所示,沉积电位从-0.8 V变化至-0.6 V时溶出峰电流随之增大,并在-0.6 V时达到最大值,之后峰电流随着电位的变化而减小。当电位大于0.2 V时,峰电流减至平台期,这可能是由于这些电位都不够负而无法导致Cu(Ⅱ)在电极上的还原。因此,之后的实验中,沉积电位采用-0.6 V。
2.3 沉积液pH的影响
考虑到沉积液的pH会大大影响沉积过程的效率和稳定性,并且Cu(Ⅱ)在中性或碱性溶液中易于发生水解,因此探索了pH在3.0~ 6.0之间沉积所用乙酸盐缓冲溶液的最适宜pH。如图4所示,当pH为5.0时溶出峰电流最大;当pH低于5.0时峰电流有所降低,可能是由于电极表面上H+和Cu(Ⅱ)之间的竞争还原造成;当pH大于5.0时,峰电流也有所降低,可能是由于pH升高,导致Cu(Ⅱ)水解。因此,接下来的实验中沉积液的pH选为5.0。

图3 沉积电位的影响Fig.3 Effect of deposition potentialConditions:0.1 mol/L acetate buffer(pH=5.0) containing 0.5 μg/mL Cu(Ⅱ),with deposition time of 600 s.

图4 pH的影响Fig.4 Effect of the pH valuesConditions:0.1 mol/L acetate buffer containing 0.5 μg/mL Cu(Ⅱ),with deposition time of 600 s and deposition potential of -0.6 V.
2.4 沉积时间的影响

图5 沉积时间的影响Fig.5 Effect of deposition timeConditions:0.1 mol/L acetate buffer(pH=5.0) containing 0.5 μg/mL Cu(Ⅱ).Other conditions are the same as in Fig.4.
电极上沉积的Cu(Ⅱ)的量与沉积时间相关,因此在沉积时间50~900 s之间探索了沉积时间的影响。如图5所示,600 s之前,峰电流随着沉积时间约呈线性增长,这说明在到达沉积饱和之前,沉积时间越长,沉积Cu(Ⅱ)越多,峰电流越大。在一定的沉积时间后,峰电流趋向平稳,这表明此时电极表面Cu(Ⅱ)富集趋向饱和。考虑到分析时间和能量消耗等因素,选取600 s为最佳沉积时间。
2.5 清洗时间的影响
为了保证沉积在电极表面的Cu(Ⅱ)完全被氧化进入用于光度法定量检测的干净空白介质中,探索了电极清洗时间的影响。沉积上Cu(Ⅱ)的电极被转移至10 mL 0.1 mol/L NaCl溶液中,于0.6 V电位下分别清洗0、100、200、300、400 s后差示脉冲伏安法(DPV)扫描。如图6所示,清洗后的电极的峰电流随着时间的增加而减小,清洗400 s后几乎降为0,表明400 s 足够完全清洗下沉积在电极表面的Cu(Ⅱ)。因此,清洗时间定为400 s。
2.6 显色时间的影响
为了保证Cu(Ⅱ)和显色剂二乙基二硫代氨基甲酸钠能够络合显色完全,因此对显色时间进行优化。如图7所示,当显色时间小于10 min时,随着时间的增加,吸光度增大,当时间大于10 min以后,随着时间的增加,吸光度只略微有所增大,总体趋于平稳。因此考虑到分析时间和能量消耗等因素,选取10 min为最佳显色时间。

图6 清洗时间的影响Fig.6 Effect of cleansing time0.1 mol/L NaCl,with cleaning potential of 0.6 V.

图7 显色时间的影响Fig.7 Effect of coloration time

图8 Cu(Ⅱ)浓度与吸光度的校准曲线Fig.8 Calibration curve of Cu(Ⅱ) concentration and the absorbance
2.7 标准曲线、检测限、重现性和选择性
在优化条件下建立了检测Cu(Ⅱ)的标准曲线。电极在乙酸盐缓冲溶液(pH=5.0)中以-0.6 V沉积600 s后,转移至0.1 mol/L NaCl 溶液中,0.6 V电位下清洗400 s后显色10 min,Cu(Ⅱ) 和吸光度之间的线性关系如图8所示。线性回归方程为:A=0.0039c-0.0119,相关系数R2=0.98,线性范围为10~100 μg/mL,检测限为1.6 μg/mL。此方法的高检测限可能是由于电极的低富集效率。考察了方法的重现性。在同样的条件下重复实验5次的相对标准偏差(RSD)为2.1%。此外,由于电极和光信号的稳定性,说明此方法具有良好且可靠的稳定性。因此,本文所建立方法表现出了良好的重现性和稳定性。
考察了共存离子干扰,结果表明在5 mL掩蔽剂EDTA-柠檬酸铵溶液存在下,当测定2 μg/mL Cu(Ⅱ),相对误差小于5%时,下列离子的允许倍数为:Mn2+(200)、Fe3+(125)、Fe2+(75)、Ni2+(50)、Co2+(150),而Pb2+、Zn2+、Cd2+、Hg2+、Al3+等与二乙基二硫代氨基甲酸钠生成无色配合物,不干扰Cu(Ⅱ)的测定,并且不同有色化合物的最大吸收波长是不同的,Cu(Ⅱ)和二乙基二硫代氨基甲酸钠反应所产生的配合物的最大吸收波长在433 nm。所以,针对Cu(Ⅱ)的检测,此联用方法具有良好的选择性。
2.8 实际水样检测
对取自不同地点的河水、海水和电镀废水中的Cu(Ⅱ)进行了检测。电沉积所用的乙酸盐缓冲溶液由相应的水样配制而成。检测结果如表1所示。此外,检测结果也与ICP-MS法的检测结果进行了比对,具有良好的一致性。说明该联用方法是可靠的,且适用于不同水样中Cu(Ⅱ)的检测。

表1 不同水样中Cu(Ⅱ)检测结果比较
3 结论
本文提出了一种检测水样中Cu(Ⅱ)的电化学-分光光度法联用技术,此方法具有良好的选择性和准确性,实现了在浑浊、污染的水样中对Cu(Ⅱ)的检测。此联用体系具有多种优势,如简易方便、高效、良好的重现性、稳定性和选择性。电极的低富集效率导致了此方法的检测限偏高,此问题会在未来的研究中着重改善及解决。
