阀切换离子色谱技术同时检测饮料中的糖类、甜味剂和防腐剂
2018-08-31沈燕飞朱仙娜童明亮陈梅兰
沈燕飞,朱仙娜,姚 澄,童明亮,陈梅兰*
饮料主要由饮用水及果汁、蔬菜汁或植物的根、茎、叶、花和果实的抽提液及各种添加剂组成。添加剂主要含甜味剂、食用色素、乳化剂、起泡剂、稳定剂和防腐剂等。防腐剂因能抑制微生物的生长繁殖[1],从而可延长保质期,被广泛添加使用。苯甲酸、山梨酸和对羟基苯甲酸酯类是使用最广泛的防腐剂[2-4]。许多研究表明,人体食用过量防腐剂会对人体健康造成潜在的危害[5-7]。糖类既是生命体的基本原料和主要结构成分,也是生命体维持生命活动的主要能量来源,更是饮料的呈味物质。除此之外,糖类能与蛋白质结合形成糖蛋白,在生命活动中发挥重要作用[8],但过量食用糖类不仅会使人发胖,同时还会诱发其他疾病,因此安赛蜜、糖精钠等甜度高、能量低的甜味剂被用来取代糖类。但我国对甜味剂和防腐剂的使用限量有严格的规定[9]。因此很有必要建立一种能同时测定糖类、防腐剂及甜味剂等的方法。目前,糖类检测方法有高效液相色谱法[10]、离子色谱-脉冲安培法[11-14]、液相色谱-示差折光检测法[15-16]、核磁共振氢谱法[17]和毛细管电泳法[18-19]。而甜味剂和防腐剂一般是通过紫外检测器[20-22]进行检测。但在实际检测过程中发现,这些物质有些有电化学信号却无紫外吸收,而有些有紫外吸收却无电化学信号,因此在分析测试中,需要分别对饮料中的防腐剂、甜味剂和糖类进行测定。现有的技术手段无法做到一次性完成,检测过程繁琐,单独测定不仅会造成人力财力的浪费,而且无法满足某些对时效性较强的检测需求,因此阀切换技术应运而生,可解决检测信号不同步的问题[23-24]。
鉴于糖类化合物分子具有电化学活性并在强碱溶液中呈离子化状态[25-27],所以阴离子交换色谱直流安培电化学检测是检测糖类物质较优的方法,样品无需衍生[28-31]。本实验建立了一种利用阀切换方法同时检测防腐剂、甜味剂和糖类的方法。方法的前处理简便,灵敏度高,定性、定量分析准确可靠。这种方法的整体性完整、重现性理想、回收率高、测定数据准确可靠,可以广泛应用于食品生产、饮料行业、生物医药中的生产工艺质量控制或最终成品的成分检测。
1 材料与方法
1.1 材料与试剂
红星二锅头(乙醇体积分数56%)、娃哈哈苏打水饮品、崂山白花蛇草水购自当地超市。苯甲酸、亚硝酸钠(分析纯) 上海振兴试剂厂;安赛蜜、山梨酸、糖精钠(纯度均为98%)、D-果糖(纯度99%)上海源叶生物科技有限公司;葡萄糖(分析纯) 天津市永大化学试剂有限公司;蔗糖(分析纯) 广州市金华大化学试剂有限公司。实验用水为超纯水(电阻率18.2 MΩ·cm)。
1.2 仪器与设备
ICS-5000型离子色谱仪(金电极,电化学检测器)美国赛默飞世尔科技有限公司;1200高效液相色谱仪(带紫外检测器) 安捷伦科技(中国)有限公司;HH-1型数显恒温水浴锅 金坛市江南仪器厂;GP50四元梯度泵 美国Dionex公司。
1.3 方法
1.3.1 溶液制备
标准储备液:将苯甲酸、亚硝酸钠、安赛蜜、山梨酸、糖精钠、葡萄糖、果糖、蔗糖配制成质量浓度为1 000 mg/L的贮备液,贮存于4 ℃冰箱备用。
标准混合溶液:分别移取一定量的上述标准储备溶液至10 mL的容量瓶中,用超纯水定容,配得质量浓度均为0.50、1.00、1.50、2.00、2.50 mg/L的混合标准溶液备用。
样品溶液的处理:把饮料或二锅头置于试管中,放置于80 ℃水浴中加热20 min并搅拌,以除去CO2气体或乙醇,减少两者对实验分析的影响。样品冷却至室温,过0.45 µm微孔滤膜后进样分析。原样品(未经前处理的样品)中待测物质的实际含量(A)按下式计算:
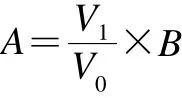
式中:A为原样品(未经前处理的样品)中待测物质的实际质量浓度/(mg/L);V1为样品经前处理(除去CO2或乙醇)后所剩的样品体积/mL;V0为样品前处理前所取的原样品体积/mL;B为经处理后样品进样所测得待测物质的质量浓度/(mg/L)。
1.3.2 色谱条件
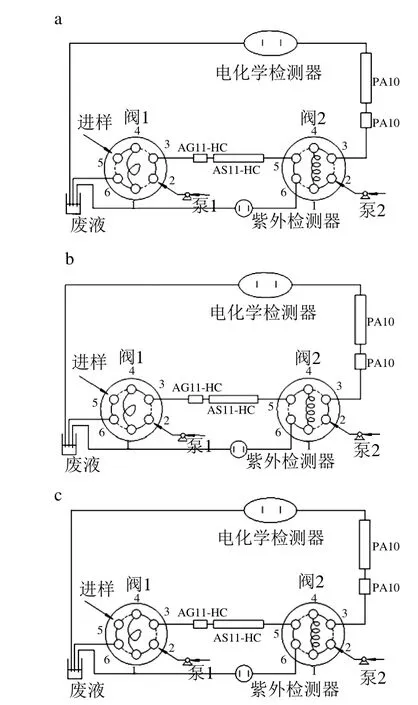

图1 色谱系统的工作过程Fig. 1 Working process of the chromatographic system
色谱系统的工作过程如图1所示,在连接时尽量缩短仪器单元与单元之间的连接线,以减少死体积。图1a是将样品装载到六通阀1中的25 μL定量环中;然后切换阀1至“Inject”状态,样品随着淋洗液进入分析柱IonPac®AS11-HC中,5 种物质(亚硝酸盐、苯甲酸、山梨酸、安赛蜜、糖精钠)在AS11-HC上面有保留,3 种糖(葡萄糖、果糖、蔗糖)在AS11-HC柱中保留较弱,在2.3 min被洗出通过阀2切换收集于定量环中,如图1b所示。3.3 min后,经阀2切换,收集在定量环中的物质经淋洗液冲入到CarboPac®PA10(4 mm×250 mm)分析柱中,经分离后电化学检测。而保留在AS11-HC中待测物经冲洗后进入紫外检测器检测,如图1c所示。分析完成后,系统切换到原始状态,如图1d所示。
糖类物质分离及检测条件:保护柱Dionex CarboPacTMPA10(4 mm×50 mm),分析柱Dionex CarboPac®PA10(4 mm×250 mm),流速1.0 mL/min,柱温35 ℃。以45 mmol/L的NaOH淋洗液等度洗脱,电化学检测(波形:Carbohydrates(Standard Quad))。
防腐剂、甜味剂分离及紫外检测条件:保护柱IonPac®AG11-HC(4 mm×50 mm),分析柱IonPac®AS11-HC(4 mm×250 mm);流动相:水和200 mmol/L的NaOH溶液,梯度淋洗条件见表1。进样量25 µL,柱温35 ℃,波长230 nm。
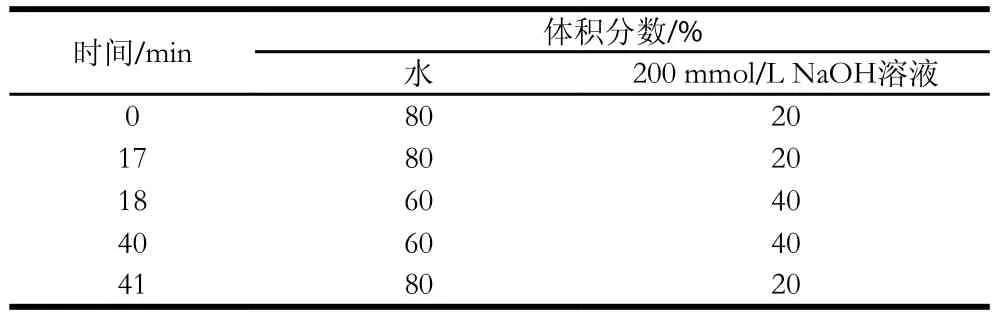
表1 防腐剂及甜味剂的梯度淋洗程序Table 1 Mobile phase gradient program for preservatives and edulcorant
2 结果与分析
2.1 淋洗条件的优化结果
在样品检测的过程中,通过对不同流动相条件进行实验,最终确定Dionex CarboPacTMPA10(4 mm×50 mm)保护柱,Dionex CarboPac®PA10(4 mm×250 mm)分析柱,用45 mmol/L的NaOH淋洗液、流速1.0 mL/min等度淋洗,分离3 种糖:葡萄糖、果糖和蔗糖,色谱图见图2。使用IonPac®AG11-HC(4 mm×50 mm)保护柱和IonPac®AS11-HC(4 mm×250 mm)分析柱,按1.3.2节的梯度淋洗条件,以1.0 mL/min的流速梯度淋洗防腐剂和甜味剂(亚硝酸盐、苯甲酸、山梨酸、安赛蜜、糖精钠),色谱图见图3。它们的保留时间为:在CarboPac®PA10(4 mm×250 mm)糖柱中的保留时间分别为葡萄糖12.2 min、果糖13.6 min、蔗糖16.3 min。3 种防腐剂(亚硝酸钠、山梨酸、苯甲酸)和2 种甜味剂(安赛蜜、糖精钠)无电化学信号,但能在IonPac®AS11-HC(4 mm×250 mm)阴离子柱中保留,保留时间分别为亚硝酸钠5.8 min、山梨酸8.7 min、苯甲酸13.4 min、安赛蜜27.6 min、糖精钠35.5 min。
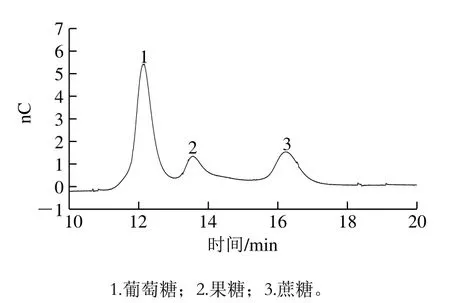
图2 葡萄糖、果糖和蔗糖混合标准样品色谱图(1.0 mg/L)Fig. 2 Chromatogram of mixed standard solutions of glucose, fructose and sucrose (1.0 mg/L)
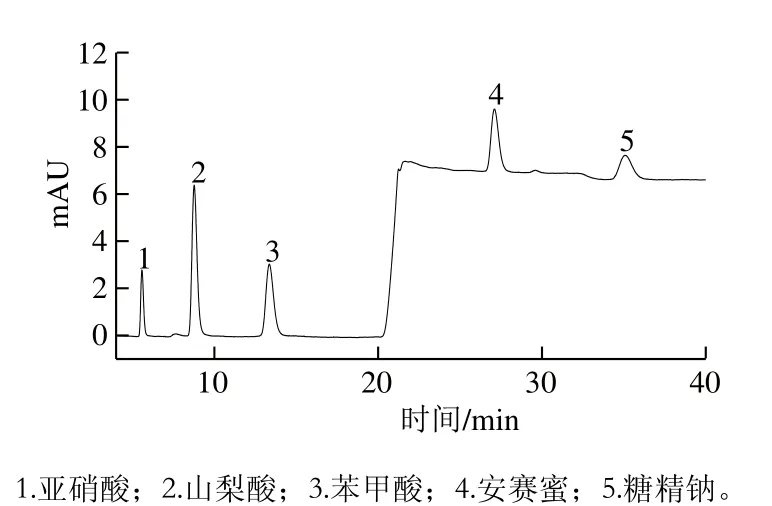
图3 亚硝酸、山梨酸、苯甲酸、安赛蜜和糖精钠混合标准样品色谱图(1.0 mg/L)Fig. 3 Chromatogram of mixed standard solutions of nitric acid, sorbic acid, benzoic acid, acesulfame potassium and saccharin sodium (1.0 mg/L)
2.2 切换时间的选择
为确定合适的阀切换时间,首先要确定糖类物质的大致出峰时间。在保护柱IonPac®AG11-HC(4 mm×50 mm)和分析柱IonPac®AS11-HC(4 mm×250 mm)后面直接连接电化学检测器,采用表1的梯度淋洗,观察2.0 mg/L 3 种糖类、3 种防腐剂和2 种甜味剂标准混合溶液的出峰情况,如图4所示,3 种糖类物质保留非常弱,在2.4 min左右开始冲出,在3.3 min左右已全部被冲出,3 种防腐剂和2 种甜味剂无电化学信号,但在紫外检测器中可知,防腐剂和甜味剂约在6 min后出峰(图3),因此可设置合适的切换时间,切换出3 种糖类而不影响后面物质的检测。
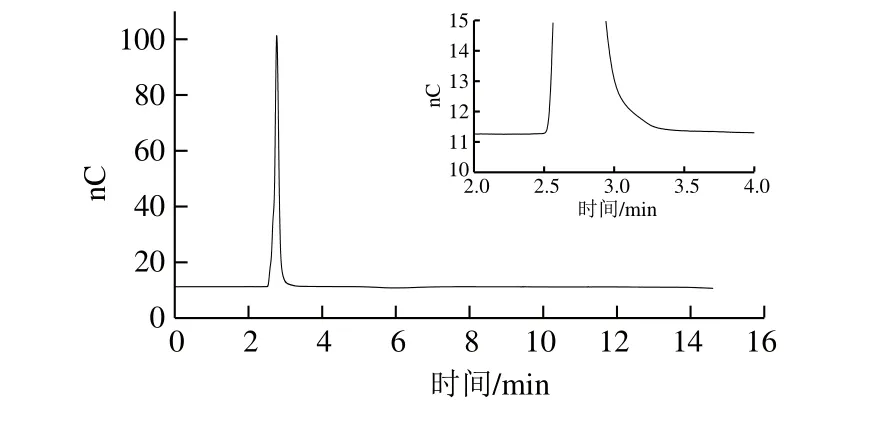
图4 葡萄糖、果糖和蔗糖混合溶液的色谱图(2.0 mg/L)Fig. 4 Chromatogram of mixture of glucose, fructose, and sucrose (2.0 mg/L)
其次,以防系统压力过高,选用定量环代替富集柱收集阀2切换出的液体,合适的定量环长度是保证收集完全的一个因素,太短可能导致前期收集的液体流出,太长导致峰展宽。首先根据切换的时间及流速推算出收集液体的体积,然后根据绿色peek管的直径计算需要管的长度,收集环的容积要略大于切换的量,以保证收集完全,最终确定定量环的长度为418 cm。为获得更准确的切换时间,对1.0 mg/L标准混合溶液进行一系列的测试。首先在第1个切换时间为2.4 min的条件下,分别测试第2个切换时间为3.1、3.2、3.3、3.4、3.6 min时标准混合溶液的出峰情况,得到各个糖和防腐剂、甜味剂的时间与峰面积关系如图5所示。
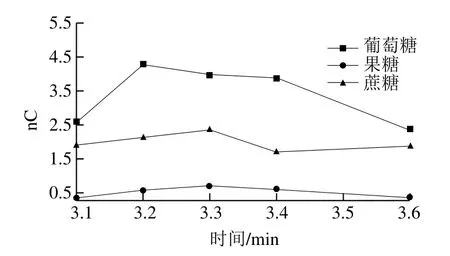
图5 3 种糖的第2个切换时间与峰面积的关系(1.0 mg/L)Fig. 5 Relationship between second switching time and peak area of 3 sugars (1.0 mg/L)
由图5可知,3.3 min时,富集效果最好,因此选择3.3 min为第2个切换时间。然后固定第2个切换时间为3.3 min,分别测试2.0、2.2、2.3、2.4、2.6 min时标准混合溶液的出峰情况,得到切换时间与峰面积关系如图6所示。由图6可知,2.3 min时,富集效果最好,因此选择2.3 min为第1个切换时间。
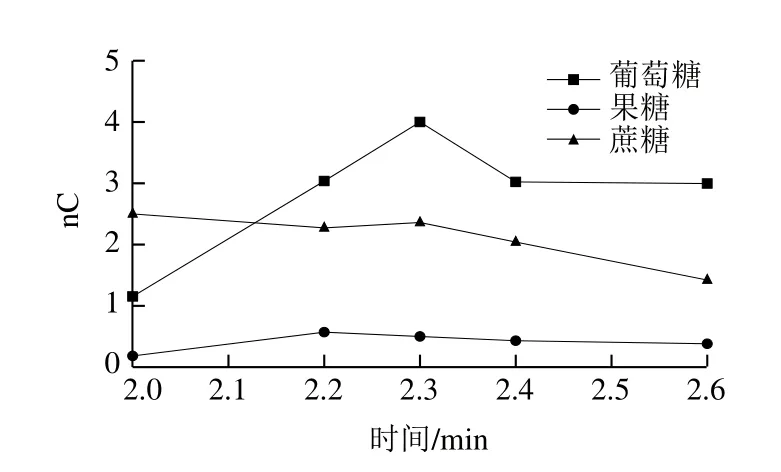
图6 3 种糖的第1个切换时间与峰面积的关系(1.0 mg/L)Fig. 6 Relationship between first switching time and peak area of three sugars (1.0 mg/L)
2.3 标准曲线的制作、重现性和检出限
使用贮备液配制0.5、1.0、1.5、2.0、2.5 mg/L的系列,按上述的色谱条件进样,得到峰面积和质量浓度的线性方程。对质量浓度为1.0 mg/L的标准混合溶液重复进样8 次求得方法的重现性及3 倍信噪比计算方法的检出限,结果见表2。该方法在0.5~2.5 mg/L线性范围内有较好的相关系数、检出限及重现性。
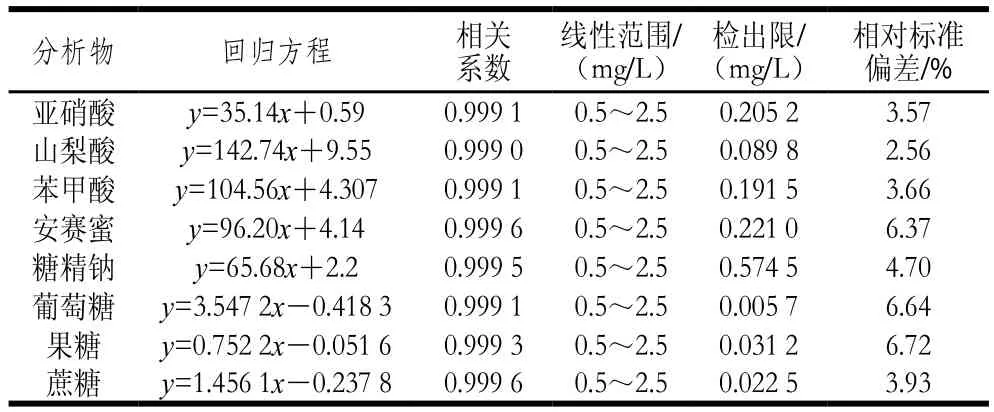
表2 线性关系及检出限Table 2 Linear relationship and detection limit
2.4 样品分析及回收率
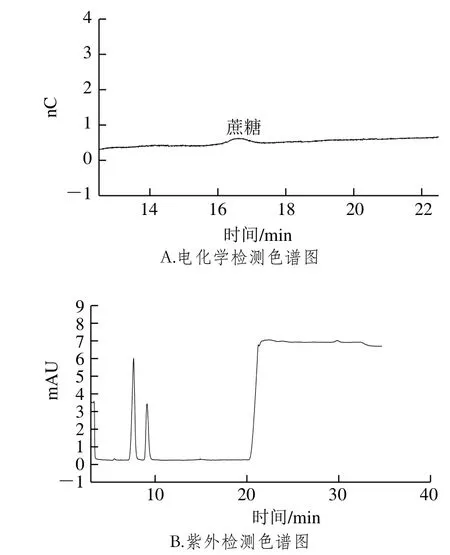
图7 蛇草水检测色谱图Fig. 7 Chromatogram for snake grass water
取10 mL样品于试管中,放置于80 ℃水浴加热20 min除去气泡或乙醇,冷却至室温,过0.45 µm微孔滤膜后,进样分析。蛇草水和二锅头的色谱图见图7~8。以同样的方法进行加标测定,平行进样3 次,测定加标回收率,回收率实验结果(表3~5)良好。注:—.未检出,下表同。
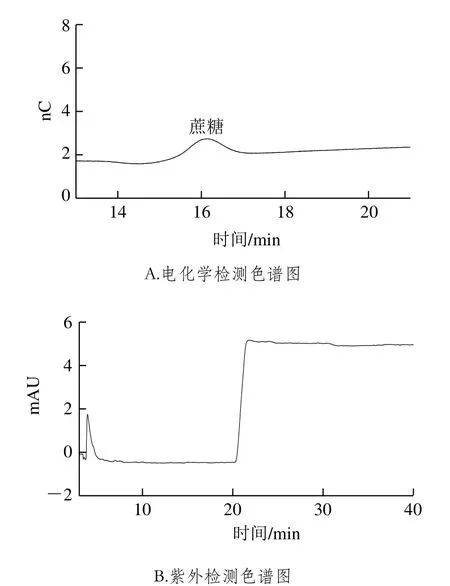
图8 二锅头检测色谱图Fig. 8 Chromatogram for Erguotou liquor

表3 二锅头加标回收率Table 3 Recovery from spiked Erguotou liquor
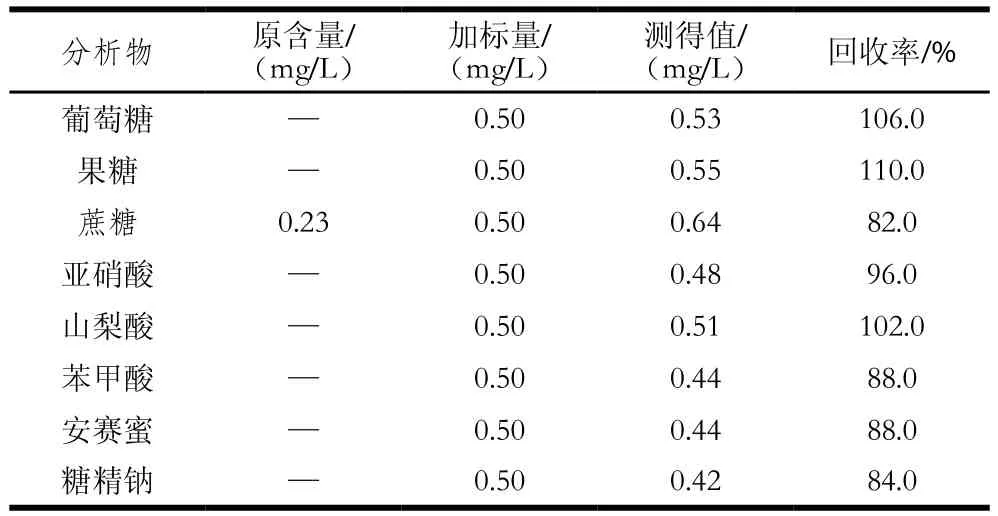
表4 蛇草水加标回收率Table 4 Recovery from spiked snake grass water
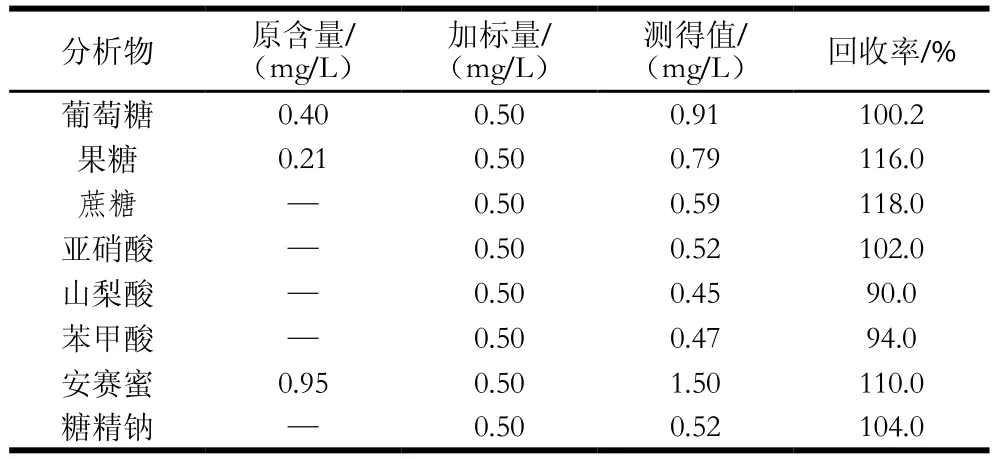
表5 苏打水加标回收率Table 5 Recovery from spiked soda water
3 结 论
采用阀切换离子色谱技术同时检测饮料中的3 种糖、5 种防腐剂和甜味剂,饮料样品经过前处理后进样,利用阀切换方法将3 种糖、3 种防腐剂、2种甜味剂在2.3 min时开始切换分离,3.3 min分离富集完毕,分别进入不同的分析柱进行分离检测。该实验大大缩短了物质单独分析所需的时间,实验简单方便,重现性、回收率等符合要求,可以应用于食品生产和饮料行业中的生产工艺质量控制或最终成品的成分检测。
