内源激素变化及外源生长素对紫花苜蓿种子萌发过程的影响
2018-08-24宋佳琦
宋佳琦, ,
(新疆农业大学草业与环境科学学院/新疆西部干旱荒漠区草地资源与生态省部共建教育部重点实验室,新疆 乌鲁木齐 830052)
已有对生长素(indole-3-acetic acid,IAA)的研究中,最先被发现的是生长素可以调节植物的向性生长,并在后续的研究中发现生长素具有调控组织分化[1]、器官的形态建成[2]、顶端优势[3]和花期[4]等多种功能。最近的研究表明,生长素在种子的休眠过程中起正向调控作用,因此生长素是第二类促进种子休眠的激素[5]。Wang等[6]和Liu等[7]在生长素调控种子休眠的研究中发现,转录因子ARF是种子休眠过程的关键调控因子,其中ARF10和ARF16是直接参与到种子休眠调控过程的两个关键ARF基因,这在分子水平上探讨了生长素调控种子休眠的机制。3-吲哚乙酸(3-Indole acetic acid,IAA)是应用最广并且生物活性最强的一种生长素[8],在蒺藜苜蓿(Medicagotruncatula)和羊草(Leymuschinensis)种子的萌发试验中,IAA对种子萌发的调控作用表现为:低浓度促进种子萌发,高浓度抑制种子萌发,且植物对IAA浓度变化的响应因植物的种类不同而具有差异[9-10];用IAA处理白三叶(Trifoliumrepens)种子后进行萌发试验,结果表明,用20mg·L-1的吲哚乙酸,可提高白三叶种子的萌发率,促进胚根、胚芽的生长[11];用20mg·L-1的IAA处理林地铁线莲(Clematisflorida)种子,提高了种子萌发率,平均萌发时间也比对照短[12]。IAA在种子萌发时有重要的调控作用,并且外源IAA能影响种子的萌发。研究生长素对种子萌发的影响多数集中于模式植物或经济作物,但对饲草作物的研究较少,有关激素调控紫花苜蓿种子萌发的研究鲜有报道。
本研究以紫花苜蓿为材料,分析了紫花苜蓿种子在不同萌发时期的內源激素变化,及其与苜蓿种子萌发间的关系,并且通过外源IAA浸种处理,研究了外源IAA对紫花苜蓿种子萌发的影响,以期为研究苜蓿种子萌发过程中的激素调控作用提供基础。
1 材料与方法
1.1 供试材料
试验材料为新牧4号紫花苜蓿(MedicagosativaL.‘Xinmu No.4’),由新疆农业大学“西部干旱荒漠区草地资源与生态”省部共建教育部重点实验室提供。
1.2 萌发试验
从供试样品中随机选取子粒饱满,大小均匀的苜蓿种子(种子硬实率约为25%),用10%的次氯酸钠消毒5 min,取出后用蒸馏水冲洗3次。取出后均匀放置在湿润的三层滤纸培养皿中,置于25℃恒温培养箱中,光照强度为60 μmol·m-2·s-1,光周期为12 h光照/12 h黑暗。用称量法及时补充蒸馏水,防止各培养皿中水势变动。共计12皿,每皿50粒种子。
根据种子萌发形态,在未萌发种子(M1)、露白种子(M2)、肧根长度1.0~1.2 cm种子(M3)、苗期种子(萌发第7天,M4)这四个时期取样,样品经液氮冷冻后放入-20℃冰箱中保存,采用酶联免疫吸附法(ELISA)测定样品中内源激素脱落酸(abscisic acid,ABA)、赤霉素(gibberellin,GA3)、生长素的含量。
1.3 外源生长素处理
从供试样品中随机选取子粒饱满,大小均匀的苜蓿种子,用10%的次氯酸钠消毒5 min,取出后用蒸馏水冲洗3次。将消毒后的种子分别浸泡在5、10、20、30 mg·L-1IAA处理液中2 h,以蒸馏水为对照(CK),取出后均匀放置在浸透不同浓度IAA溶液的三层滤纸培养皿中,置于25℃恒温培养箱中,光照强度为60 μmol·m-2·s-1,光周期为12 h光照/12 h黑暗。每个处理3次重复,每皿50粒种子。用称量法及时补充蒸馏水,防止各培养皿中水势变动。
种子以胚根突破种皮2 mm左右为萌发标准,每天观察记录种子萌发数,第4天统计萌发势,第7天统计萌发率并测定苗长、根长及生物量。萌发结束后取样,每个处理取0.5~1 g幼苗子叶经液氮速冻后置于-20℃的冰箱中,采用酶联免疫吸附法(ELISA)测定子叶中ABA、GA3、IAA的含量,试剂盒由中国农业大学提供。根据以上数据统计下列指标。
萌发率(%)=(第7天萌发种子粒数/供试种子总粒数)×100% ;
萌发势(%)=(第4天萌发种子粒数/供试种子总粒数)×100% ;
萌发指数( GI )=∑( Gt/Dt ),式中:Gt为在不同时间的萌发数;Dt为萌发日数;
活力指数( VI )=萌发指数×苗长
1.4 数据分析
数据通过Excel 2010进行整理,使用Origin 8.0软件作图。采用SPSS 20.0软件进行单因素方差分析及Duncan多重比较。
2 结果与分析
2.1 苜蓿种子不同萌发时期内源激素的动态变化
苜蓿种子萌发的不同阶段IAA含量在11.06~11.39 ng·g-1FW之间,M1到M2时期种子中IAA含量减少0.06 ng·g-1FW,M2到M4时期IAA含量逐渐增多并且M3到M4时期显著增加0.18 ng·g-1FW(P<0.05)。由表1可知,GA3含量变化幅度最大,随着苜蓿种子的萌发进程,种子中GA3含量逐渐上升,在M1到M2期间GA3含量显著升高,M2比M1时期增长1.75 ng·g-1FW(P<0.05)。ABA的含量变化是种子破除休眠的关键条件之一,ABA含量在M1到M3时期逐渐下降,M2较M1时期ABA含量显著下降0.35 ng·g-1FW(P<0.05),但在M3到M4期间,ABA含量略有回升。

表1 不同萌发时期苜蓿种子中内源激素的含量Table 1 The content of endogenous hormones in different germination stages of alfalfa seeds
注:同行不同字母表示差异显著(P<0.05),下同
Note: Different letters in the same line indicate significant difference at the 0.05 level, the same as below
2.2 不同萌发时期苜蓿种子內源激素间的比值变化
苜蓿种子萌发期间种子中各內源激素含量上下浮动,同时各内源激素间的比例也有变化。从图1可以看出,IAA/ABA、GA3/ABA变化趋势相似,在苜蓿出苗期(M1至M2时期)大幅度上升。在生根期(M2至M3时期)IAA/ABA增长幅度大于GA3/ABA,M3到M4期间IAA/ABA与GA3/ABA下降幅度相似。在苜蓿种子萌发过程中內源激素间的比例呈现不同变化,ABA与GA3、IAA具有显著的拮抗作用。

图1 不同萌发时期苜蓿种子中IAA/ABA、GA3/ABA的变化Fig.1 Changes of IAA / ABA and GA3 / ABA in alfalfa seeds during different germination stages注:不同字母表示差异显著(P<0.05)Note:Different letters indicate significant difference at the 0.05 level
2.3 外源生长素(IAA)对苜蓿种子萌发后子叶中内源激素含量变化的影响
不同浓度IAA处理下,子叶中IAA、GA3、ABA的变化对不同浓度IAA的响应不同。如表2所示,子叶中IAA的含量随着处理浓度的增长逐渐增多,当处理浓度为30 mg·L-1时,子叶中IAA含量最大为12.15 ng·g-1FW且显著高于其他处理(P<0.05),表明外源IAA浸种后,促进子叶合成IAA。
子叶中GA3含量呈现先升高后下降的趋势,当处理浓度为20 mg·L-1时,子叶中GA3的含量最大,显著高于对照(P<0.05),但30 mg·L-1处理下与对照相比子叶中GA3含量减少0.36 ng·g-1FW。脱落酸的含量变化与赤霉素和生长素均不同,不同浓度IAA处理下,子叶中ABA变化呈波浪型,当IAA处理浓度为10 mg·L-1时,子叶中ABA含量最少为3.47 ng·g-1FW显著低于对照(P<0.05)。

表2 外源IAA处理后苜蓿子叶中内源激素的含量变化Table 2 The change in content of endogenous hormones in alfalfa cotyledons after treated with exogenous IAA/ng·g-1 FW
2.4 外源生长素(IAA)对紫花苜蓿种子萌发特性的影响
通过比较不同浓度IAA浸种对紫花苜蓿苗长和根长的影响可知,在IAA浓度为30 mg·L-1时,苜蓿的苗长比对照减少0.03 cm,但无显著差异,其它处理均显著高于对照(P<0.05)。根长对IAA的响应与苗长不同,不同处理的IAA均可促进根的生长。当IAA浓度为10 mg·L-1时,苗长及根长生长最好分别高于对照43.1%和22.5%,其次为20 mg·L-1的处理。由表3可知,随着IAA浓度的升高,根长、苗长及生物量呈现先增大再减小的趋势,表明苜蓿种子萌发后的根、芽生长对IAA响应较敏感,适宜浓度的IAA促进根和芽的生长,但高浓度的IAA会明显抑制芽的生长。IAA浓度为10 mg·L-1时,萌发率、萌发势均显著高于其他处理(P<0.05),相比对照组的萌发率和萌发势分别提高了18.66%和31.81%,30 mg·L-1处理下种子的活力指数比对照下降了6.64%,10 mg·L-1和20 mg·L-1处理下活力指数及萌发指数显著高于对照(P<0.05)。综上所述,10 mg·L-1和20 mg·L-1的IAA可以促进紫花苜蓿种子的萌发,但浓度为30 mg·L-1时,种子的萌发参数均低于对照,不利于种子的萌发。
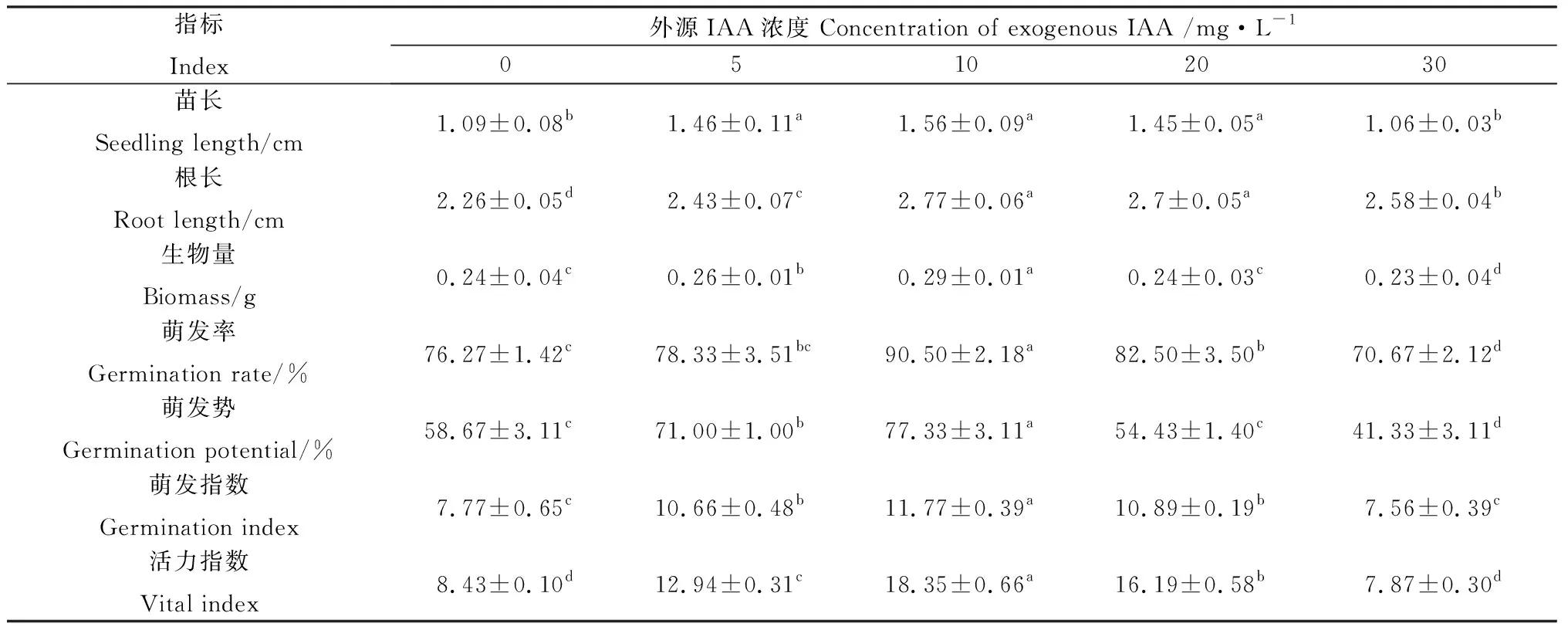
表3 不同浓度IAA处理下苜蓿种子萌发参数的变化Table 3 The change in germination parameters of alfalfa seeds after treated with IAA at different concentrations
3.1 苜蓿种子萌发不同时期内源激素的动态变化
种子萌发是植物生命活动开始的标志之一,在多种激素的协调下完成[13],种子生理休眠的诱导[14]及终止[15]在多种内源激素的协调、拮抗作用下完成。种子萌发时地上及地下生长过程中内源激素的含量变化各不相同。研究已证实ABA可以抑制种子萌发、维持种子休眠[16-17]。在本研究中紫花苜蓿种子萌发时根系的生长过程(M1至M3时期),种子中ABA含量逐渐下降,因为打破种子的休眠、胚根突破种皮均与ABA的含量有关。在种子萌发时首先需要吸胀,种子吸胀后,发生的重要现象之一就是ABA含量下降,并且ABA的敏感性降低,这是种子萌发的先决条件[18-19]。M3到M4时期过程中,ABA含量略有回升,可能是吸胀结束后,种子重新合成ABA,因为ABA能够增加液泡中糖的浓度,提高根系细胞吸取营养的能力,促进出苗[20]。
本试验中苜蓿种子萌发经历M1到M2时期时,ABA含量减少,GA3含量骤升,这与油茶(Camelliaoleifera)[21]、凤丹(TreePeony)[22]、重楼(RhizomaParidisYunnanensis)[23]等种子萌发过程中ABA与GA3含量变化相似。GA3促进种子萌发的作用在多种植物上已被证实[24]。在种子萌发时ABA与GA3表现出显著的拮抗作用[25]。在苜蓿种子萌发过程中GA3含量逐渐上升,这可能与GA3的大量合成有利于动员种子的储存物质和胚的扩张有关[26],并且种子萌发时积累大量GA3可以促进软化屏障组织水解酶的表达,降低胚根突破种皮的机械阻力,利于种子萌发[27]。
有研究证实IAA与ABA在种子萌发时具有相似作用,均表现为正向调控种子休眠[5]。本研究中,苜蓿种子在M1~M2时期,IAA含量下降,表明苜蓿种子萌发时,种子休眠的解除受IAA和ABA共同作用。生长素在植物顶端组织和幼嫩叶片中合成[28],低浓度的IAA促进植物的生长发育,浓度过高则抑制植物的生长。在苜蓿种子萌发后期,IAA含量逐渐增多,表明苜蓿地上和地下部分的生长需要合成IAA。
种子的萌发不仅受ABA、IAA、GA3等内源激素的调节,也与各内源激素间的平衡有关,特别是促进生长类激素与抑制生长类激素间的平衡[29]。本试验发现,苜蓿种子在不同萌发时期,GA3/ABA、IAA/ABA的比值整体升高,说明苜蓿萌发时激素间的平衡作用,对解除种子休眠,促进萌发有重要影响。Cadman[30]也认为GA/ABA值升高是种子解除休眠的原因,GA/ABA值呈上升趋势会打破种子休眠,促进种子萌发。
3.2 外源IAA对苜蓿种子萌发的影响
已有研究使用IAA浸种处理黄瓜(Cucumissativus)[31]、黑草(Buchneracruciata)[32]、蓝靛果忍冬(Loniceracaerulea)[33]等种子,发现IAA对种子萌发的影响,均呈现低浓度的IAA促进种子萌发及幼苗的生长,而较高浓度的IAA会降低种子的萌发率。本研究也得出了相似的结果,低浓度(10 mg·L-1)的IAA可促进紫花苜蓿种子的萌发,并且促进幼苗生长。外源IAA促进苜蓿种子萌发率及幼苗的生长,这与苜蓿种子萌发过程中内源激素的变化息息相关。种子萌发时GA和ABA表现为拮抗作用,ABA含量的下降是GA含量升高和敏感性增强的必要因素[34]。本研究中发现,随着IAA处理浓度递增,紫花苜蓿种子萌发时子叶中GA3含量逐渐增多,同时ABA含量逐渐减少,说明在外源IAA处理下,苜蓿种子萌发过程中GA和ABA依然有显著的拮抗作用。近期研究表明,ABA的含量变化取决于CYP707A2基因的活性[19]。在试验中通过IAA浸种后可能影响紫花苜蓿种子中CYP707A2基因的表达,导致子叶中ABA含量下降,促使GA的合成基因上调。
综上所述,外源激素IAA影响紫花苜蓿种子萌发时GA3、ABA含量,进而影响紫花苜蓿种子萌发。但激素的调控网络十分复杂,外源IAA如何影响苜蓿种子萌发时内源激素的调控网络,还有待进一步研究。
