金黄色葡萄球菌培养基的筛选及发酵条件的优化研究
2018-08-23李新圃罗金印刘龙海李宏胜
张 哲, 李新圃, 杨 峰, 罗金印, 刘龙海, 李宏胜
(中国农业科学院兰州畜牧与兽药研究所 农业部兽用药物创制重点实验室 甘肃省新兽药工程重点实验室,甘肃 兰州 730050)
金黄色葡萄球菌(Staphylococcusaureus,以下简称金葡菌)是人和动物最主要的致病菌之一,在自然界中分布极为广泛[1-2]。金葡菌之所以难以防治,是因为在菌体的表面存在一层“保护膜”,即荚膜(Capsule)。有研究表明,荚膜几乎存在于所有金葡菌菌株的表面,可保护细菌免受抑菌或杀菌物质的损害以及宿主吞噬细胞的吞噬,同时还有助于细菌黏附于宿主细胞表面以诱发感染,是细菌得以生存的重要表面结构[3]。荚膜的主要成分为多糖,是细菌结构变化最少的表面抗原,有较好的免疫原性,最适宜做疫苗的靶抗原之一[4]。现已证明,金葡菌荚膜基因的表达受生长环境,如培养基成分、培养条件等因素的影响,适宜的生长条件可提高菌体及荚膜多糖的产量[5-6]。为此,本研究选取了4种培养基(THB肉汤、哥伦比亚液体培养基、营养肉汤和脑心浸出液),在相同培养条件下,以菌液吸光度、菌体湿重等为指标,确定最适金葡菌生长的培养基;并通过单因素试验、正交试验优化等,对培养条件,如培养基初始pH、装液量、接种量及培养温度等进行探究,以筛选出最适宜金葡菌的生长条件,并通过透射电镜对优化前后培养细菌的荚膜进行比较观察。
1 材料与方法
1.1 材料
1.1.1 菌株 金黄色葡萄球菌J581,为本实验室前期分离鉴定并冻存的奶牛乳房炎病原菌强毒株。
1.1.2 培养基 血琼脂培养基,为广州市迪景微生物科技有限公司生产;脑心浸液肉汤(Brain Heart Infusion Medium, BHI)、营养肉汤(Nutrient Broth, NB)均为广州环凯生物科技有限公司生产;哥伦比亚培养基(Columbia Broth, CB)购自招远托普生物工程有限公司;Todd-Hewitt Broth(THB)为实验室自制。
1.1.3 主要试剂及仪器 新生牛血清(兰州民海生物工程有限公司),戊二醛固定液(Sigma)及乳清(实验室自制)等;透射电镜(JEM-1230,JEOL)。
1.2 方法
1.2.1 培养基的筛选 开启冻存的菌种J581,以1%的接种量接种至2 mL营养肉汤管中,37 ℃培养10 h制备一级种子发酵液;取0.3 mL一级种子液接种于装有30 mL营养肉汤的三角锥瓶中,恒温摇床(37 ℃、120 r/min)培养至12 h得二级种子发酵液,短期置4 ℃冷藏备用。按1%的接种量将二级种子液分别接种于含500 mL THB、CB、NB及BHI液体培养基中,混匀后各取150 mL,分装至5个100 mL灭菌摇瓶中(每种培养液含1瓶350 mL和5瓶30 mL)。所有摇瓶均置于恒温摇床培养至28 h(37 ℃、120 r/min)。每隔4 h从350 mL摇瓶中取样5 mL,采用pH计测定菌液pH值;取样3 mL,测定600 nm处的吸光度;取样1 mL进行稀释,并采用软件计数法[7]对平板上的菌落进行计数。分别在0、8、16、24及28 h于5个含30 mL的三角瓶中取15 mL置于离心管中,低温离心后菌体称重。
1.2.2 培养基外加营养成分的筛选 经过对4种培养基的筛选比较,哥伦比亚培养基(CB)最适于金葡菌J581的生长。为进一步优化CB,查阅相关文献[6,8-10],在CB中分别添加葡萄糖、乳糖、乳清和血清,通过测定菌液的吸光度、活菌数及菌体产量,确定适宜的外加营养成分。按照步骤1.2.1中方法制备种子发酵液,以1%的接种量分别接种到添加有1%葡萄糖、1%乳糖、1%乳清和1%血清的CB中,37 ℃、120 r/min培养至16 h;以CB为参比,测定OD600,采用CB稀释至10-7,取200 μL涂布计数,离心收集菌体,称量菌体湿重。
1.2.3 培养条件单因素试验 采用优选的培养基(CB),对不同的装液量、初始pH、接种量、发酵温度、转速以及1.2.2中优选的营养成分(乳清)添加量进行单因素试验,各因素水平选择见表1。除各因素变量外,初始培养条件为装液量30%(体积分数),接种量1%(体积分数),乳清添加量1%(体积分数),初始pH 7.0(高压灭菌前),37 ℃、120 r/min摇瓶培养。培养至16 h,测定OD600,离心收集菌体,称量菌体湿重。
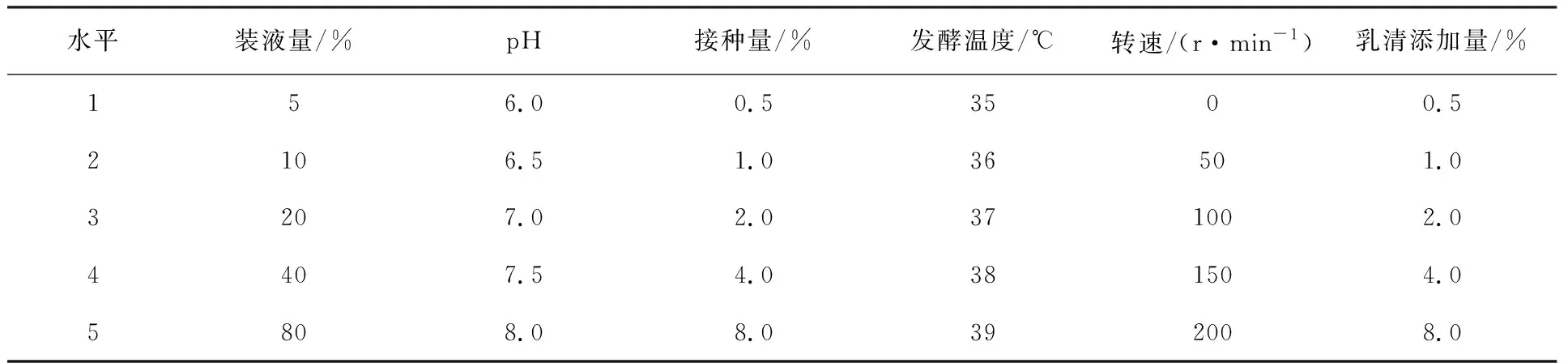
表1 培养条件单因素试验
1.2.4 正交试验优化培养条件 根据单因素试验结果,以起始pH、接种量、发酵温度及乳清添加量为试验考察对象,以菌体湿重为考察指标,设计 L9(34)正交表,其因素水平见表2。

表2 L9(34)正交设计编码值及水平
1.2.5 菌体的电镜观察 金葡菌分别按照优化前后的条件进行发酵培养至12 h,各取1.5 mL金
葡菌发酵液,8 000 r/min离心5 min,弃去上清,加入2.5%的戊二醛固定,送至兰州大学医学院电镜中心做透射电镜观察。
2 结果与分析
2.1 培养基的筛选
经过对4种培养基(THB、CB、NB和BHI)的pH值、吸光度及菌体湿重等相关指标的测定,绘制各指标随培养时间变化的曲线(图1),综合分析表明,相同培养条件下,哥伦比亚培养基(CB)最适于金葡菌J581的生长,确定16 h为最佳培养时间。利用CB发酵金葡菌,其菌体产量(0.215 g/15 mL)是NB培养菌体产量(0.142 g/15 mL)的1.5倍。

图1 不同培养基的pH值变化曲线图(A)、活菌数变化曲线(B)、吸光度变化曲线(C)、菌体湿重变化曲线(D)Fig.1 Variation curves of pH(A), colony-forming units (B), absorbance (C), and bacterial weight in different medium(D)
2.2 外加营养成分的筛选
通过测定培养至16 h菌液的活菌数、菌体湿重及OD600,得到添加不同营养成分对细菌生长的影响,如图2所示。由图2可知,与其他营养成分相比,在CB中添加乳清,更有利于金葡菌的生长。
2.3 培养条件单因素试验
通过测定菌体湿重及600 nm处的吸光度,得到不同装液量、初始pH、接种量、发酵温度、转速及乳清添加量对细菌生长的影响,如图3所示。结果表明,摇瓶装液量越少,转速越高,菌体生长状况越好。但结合生产实际,装液量过少将导致资源的浪费,确定30%的装液量为最佳;而转速过高,可能导致摇瓶被晃出,带来安全隐患,因此确定200 r/min为最佳转速。考虑到各培养条件间可能存在的相互作用,对菌液起始pH、接种量、发酵温度及乳清添加量,还需进行正交试验。
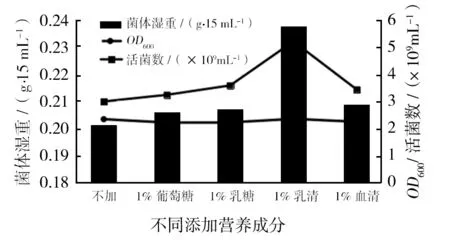
图2 外加营养成分的筛选Fig.2 Screening of nutrient components

图3 装液量(A)、pH(B)、接种量(C)、发酵温度(D)、转速(E)及乳清添加量(F)对细菌的影响Fig.3 Effect of liquid medium volume (A), pH (B), inoculation amount (C), fermentation temperature (D) shaking speed (E) and addition of whey (F) on growth of bacteria
2.4 正交试验优化培养条件及验证
对起始pH、接种量、发酵温度及乳清添加量的正交试验,结果见表3。从表3可以看出,各因素对试验结果的影响程度大小为发酵温度>初始pH>乳清添加量>接种量。综合来看,优选的实验方案为A2B2C2D2,即高压灭菌前调pH至7.0,添加2%的乳清,接种量为1%,37 ℃、200 r/min摇床震荡培养。因正交试验组合中无此组合,故需照此条件做一个补充验证性试验。结果表明,该优选方案每15 mL菌液获得0.258 g湿菌体,优于9号实验方案(0.242 g),与优化前(0.215 g)相比,菌体产量提高了20%。
2.5 菌体的透射电镜图像
将菌体在透射电镜做50 000倍放大,结果如图4所示,其中A为优化前条件培养的菌体,B为采用优化后条件培养的菌体。由图4可知,菌体外层半透明状物质即为菌体荚膜,在优化后条件下培养的细菌,荚膜层增厚且有荚膜菌体数量增多。

表3 试验方案及结果

图4 透射电镜下的菌体Fig.4 Observed bacteria by TEMA:优化前菌体;B:优化后菌体Bacteria before optimization (A) and after optimization (B)
3 讨 论
微生物发酵受内部代谢机理、调控机制等影响,同时还受到外界环境(如培养基成分、发酵温度及培养时间等)影响。因此筛选合适的培养基,并对培养条件进行优化,对于实现目标产物的高产、经济等,显得尤为重要[11-12]。本研究选取了4种培养基(THB、CB、NB和BHI)进行金葡菌的发酵培养,对菌液吸光度、菌体湿重等指标进行了比较分析,结果表明,哥伦比亚培养基(CB)最适于金葡菌的生长,这一结果与国内外多位学者研究结果一致。因此,本研究最终选择CB作为后续研究的基础培养基。
为进一步提高金葡菌的产量,本研究通过单因素试验对不同外加营养成分(葡萄糖、乳糖、乳清和血清)、不同装液量、初始pH、接种量、发酵温度、转速及乳清添加量等进行了研究。与其他外加营养成分相比,添加乳清的培养基,更适合金葡菌的生长。乳清是干酪生产过程的副产物,含有牛奶中一半以上的营养物质,20%左右的牛奶蛋白、几乎全部的乳糖、多种维生素以及矿物质等[13]。试验用的金葡菌分离自患病奶牛乳汁中,因此乳清的添加更有利于该菌株的生长。乳清能否有利于其他来源金葡菌的生长,还有待于进一步探究。试验表明,装液量越少,越适于金葡菌的生长。这可能是由于装液量越少,摇瓶中的空气越充足,更适合细菌的生长繁殖。因此,摇瓶发酵金葡菌时,装液量越少越好,但考虑到生产实际需求,本研究最终选择30%的装液量作为初始装液量。由于发酵罐可以往发酵液内不断注入空气,因此当用发酵罐进行发酵培养时,装液量的确定还需进一步的研究。培养基的pH值对微生物的生长与代谢有较大影响,如微生物酶活性、细胞膜电荷及细胞膜通透性等,从而影响微生物对营养物质的吸收及代谢物的外排等。本研究发现,金葡菌培养基初始pH 7.0为最佳,且在发酵过程中,菌液的pH值先下降,在发酵后期上升。大多数的葡萄球菌都能分解葡萄糖、麦芽糖和蔗糖,产生乳酸、乙酸和苹果酸等,这些有机酸的产生导致了pH值的下降。发酵后期菌体发生自溶,导致核酸类物质外排,从而引起pH的上升;此外,其他生理酸碱性物质利用后也会造成pH的波动[14]。此外,接种量、发酵温度、转速及乳清添加量对金葡菌的生长均有较大的影响,通过试验比较确定,调发酵液pH 7.0,添加2%乳清,30%装液量,接种量1%,37 ℃,200 r/min摇瓶培养至16 h为最佳培养条件。
正交试验具有所需实验次数不多、可显著提高试验效率,是科学研究中最常用的试验设计方法之一[15]。本研究利用SPSS软件,以起始pH、接种量、发酵温度及乳清添加量为试验因素,以菌体湿重为考察指标,设计 L9(34)正交表,做正交试验。最终确定,调发酵液pH7.0,添加2%的乳清,30%的装液量,1%的接种量,37 ℃、200 r/min摇瓶培养至16 h。与试验优化前相比,菌体产量提高了20%。
本研究首次报道了乳清对金葡菌生长的影响,并利用透射电镜对优化前后的金葡菌进行了比较观察,结果表明,优化后条件下培养的细菌,荚膜厚度增加,为后续荚膜多糖疫苗的研究提供了参考。然而,多糖的提取纯化工艺尚未建立,因此未能对优化前后细菌产生的多糖进行提取,以比较荚膜多糖的增加量。
