致病性副溶血性弧菌菌落杂交检测体系的优化
2018-08-23徐马俊坤张昭寰孙晓红潘迎捷
徐马俊坤, 冯 博, 张昭寰, 孙晓红,2,3, 潘迎捷,2,3, 赵 勇,2,3*
(1.上海海洋大学 食品学院,上海 201306;2.上海水产品加工及贮藏工程技术研究中心, 上海 201306;3.农业部 水产品贮藏保鲜质量安全风险评估实验室(上海),上海 201306)
副溶血性弧菌(Vibrioparahaemolyticus)是一种嗜盐性革兰阴性弧菌,广泛分布于河海交界处、海水及沿海地区,是我国沿海地区引起食物中毒的重要致病菌[1-3]。随着海产品消费水平的不断提高,在日本、北美、东南亚等地微生物引起的食源性疾病爆发事件中,副溶血性弧菌污染也成为首要因素[4-7]。副溶血性弧菌经污染的食物进入消化道后,附着于肠道细胞,在肠道繁殖并分泌出各种分泌物,易引起急性胃肠炎和原发性败血症等疾病[8-9]。其中溶血毒素是副溶血性弧菌的主要致病因子,包括分别由毒力基因tdh和trh编码产生的耐热直接溶血毒素(thermostable direct hemolysin,TDH)和相对耐热直接溶血毒素(TDH-related hemolysin,TRH)[10-11]。副溶血性弧菌在水产品中虽然有很高的检出率,但其中致病性菌株比例较低。传统的副溶血性弧菌检测方法费时费力,且难以区分致病性菌株,给定量风险评估带来了很大障碍。随着分子生物学技术的发展,分子生物学方法已经成为现代微生物学的重要手段。其中原位杂交(insituthybridization)技术的原理是dsDNA变性后与带有互补序列的同源单链配对,退火复性后形成双链结构的DNA或DNA/RNA异质双链分子。带有标记的探针与固定在玻片或纤维膜上的组织或细胞中特定的核苷酸序列进行杂交,可以探测其中所有的同源核酸序列,无需单独提取DNA或RNA。该技术灵敏度高,特异性好[12],可根据探针的选择提供微生物数量和致病性等多种信息。原位杂交方法一方面可以为致病菌株的筛选提供便利,大大提高菌种筛选的针对性;另一方面其本身也是一种高效的检测方法。但在菌落的原位杂交中存在着杂交背景复杂及杂交结果不稳定的问题,目前尚鲜有报道用于副溶血性弧菌的检测,因此,进一步优化杂交体系显得尤为迫切。本研究重点探讨致病性副溶血性弧菌检测中菌落杂交技术的应用,并优化菌落杂交技术用于致病性副溶血性弧菌检测的最佳条件,从而使水产品中副溶血性弧菌的风险评估更快、更准确、更简便。
1 材料与方法
1.1 材料
1.1.1 菌株 副溶血性弧菌(Vibrioparahaemolyticus)标准菌株ATCC17802(tdh-/trh+)、ATCC33846(tdh+/trh-)、ATCC33847(tdh+/trh-)及由本实验室自海产品中分离获得的副溶血性弧菌野生菌株VP24(tdh-/trh-),所有菌株的毒力基因均经过tPCR方法鉴定。单增李斯特菌(Listeriamonocytogenes)菌株WaX12 为上海市市场购买的生猪肉中分离得到的野生致病菌。
1.1.2 试剂 地高辛检测试剂盒(瑞士Roche公司),尼龙膜(美国Sigma公司),胰蛋白胨大豆肉汤培养基(TSB),硫代硫酸盐-柠檬酸盐-胆盐蔗糖琼脂(TCBS琼脂),脑心浸液肉汤(BHI)均购自北京陆桥技术有限责任公司;其他试剂均为国产分析纯。
1.1.3 主要仪器 HL-2000组合型分子杂交箱(美国UVP公司),Bio-Tek 酶标仪(美国伯腾仪器有限公司),5810R离心机(美国Eppendorf公司)。
1.2 方法
1.2.1 菌液的制备 将副溶血性弧菌划线接种于TCBS 平板,挑取单菌落于5 mL TSB的试管中,37 ℃、180 r/min 摇床培养10 h,连续活化2 次,作为接种液,备用。单增李斯特菌接种至BHI 液体培养基,37 ℃摇床培养10 h,按 1∶ 100比例接种于5 mL BHI 液体培养基,37 ℃摇床培养备用。
1.2.2 探针的合成 本研究所用的寡核苷酸探针为p-tdh、p-trh及p-toxR,根据文献报道合成[13]。p-tdh用于检测毒力基因tdh,探针序列为5′-CAACTTTTAATACCCAAGCTCCGGTCAATGTA-AAGG-3′;p-trh用于检测毒力基因trh,探针序列为5′AGGCTCAAAATGGTTAAGCGCCTATATGAC-GGTAAA-3′;p-toxR用于检测副溶血性弧菌标志基因toxR,探针序列为5′-ATTACTACCGATTTGC-GTACTGCTGTTTACAAACCC-3′。所有的DNA探针委托生工生物工程(上海)股份有限公司合成,并采用地高辛5′端标记,保存浓度为25 ng/μL。
1.2.3 斑点杂交 斑点杂交是通过在杂交膜上点加样品DNA代替菌落的原位杂交检测方法。通过斑点杂交方法对探针性能进行验证,并在基础流程基础上确定一套较为快速简便的杂交条件下限用于后续优化的参考。取副溶血性弧菌接种液100 μL接种到9 mL TSB中,单增李斯特菌接种液100 μL接种到9 mL BHI中,37 ℃、180 r/min 摇床培养10 h,通过DNA提取试剂盒提取DNA。通过将ATCC33847的DNA以150 μg/mL 2 μL,100 μg/mL 2、5、10 μL, 50 μg/mL 2、5、10、15 μL的不同点样量滴加到杂交膜上,于80 ℃热固定2 h,按试剂盒所建议方法杂交显色,确定合适的DNA点样量,以用于后续优化实验。将菌株ATCC17802、ATCC33846、ATCC33847、VP24的DNA模板分别点到杂交膜上,并以单增李斯特菌DNA作为对照,进行同样的斑点杂交显色验证探针的特异性实验,每组实验重复2次。
1.2.4 菌落杂交 菌落杂交的主要步骤为印迹、裂解、固定、预杂交、杂交、显色。本研究参考DIG Application Manual for Filter Hybridization (DIG-AMFH, Roche Diagnostics,2008)的方法,结合 Roche公司 DIG High Prime DNA Labeling and Detection Starter Kit Ⅰ试剂盒进行杂交实验。①前处理过程的优化:a.涂布平板:取副溶血性弧菌接种液进行10×梯度稀释后,滴加到添加了3% NaCl的TSA培养基上涂布平板,37 ℃培养10~16 h,每1 h对菌落进行观察并取样筛选用于影印,比较影印结果。b.菌落转移:尼龙膜剪成比培养皿略小的圆形,在膜上斜剪一刀作为标记,以确定膜的正反面和菌落位置。将杂交膜分别覆盖平板20、40和60 s,比较影印结果。 c.菌落裂解:碱裂解法:反复从膜反面渗透0.5 mol/L的NaOH溶液裂解并通过Tris·Cl(pH 7.4)平衡后晾干;溶菌酶处理:将膜浸入含有溶菌酶(2 mg/mL)溶液中,37 ℃作用30 min。单独使用两种不同处理方法,杂交并比较显色结果。d.DNA的固定:通过紫外交联2 min后晾干备用;80 ℃热固定2 h后备用。单独使用两种不同处理方法,杂交并比较显色结果。e.洗膜:2×SSC 0.5% SDS溶液漂洗杂交膜2次,需要充分浸润并轻轻振荡,每次5 min。0.5×SSC 0.5% SDS溶液漂洗杂交膜2次,每次5 min。②杂交显色过程的优化:a.预杂交:严谨洗涤杂交膜去除菌落碎片和未固定的DNA后,将每张杂交膜分装到不同容器,加入5 mL以上预热的杂交缓冲液,进行37 ℃ 30 min的预杂交。b.杂交:倒出预杂交液,向每张杂交膜上加入3.5 mL预热的杂交液(探针浓度25 ng/mL),37 ℃振荡孵育,分别测试4、6、8、10、12 h的杂交时间,比较显色结果。c.显色:对杂交膜进行一次严谨洗涤去除未结合的探针后,按照地高辛杂交检测试剂盒 I 的说明进行信号检测。洗涤缓冲液中Tween-20浓度调整为0.2%、0.3%、0.4%(体积分数),封闭和抗体结合时间分别延长0.5 h,比较显色结果。对比显色结果,4 h起每隔1 h进行观察,或8 h第一次观察后,每隔1 h进行观察。所有比较显色结果的优化实验重复2次。
2 结果与分析
2.1 斑点杂交对探针的鉴定
根据Suffredini等[13]的报道,本研究所使用的3个寡核苷酸探针特异性、灵敏度较好,性能基本相同。通过斑点杂交进行了验证实验,如图1所示,结果证明本实验所用菌株DNA均能被对应探针正确检出或排除。图2为通过tdh探针检测不同浓度ATCC33847菌株DNA的斑点杂交结果。从图 2 可看出,在斑点杂交中,DNA浓度对显色结果有较大影响,且低浓度时有结果不稳定的风险,但在同样的DNA浓度下,由于尼龙膜的毛细作用,在将DNA 点样量提高到10 μL以上后不能再提高显色结果,同时提取100 μg/mL以上浓度的DNA通常需要增加额外的操作和检测。因此斑点杂交实验确定的点样量为100 μg/mL 10 μL,用于后续的优化实验。
通过斑点杂交的预实验显示,对于DNA样品的检测,紫外交联2 min固定,37 ℃预杂交30 min、杂交4 h、显色8 h的杂交方法可以获得较为正常的显色结果。
2.2 菌落原位杂交前处理方法的优化
2.2.1 细菌培养和影印 根据比较影印后平板和膜上菌落,选择了37 ℃ 14 h的细菌培养时间,细菌培养时间过短,平板上菌落过小,影印后容易出现损失,对应性差不利于后续使用;培养时间过长菌落过大甚至出现自溶,影响后续杂交显色。
2.2.2 菌体裂解 在菌落杂交中对溶菌酶处理和碱法裂解进行了比较,结果显色差异不明显,但溶菌酶需要浸泡处理,且也存在一定不稳定性,根据菌落本身的生长状态和影印的质量不同,易造成极为复杂的背景甚至实验失败,图3为不同前处理方式的菌落显色后的结果。在菌体的裂解过程中,溶菌酶主要通过破坏细胞壁使内容物逸出而使细菌溶解。而副溶血性弧菌是一种细胞壁较薄的革兰阴性菌,碱裂解法可以完全替代溶菌酶处理,同时碱裂解法从反面渗透,保持了菌体DNA不会随液体逸散,也增强了实验结果的稳定性。
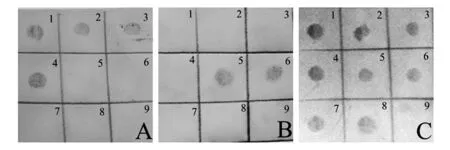
图1 3种寡核苷酸探针用于斑点杂交检测副溶血性弧菌及单增李斯特菌DNA的结果Fig.1 The results of Vibrio parahaemolyticus and Listeria monocytogenes DNA detected by dot blot hybridization using 3 oligoprobes1、2:菌株ATCC33846;3、4:菌株ATCC33847;5、6:菌株ATCC17802;7、8:菌株VP24;9:菌株Wax12;A:p-tdh检测结果;B:p-trh检测结果;C:p-toxR检测结果1, 2: ATCC33846; 3, 4: ATCC33847; 5, 6: ATCC33802; 7, 8: VP24;9: Wax12; A:detected by p-tdh; B:detected by p-trh; C:detected by p-toxR
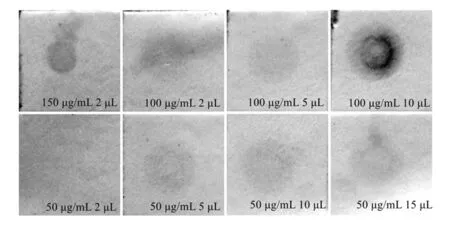
图2 不同DNA点样量的斑点杂交显色结果对比Fig.2 Comparison of different sampling amount in dot blot hybridization
2.2.3 固定方法 通过斑点杂交比较了紫外交联2 min和热固定2 h的固定方法,其结果显色和背景均无明显差异,但是紫外交联法在菌落原位杂交实验中存在实验结果不稳定的现象,给实验增加了一定的不确定性,可能是由于表面没有充分干燥或菌落较厚,水膜或是菌体本身阻挡了紫外线的穿透,造成菌体与膜的接触位置并未实际获得紫外交联的效果。同时紫外交联的功率需要专用的器材保障是检测方法推广中的一项障碍。而考虑到紫外交联本身所需时间较短,在实际实验中,也可以考虑紫外与热固定联用的方法。
图3为前处理过程优化前可能出现的结果和优化后的显色结果,根据优化结果,本实验后续的菌落原位杂交选择采用37 ℃培养14 h后影印、碱法裂解、80 ℃热固定2 h的前处理方法。
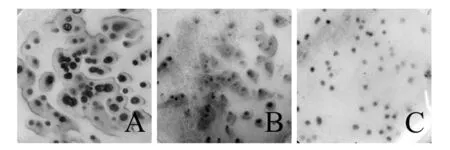
图3 不同前处理方法获得的菌落原位杂交显色结果对比Fig.3 Comparison of different pretreatment methods in colony in situ hybridizationA:培养时间过长的菌落影印后的显色结果;B:溶菌酶处理菌体的显色结果;C:优化方法后的显色结果A: the result of long-time culture colonies;B: the result of lysozyme method C: the result of optimization
2.3 菌落原位杂交过程的优化
2.3.1 杂交时间 由于寡核苷酸探针长度较短,探针本身对温度的要求差异较小,因此杂交过程主要针对杂交时间进行摸索。在实际杂交过程中由于杂交效率随时间的增长存在收益递减的现象,在斑点杂交实验中大部分杂交过程实际在前4 h已基本完成。但在菌落原位杂交实际操作的比较中,37 ℃杂交4~6 h的杂交结果仍存在显色不明显的现象和结果不稳定的风险,而8~10 h的过夜杂交则可以明显增强实验的稳定性和改善显色的结果。而8 h后的杂交几乎已经没有收益,但在14 h内并未观察到延长时间对显色造成负面影响。可能是由于基础流程的洗脱过程已较为完善,探针很难在杂交膜空白处产生残留。
2.3.2 免疫检测 在标准流程所获结果不稳定,背景复杂的基础上,主要针对去除背景、增强稳定性对免疫检测和显色过程进行了一系列调整,将封闭时间和抗体结合时间分别延长0.5 h后,信号强度和稳定性有所提高,且没有观察到造成背景的增强。显色阶段洗涤缓冲液Tween-20在3个添加浓度下,总体差异不大,增加洗涤液中Tween20的浓度并未明显改善背景。相比更高浓度,添加0.2%体积Tween20的洗涤液所得到的结果相比更加清晰稳定。
2.3.3 显色时间 确定了显色液浸泡8 h的显色时间,8 h内避光反应显色点与背景的色差不断增强,提前观察有破坏避光环境的风险,8 h显色后停止反应并洗涤后杂交膜的背景仍保持接近白色,而继续反应会连同背景一同加深,肉眼观察色差并无明显变化。因此,本研究的菌落原位杂交选择采用37 ℃预杂交30 min后杂交8 h,封闭1 h,抗体结合1 h,2%(体积分数)Tween-20洗脱液洗脱后显色8 h的杂交过程。
3 讨 论
对于生物素标记探针的原位杂交方法,国内外学者已经进行了多方面的研究,刘超兰等[14]设计并优化了一套可用于酿酒微生物菌种筛选的菌落原位杂交方法,吕欣等[15]利用DGGE-菌落原位杂交方法针对性地分离土壤中地精喹禾灵降解菌,杨颖等[16]建立了大肠杆菌Nissle 1917的原位杂交鉴定方法。Saidi等[17]通过PCR结合菌落原位杂交的方法协助确认了霍乱弧菌菌株的基因型。
目前原位杂交技术多种多样,但在对环境中的微生物进行检测时,菌落原位杂交仍然是最常用的方法之一[18]。而针对食源性致病菌尤其是副溶血性弧菌的研究报道仍然较少,一些学者提出了原位杂交在弧菌检测方面的应用,Givens等[19]通过菌落原位杂交与qPCR共同定量检测了春冬季节鱼、牡蛎、水体和沉积物中副溶血性弧菌和创伤弧菌。而本研究认为该技术在种内致病株检测方面也有独特的优势,同时也有助于菌株的分离和筛选。
在原位杂交实验中,要保证低背景、着色清晰、稳定性好的实验结果,不仅需要严格操作选择合理的预处理方法,同时也受到杂交温度、杂交时间、显色检测方法的影响。本研究针对致病性副溶血性弧菌的原位杂交进行了改良和优化,得到了副溶血性弧菌较好的预处理条件和杂交条件,副溶血性弧菌的培养:TSA培养基涂布平板于37 ℃培养14 h后影印;预处理条件:NaOH碱法裂解,80 ℃热固定2 h;杂交条件:杂交温度37 ℃,杂交时间8 h,封闭时间1 h,抗体结合1 h,洗脱缓冲液中Tween-20浓度0.2%(体积分数),显色液中浸泡8 h后终止显色反应。
