NLRP3炎症小体在高脂诱导大鼠冠状动脉硬化性心脏病形成中的表达水平及意义
2018-08-18王全河翟关群
王全河,翟关群
随着人们生活水平的提高,高脂饮食的危害性日益明显,冠状动脉硬化性心脏病(冠心病,CAD)发病率也逐年增加[1],且呈年轻化趋势[2],对患者、家庭及社会造成了严重负担[3]。深入研究冠心病的形成机制,对于有效预防其形成、降低发病率,具有重要意义。目前高血脂刺激活性氧(ROS)生成增多被认为是CAD发生和发展的重要原因[4]。过多的ROS刺激多种炎症因子表达升高,如核因子kB(NF-kB)、硫氧还蛋白相互作用蛋白(TXNIP)等,促使动脉粥样硬化形成。研究表明,NLRP3炎症小体与动脉粥样硬化关系密切[5],研究发现,NLRP3可在CAD形成中出现异常表达,推测NLRP3炎症小体参与了CAD的发生及发展,现将结果报道如下:
1 材料与方法
1.1 实验材料实验大鼠购自重庆医科大学动物研究所,所有的动物护理和程序符合美国国立卫生研究院的指导方针,且符合相关伦理学规定。血脂指标测定采用通过瑞文医疗生化分析仪(型号XR420A),NLRP3抗体购自博尔西(Bersee),BCA蛋白试剂盒品牌:Solarbio (货号:PC0020),RIPA裂解液购自Bosterbio(货号:AR0105),bio-Rad Mini V垂直电泳仪和Trans Blot仪(GE公司),PCR仪品牌Thermo Fisher,Trizol试剂,RNA反转录试剂盒购自Abcam公司。
1.2 实验方法
1.2.1 CAD动物模型制备雄性SD大鼠(210~220 g,6周)共160只,饲养于无菌环境中,并予以正常饮食及饮水,直至可自由采食1周。将实验动物称重后并编号处理,采用随机数字表法分为4组:对照组(Control组40只)、高脂饮食(A组40只)、高脂饮食+空载体慢病毒组(B组40只)、高脂饮食+NLRP3-miRNA慢病毒组(C组40只)。除Control组单纯喂养基础饲料外,其余三组均为基础饲料+高脂饮食(高脂饮食为3%胆固醇,0.5%胆酸钠,0.2%丙基硫氧嘧啶,5%白糖,10%猪油)。同时除对照组外其余实验大鼠每日清晨8:00给予维生素D3(Vitamin D3)300 000 IU/kg肌肉注射并予尼古丁(Nicotine)25 mg/kg溶于2 ml花生油中灌胃,晚6:00予尼古丁25 mg/kg溶于花生油中再次灌胃,Control组予生理盐水肌注和花生油灌胃处理。通过RNAi干扰技术构建沉默率最高的质粒,最终构建pLenti6.3-EmGFP-NLRP3-miRNA慢病毒载体,实验第8周B组实验大鼠腹腔注射慢病毒空载体,C组腹腔注射pLenti6.3-EmGFP-NLRP3-miRNA慢病毒载体,其余组分别注射等量生理盐水,共干预8周,所有实验动物均饲养16周。
1.2.2 NLRP3炎性小体及蛋白白介素-1β(IL-1β检测)分别于正常饲养第1 d、高脂饮食第4周、第8周、第12周及第16周各组分别断颈法处死大鼠5只,通过RT-qPCR及Western Blot检测大鼠心肌组织中NLRP3炎性小体其作用蛋白IL-1β表达水平进行检测。
1.2.3 血清学检测分别于正常饲养第1 d、高脂饮食第4周、第8周、第12周、第16周抽取大鼠股动脉血,经肝素抗凝及高速离心(2000 r/min)处理后,分离血浆,注入已加好的10% EDTANa2(1.5 mg/ml) 30 μl(乙二胺四乙酸二钠)及Aprotinin(500 kiu/ml)20 μl(胰蛋白酶抑制液溶液)的EP管中,-80℃冻存备用,同时测定总胆固醇(TC)及三酰甘油(TG)。
1.2.4 心肌组织及冠状动脉病理切片各组16周时处死大鼠5只并获取冠状动脉5 mm及心脏横断面组织,组织离体后用10%的formalin固定,HE染色后观察冠状动脉壁斑块沉积和心肌细胞脂质沉积情况评价造模情况。
1.2.5 心功能评价实验动物分别于正常饲养第1 d、高脂饮食第4周、第8周、第12周、第16周通过心脏彩超测量,包括左室舒张末期内径(LVIDd),左室收缩末期内径(LVIDs),左室舒张末期室间隔厚度(IVSd),左室射血分数(LVEF),左心室舒张期容积(LVEDV)等。
1.3 统计学处理采用SPSS 19.0软件进行数据处理及分析。计量资料以(±s)表示,组间比较采用独立样本t检验;计数资料以%表示,组间比较采用χ2检验,当理论频数<5时,采取Fishe精确概率法检验,P<0.05为差异具有显著性。
2 结果
2.1 NLRP3炎症小体及蛋白IL-1β的表达通过RT-qPCR及Western Blot检测心肌组织中NLRP3炎性小体表达情况,发现在高脂饮食组大鼠的心肌组织中NLRP3蛋白表达水平及mRNA水平均明显高于对照组(P<0.01)(图1),IL-1β表达水平及mRNA水平亦明显高于对照组(P<0.01)(图2);通过RNAi干扰技术对NLRP3蛋白表达进行沉默干预8周,结果发现该组大鼠(C组)心肌组织中NLRP3蛋白、IL-1β蛋白表达水平及mRNA水平较未干预高脂饮食组(A组及B组)大鼠表达水平下降(P<0.05)。

图1 心肌组织中NLRP3炎性小体蛋白表达水平及mRNA表达水平测定
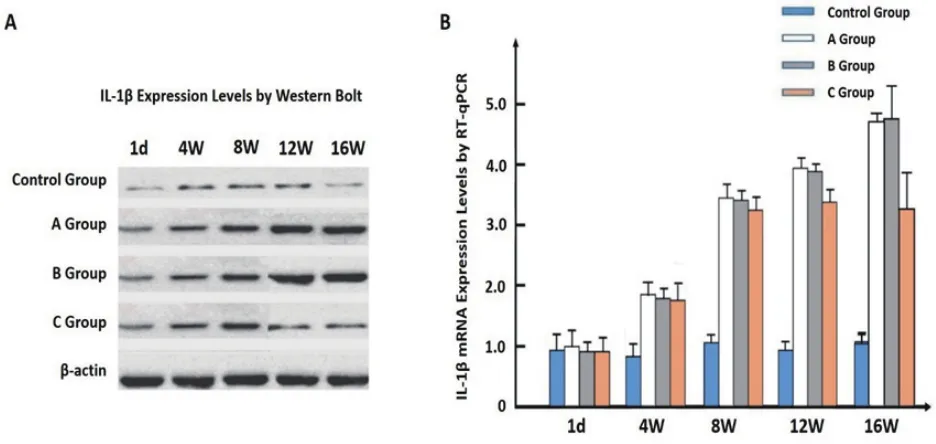
图2 心肌组织中IL-1β蛋白表达水平及mRNA表达水平测定
2.2 各组大鼠的血脂变化根据实验设计在不同时间点位,对4组实验大鼠血液中的TC及TG进行检测后发现,分别三组高脂饮食大鼠(A组、B组及C组)与对照组大鼠相比血浆中的TC和TG水平均显著升高(P<0.05);而进行慢病毒干预处理后C组大鼠在干预后8周,TC及TG水平较A组下降(表1)。
2.3 大鼠心肌改变情况16周时处死大鼠,通过组织切片检测发现,对照组正常饮食的大鼠冠状动脉仅出现少量粥样硬化斑块,而在另外三组高脂饮食大鼠中均出现了明显的粥样硬化斑块(图3A);高脂饮食实验的大鼠心肌细胞切片观察后发现,其心肌细胞明显肿胀并伴纤维组织增生(图3B),符合冠心病的心肌病理改变。同时经RNAi干扰技术沉默处理的大鼠(C组)其冠状动脉粥样硬化斑块程度低于A组;通过对大鼠左心室重量称重并比较左心室重量/体重比值,结果发现3组高脂饮食组大鼠左心室重量/体重比值较对照组均明显增加(P<0.01);RNAi干扰技术沉默组大鼠(C组)左心室重量/体重比值较高脂饮食组(A组)降低(P<0.05) (图3C)。
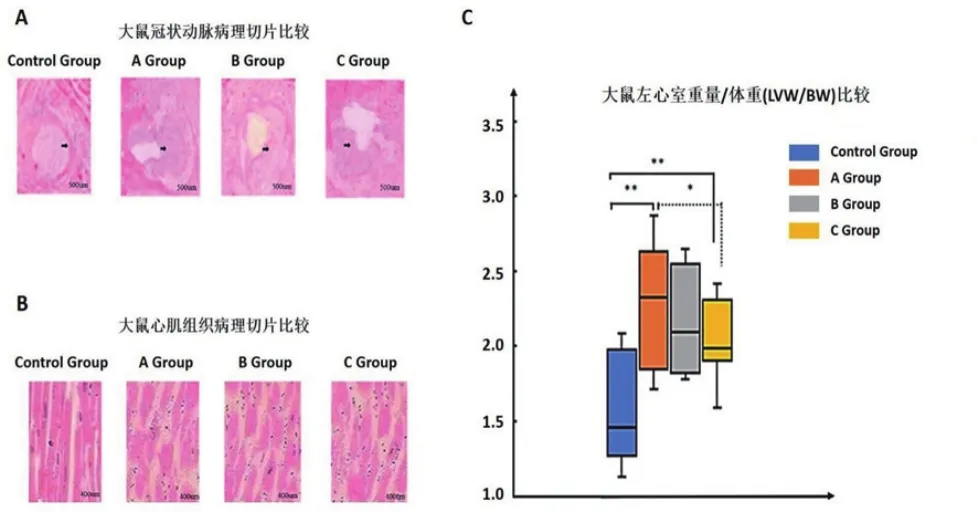
图3 各组大鼠冠脉心肌组织病理切片及左心室/体重比值检测结果
2.4 大鼠心脏结构及功能评价通过对各组实验大鼠不同时间点位的心脏彩超发现:实验组4周后逐渐出现心脏结构改变,16周时,与正常饮食的大鼠相比,高脂饮食大鼠心脏腔室明显增大,且心脏功能随高脂饮食的时间延长而出现功能下降(P<0.05),经RNAi干扰技术沉默处理的大鼠中心脏增大的情况较高脂饮食组(A组)降低,而心脏功能有所恢复(P<0.05)。
3 讨论
表1 各组实验大鼠的TC与TG水平检测(mmol/L,±s)

表1 各组实验大鼠的TC与TG水平检测(mmol/L,±s)
注:TC:总胆固醇;TG:三酰甘油
组别 control组(n=20) A组(n=20) B组(n=20) C组(n=20)TC TG TC TG TC TG TC TG 1 d 1.50±0.12 0.42±0.16 1.48±0.13 0.31±0.12 1.51±0.15 0.41±0.11 1.47±0.16 0.38±0.14 4 W 1.51±0.13 0.40±0.13 5.35±1.15 0.95±0.14 4.98±1.06 1.01±0.22 5.11±1.06 0.98±0.23 8 W 1.57±0.15 0.44±0.15 13.51±3.21 1.59±0.85 14.78±2.79 1.57±0.55 13.96±2.05 1.39±0.32 12 W 1.52±0.14 0.43±0.12 17.52±2.58 2.25±0.98 18.32±2.37 2.39±1.02 16.30±1.68 1.67±0.85 16 W 1.61±0.18 0.45±0.17 21.75±2.21 3.20±1.05 20.38±1.95 3.37±1.12 18.52±1.63 2.78±1.01
表2 各组大鼠在不同时段心脏超声检测结果(±s)

表2 各组大鼠在不同时段心脏超声检测结果(±s)
注:LVIDd:左室舒张末期内径;LVIDs:左室收缩末期内径;IVSd:左室舒张末期室间隔厚度;LVEF:左室射血分数;LVEDV:左室舒张期容积
组别 指标 1 d 4周 8周 12周 16周control组 LVIDd(mm) 6.12±0.68 5.78±0.53 6.58±0.85 6.38±0.71 6.75±1.01 LVIDs(mm) 3.21±0.47 3.07±0.36 3.47±0.62 3.52±0.53 3.76±0.71 IVSd(mm) 1.92±0.22 1.85±0.15 2.03±0.37 1.97±0.31 2.32±0.54 LVEF 80.32±8.65 76.68±6.02 83.16±10.08 82.34±9.24 86.59±11.26 LVEDV(mL) 210.89±43.62 206.37±40.43 215.69±49.31 212.32±45.62 220.61±51.75 A组 LVIDd(mm) 6.45±0.82 5.83±0.92 6.21±0.98 7.12±0.71 9.02±0.75 LVIDs(mm) 3.47±0.61 2.75±0.78 1.89±1.34 3.21±0.23 6.31±0.61 IVSd(mm) 1.89±0.11 2.35±0.21 3.21±0.41 2.58±0.15 2.01±0.30 LVEF 79.56±7.86 86.32±6.29 90.85±8.81 80.01±3.21 60.36±2.58 LVEDV(mL) 215.62±45.38 201.21±50.61 160.43±53.21 250.39±60.31 380.56±110.78 B组 LVIDd(mm) 5.95±0.53 6.12±0.98 6.09±0.72 7.42±0.92 8.52±0.51 LVIDs(mm) 3.27±0.51 2.85±0.85 2.01±1.56 3.58±0.46 5.97±0.41 IVSd(mm) 1.81±0.09 2.41±0.32 3.48±0.57 2.46±0.12 1.98±0.18 LVEF 76.25±6.21 87.33±7.21 92.35±9.91 75.32±2.58 63.52±5.37 LVEDV(mL) 209.35±42.22 216.31±56.84 170.85±60.21 240.71±50.32 371.41±90.71 C组 LVIDd(mm) 6.01±0.73 6.14±0.78 6.72±0.84 6.79±0.62 7.01±0.81 LVIDs(mm) 3.51±0.76 3.45±0.97 2.78±1.76 3.21±0.78 4.05±0.81 IVSd(mm) 1.92±0.18 2.51±0.41 3.46±0.53 3.04±0.72 2.71±0.69 LVEF 80.32±8.94 85.28±5.68 94.72±8.91 79.47±7.92 75.21±5.22 LVEDV(mL) 219.85±51.21 220.21±60.21 180±51.23 210.97±53.21 266.78±59.84
CAD已成为导致人类死亡病因中的首位疾病。目前已证实该疾病与脂质代谢异常关系密切[6],最终造成心脏形态及功能改变及不良事件发生。近年发现非特异性炎症与血脂异常关系密切[7],深入开展非特异性炎症导致血脂异常进而促进CAD的研究,对于有效防控CAD有着重要意义。
NLRP3炎性小体是天然免疫系统的重要组成部分,参与机体免疫反应和疾病发生[8],已有研究证实NLRP3炎症小体在许多疾病中扮演重要角色,如家族性周期性自身炎症反应、2型糖尿病、慢性肝病、慢性肺部疾病等[9,10],但遗憾的是NLRP3炎性小体与冠心病相关报道少见,具体机制亦不明确,尚需进一步研究。
我们通过高脂饮食诱导制备大鼠冠心病动物模型并对NLRP3炎性小体表达水平及其对心脏结构和功能的影响进行检测,结果发现与正常饮食的大鼠相比,高脂饮食大鼠血脂水平显著升高(P<0.05);且冠状动脉均不同程度的出现粥样硬化斑块。同时通过实验发现,NLRP3炎性小体蛋白表达水平及mRNA水平在高脂饮食组明显升高,其作用蛋白IL-1β表达水平及mRNA水平也出现了明显增高;结合心脏彩超对大鼠心脏结构和功能进行评价,我们高脂饮食大鼠心脏形态明显增大且心脏功能明显下降(P<0.05),为验证是否NLRP3炎性小体表达水平与心脏结构和功能以及冠状动脉粥样硬化程度相关,我们通过RNAi干扰技术沉默技术对高脂饮食大鼠进行了处理,结果发现NLRP3炎性小体表达水平的下降后,大鼠冠状动脉粥样硬化斑块程度有所减轻且心脏结构和功能有所改善,推测其机制可能为下调NLRP3炎症小体水平从而调控其作用蛋白IL-1β延缓血管内皮损伤,抑制血管内皮的非特异性炎症的发生[11],从而改善心脏功能。
综上所述,冠状动脉硬化型心肌病中NLRP3炎症小体蛋白表达水平及mRNA水平明显升高,与CAD的心脏结构改变、心脏功能及冠状动脉粥样硬化程度相关,下调其表达水平可以改善CAD的心脏改变,改善心脏功能及冠状动脉粥样硬化程度。
