2种溶解态铜对凡纳滨对虾Cu2+-ATPase及Ca2+-Mg2+-ATPase和 Cu-Zn-SOD的影响
2018-08-07彭士明史永富席寅峰施兆鸿
宋 泰,彭士明,史永富,席寅峰,黄 艇,施兆鸿
(1.中国水产科学研究院东海水产研究所,农业部东海与远洋渔业资源开发利用重点实验室,上海 200090;2.上海海洋大学水产与生命学院,上海 201306;3.国际铜业协会,上海 200000)
铜(Cu)是甲壳类赖以生存的金属元素之一。甲壳类体内用于携氧的主要蛋白是以铜为中心原子的血蓝蛋白(CP)[1-2],可见铜元素直接关系到甲壳类的代谢功能。铜属于重金属元素,单质铜与Cu2+存在200~800 mV的氧化还原电位差,因此其代谢相关活性物质具有特异性,铜三磷酸腺苷酶(Cu2+-ATPase)作为 Cu2+的通道,其活力大小很大程度上影响着铜的代谢水平。Ca2+、Mg2+和Cu2+有着比较接近的电位差,当铜代谢过盛时,Cu2+能够通过某种机制抑制鳃中的蛋白酶活力,如镶嵌转运亚基的基团或竞争性抑制离子通道,从而导致体内离子组分的失衡[3]。铜锌超氧化物歧化酶(Cu-Zn-SOD)活力水平也受水体中铜水平的影响,Cu-Zn-SOD作为甲壳类清除自由基的主要酶蛋白,其活力的强弱关系到甲壳类健康。凡纳滨对虾(Litopenaeus vannamei)的Cu-Zn-SOD在对抗溶藻弧菌和白斑综合症病毒胁迫中起着重要的作用[4]。因此研究水体中铜对甲壳类体内 Cu2+-ATPase、Ca2+-Mg2+-ATPase和 Cu-Zn-SOD的活性大小的影响,对了解铜代谢的水平有着理论意义。
甲壳类对重金属的吸收主要有两种途径:一是通过摄食把水体中或饵料中的重金属经消化道进入体内,最终在肝胰脏中富集,另一种途径是经过鳃不断吸收溶解在水中的重金属离子,经体液循环最终积累在细胞中[5]。因此,研究不同溶解态的铜对甲壳类的作用有着积极的生物学意义。铜合金在海水中可以通过电离、氧化还原反应来释放微量铜离子(包含Cu+和Cu2+),而海水会通过络合反应使水体离子铜络合,总铜保持在一个相对稳定的范围内[6]。铜合金板和Cu2+均能起到使细菌失活的作用,有报道认为,过量的Cu2+可破坏细菌内蛋白[7],铜合金板本身存在的电位差,使其接触的细菌失活[8],可以在不溶于水体的状态下降低养殖水体有害细菌含量。本研究以凡纳滨对虾为实验对象,采用目前在养殖过程中作为抑制原生动物或杀菌的LC6911型铜板为释放络合铜源的材料,并以五水硫酸铜(CuSO4·5H2O)作为Cu2+的原料进行对比,研究不同时长、不同溶解态铜以及不同添加量铜对虾体内不同组织中 Cu2+-ATPase、Ca2+-Mg2+-ATPase和Cu-Zn-SOD的影响。旨在探讨在水体中使用铜合金(LC6911型铜板)作为络合铜源提升凡纳滨对虾代谢功能的可行性,为今后的生产和研究提供参考数据。
1 材料与方法
1.1 实验材料
实验在中国水产科学研究院东海水产研究所福鼎研究中心内进行。凡纳滨对虾购自福建当地养殖场,体长(9.0±0.9)cm,体质量(11.5±2.3)g。实验海水经自然沉淀、砂滤、蛋白质分离器处理后使用,处理后的海水经检测离子铜含量低于1×10-6mg·L-1,总铜含量(3.1×10-5±1.21×10-6)mg·L-1,盐度26±0.8。
实验用饲料为正大牌对虾饲料,为避免饲料中铜干扰实验,参照董晓慧等[9]的方法用EDTA浸泡处理后烘干储存备用。实验用LC6911型铜板由国际铜业协会提供,将厚度0.1 cm的铜板裁成50 cm×60 cm的小块储存备用。硫酸铜为CuSO4·5H2O,分析纯(上海国药集团化学试剂有限公司)。
1.2 实验设计
1.2.1 LC6911铜合金在海水中铜释放量
用直径2 m、深1 m的玻璃钢圆桶9个,每桶放置2 m3沙滤海水,实验分设0.3 m2铜板和0.6 m2铜板平铺桶底,即按水体计算分别为0.15 m2铜板·m-3和0.3 m2铜板·m-3,另设空白对照组。每组实验设3平行,水温28℃,盐度26±0.8,不间断充气,不换水。分别在 0 h、1 h、2 h、4 h、8 h、12 h、24 h、36 h、48 h、60 h、72 h、96 h取各平行水样,用离子计(雷磁 PXSJ—216F型离子计)测定水体Cu2+含量以及水体总铜含量。水体总铜含量测定方法参照李登新[10]:将水样降温至25℃,用盐酸滴定至水体pH 5.2后再用离子计测 Cu2+浓度(注:25℃Ksp[Cu(OH)2]=2.2×10-20)。
1.2.2 养殖实验设计
根据1.2.1的结果,空白对照组测定的Cu2+量值稳定在(3.18×10-5±6.88×10-7)mg·L-1,在2 m3的海水中每0.3 m2铜板48 h内的释放总铜量为(0.245±3.70)×10-4mg·L-1。另参照中华人民共和国农业部颁发的海水水质标准[10]和刘存岐等[11]对中国明对虾 (Penaeus chinensis)养殖实验中海水添加铜浓度梯度,本实验设1个对照组和4个试验组即2个用铜板作为络合铜试验组和2个添加CuSO4·5H2O的Cu2+试验组,分别为:A组(空白对照),B组(0.15 m2铜板·m-3水体),C组(0.3 m2铜板·m-3水体),D组(0.25 mg Cu2+·L-1水体),E组(0.50 mg Cu2+·L-1水体),每组均设3个平行。实验用容器与1.2.1所述相同,每个重复分别放置40尾虾。实验开始前暂养1周。暂养和实验期间环境条件均为水温(28±1.1)℃、盐度26±0.8、不间断充气、每隔48h换水10%,清除残饵粪便,换水前检测各平行水体内总铜含量与离子Cu2+含量。由于Cu2+会缓慢络合,每次换水时向D、E组中补充因换水流失浓度的CuSO4·5H2O,补充流失的Cu2+。投饵时均使用虾料筐,避免饲料接触容器底部的铜板。投料量约为虾体质量的6%。
1.3 采样方法
饲养期间,在 0、2、4、8、16、32、56 d取样,每重复实验取3尾,用1 mL的注射针自对虾胸下动脉抽取血淋巴,再解剖分取鳃、肝胰脏后半部分和肌肉,取得样品置离心管内,-80℃冷冻保存待测。
1.4 虾体铜含量以及酶活力的测定
检测不同组织中的钙镁三磷酸腺苷酶(Ca2+- Mg2+-ATPase)、铜 三 磷 酸 腺 苷 酶 (Cu2+-ATPase)和铜锌超氧化物歧化酶(Cu-Zn-SOD)。通过单位时间内ATP酶分解的无机磷的量来测定ATP酶活力;1 mg组织蛋白在1 mL反应液中SOD抑制率达50%时所对应的SOD量为一个活力单位(U)。实验所涉及酶及蛋白类指标使用南京建成生物科技有限公司的试剂盒进行测定,具体方法参见说明书。实验所测虾体内铜含量方法为原子火焰吸收法,样品前处理采用硝酸-高氯酸湿式消解。
1.5 数据处理
除水体铜含量实验的数据外,其它实验数据处理均进行统计学分析。分析使用Spss Statistics 19软件,使用单因素ANOVA对组间进行差异显著性分析;Ducan法进行方差齐次性检验。P<0.05表示差异具有显著性。
2 结果与分析
2.1 LC6911铜合金在海水中的铜释放量和各组的铜含量
在无养殖生物条件下,24 h内铜板单位水体的总铜释放量和时间呈正比(表1):24~96 h,0.15 m2铜板·m-3和 0.3 m2铜板·m-3释放Cu2+量分别稳定在2.18×10-1~1.75×10-1mg·L-1和3.27×10-1~6.47×10-1mg·L-1。实验期内未放置铜板的空白对照组的Cu2+量值稳定在(3.18×10-5±6.88×10-7)mg·L-1。
养殖实验期间,空白对照A组总铜含量低于1.08×10-6mg·L-1,B、C组 Cu2+含量低于1.42×10-5mg·L-1,B组总铜含量(2.48×10-1±3.34×10-2)mg·L-1,C组总铜含量(4.86×10-1±5.76×10-2)mg·L-1。D组 Cu2+含量区间调控在2.1×10-1~2.5×10-1mg·L-1,E组Cu2+含量区间调控在4.2×10-1~5.0×10-1mg·L-1。实验期间除采样外,各试验组、对照组凡纳滨对虾存活率均为100%,无死亡现象。
2.2 2种溶解态铜对凡纳滨对虾肌肉铜含量影响
凡纳滨对虾肌肉中铜含量在实验周期内变化规律见图1。对照组中肌肉铜含量在实验过程各时间点间变化不显著(P>0.05);2组络合态铜的试验组在2 d起至实验结束始终显著高于对照组(P<0.05);2组Cu2+试验组在实验初期也同样在2 d时就与对照组呈显著性差异(P<0.05),随实验时间的延长,与对照组之间的差异逐渐减小,高Cu2+试验组在32 d后已低于对照组,且在实验结束时(56 d)低于对照组。低Cu2+试验组同样也随实验时间延长而含量下降。
2.3 2种溶解态铜对凡纳滨对虾不同组织中Cu2+-ATPase活力的影响
实验期内,各试验组凡纳滨对虾鳃组织中的Cu2+-ATPase活力均显著高于对照组(P<0.05)。且呈不断上升的趋势,实验结束时0.3 m2铜板·m-3试验组已经高出对照组的8倍,0.15 m2铜板·m-3试验组也高于对照组4.2倍;Cu2+试验组呈现与络合铜试验组相同的变化趋势,高Cu2+试验组和低Cu2+试验组分别高于对照组6.4倍和4.9倍。2种溶解态铜不同浓度之间也呈显著性差异(图2)。结果表明,水体中不论何种溶解态的铜对鳃组织中Cu2+-ATPase活力均具有随时间延长而酶活力增大的趋势。

表1 0.15 m2·M-3和0.30 m2·m-3铜板试验组随时间释放的总铜含量Tab.1 Total Cu release of 0.15 m2·m-3 and 0.30 m2·m-3 copper plate
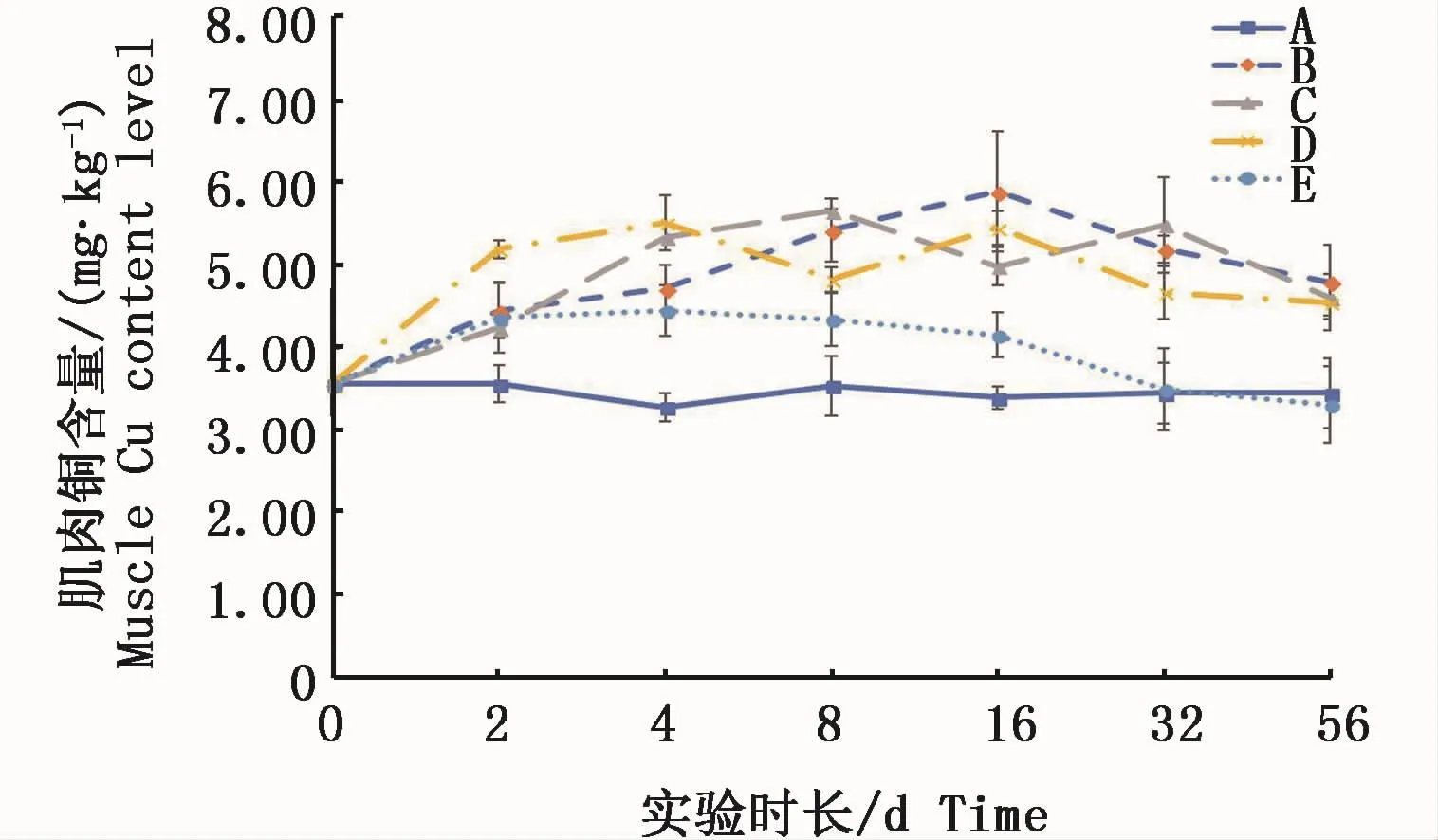
图1 不同处理条件下凡纳滨对虾肌肉铜含量变化Fig.1 Changes of Cu content level in L.vannamei muscle tissue under different treatments注:A:空白对照组;B:0.15 m2铜板·m-3水体;C:0.3 m2铜板·m-3水体;D:0.25 mg Cu2+·L-1水体;E:0.5 mg Cu2+·L-1水体Note:A:Blank group;B:0.15 m2 copper plate·m-3;C:0.3 m2 copper plate·m-3;D:0.25 mg Cu2+·L-1;E:0.5 mg Cu2+·L-1
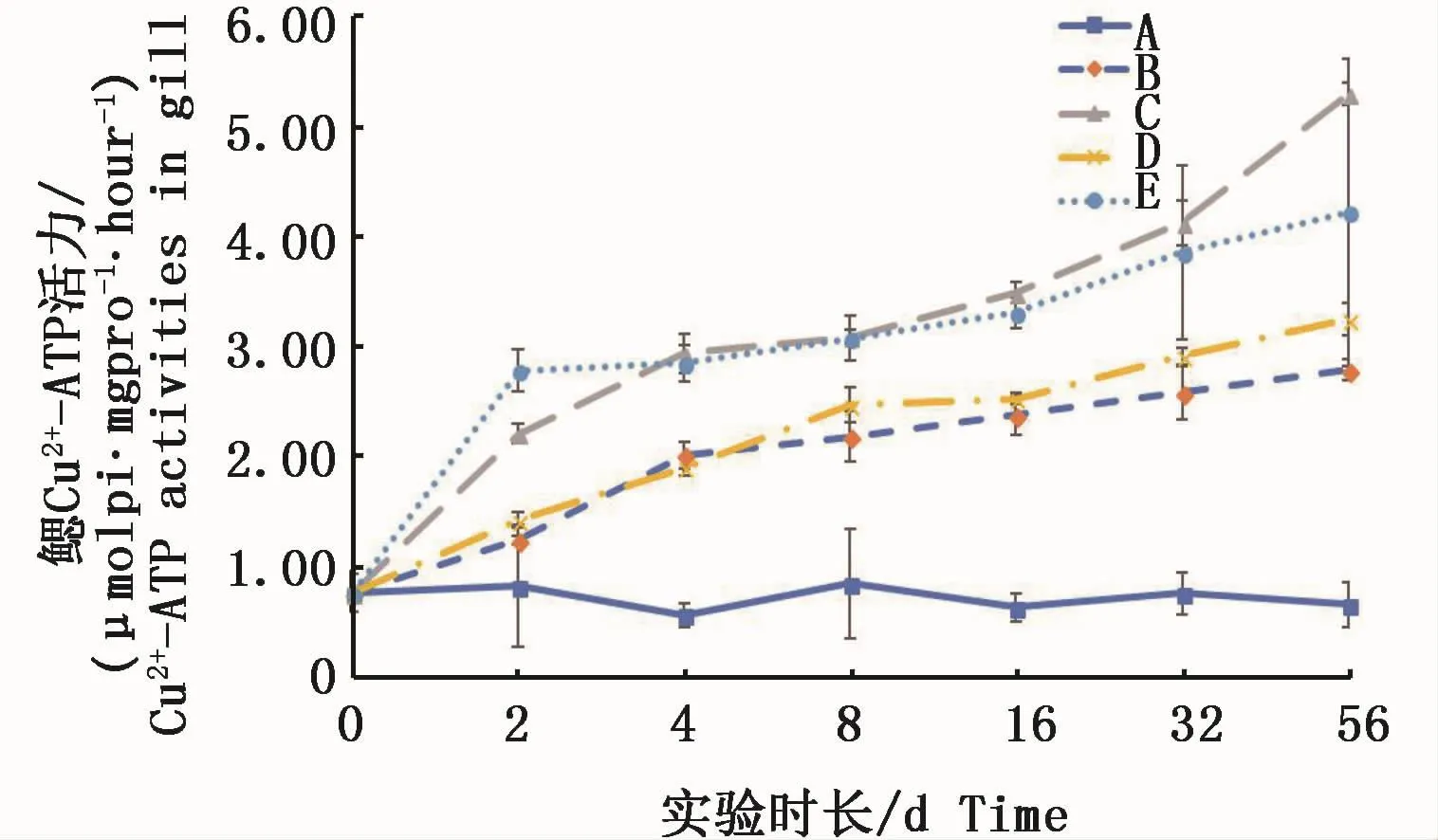
图2 不同处理条件下凡纳滨对虾鳃Cu2+-ATPase活力变化Fig.2 Changes of Cu2+-ATPase activities in L.vannamei gills under different treatments注:A:空白对照组;B:0.15 m2铜板·m-3水体;C:0.3 m2铜板·m-3水体;D:0.25 mg Cu2+·L-1水体;E:0.5 mg Cu2+·L-1水体Note:A:Blank group;B:0.15 m2 copper plate·m-3;C:0.3 m2 copper plate·m-3;D:0.25 mg Cu2+·L-1;E:0.5 mg Cu2+·L-1
各试验组肝胰腺中Cu2+-ATPase活力随实验时间延长而不断增高,且与对照组呈显著性差异(P<0.05)。不同溶解态的铜均是高浓度试验组中的酶活力大于低浓度试验组,Cu2+试验组中低浓度组在4 d起与高浓度试验组呈显著性差异(P<0.05)。结果表明,凡纳滨对虾的肝胰腺中Cu2+-ATPase活力不仅与水体中铜的溶解态相关,还与浓度呈正相关(图3)。
2.4 2种溶解态铜对凡纳滨对虾不同组织中Ca2+-Mg2+-ATPase活力的影响
鳃组织中的 Ca2+-Mg2+-ATPase活力在实验前期(2 d)都呈上升趋势,其中络合铜试验组和低Cu2+试验组均与对照组呈显著性差异(P<0.05)。随后,0.15 m2铜板·m-3试验组和低Cu2+试验组先继续上升后下降,而高浓度Cu2+试验组和0.3 m2铜板·m-3试验组则从2 d起不断下降,各试验组至实验结束时均显著低于对照组(P<0.05)(图4)。结果表明,鳃组织中的 Ca2+-Mg2+-ATPase活力受2种溶解态铜浓度的影响均先升后降,8 d时除高浓度Cu2+试验组显著低于对照组外(P<0.05),其它各组均与对照组无显著性差异(P>0.05),至实验结束时各试验组均显著低于对照组(P<0.05);并且,鳃组织中Ca2+-Mg2+-ATPase活力与 Cu2+-ATPase活力一样,在本实验条件下均表现出铜水平对酶活力的影响大于铜的溶解态对酶活力的影响。
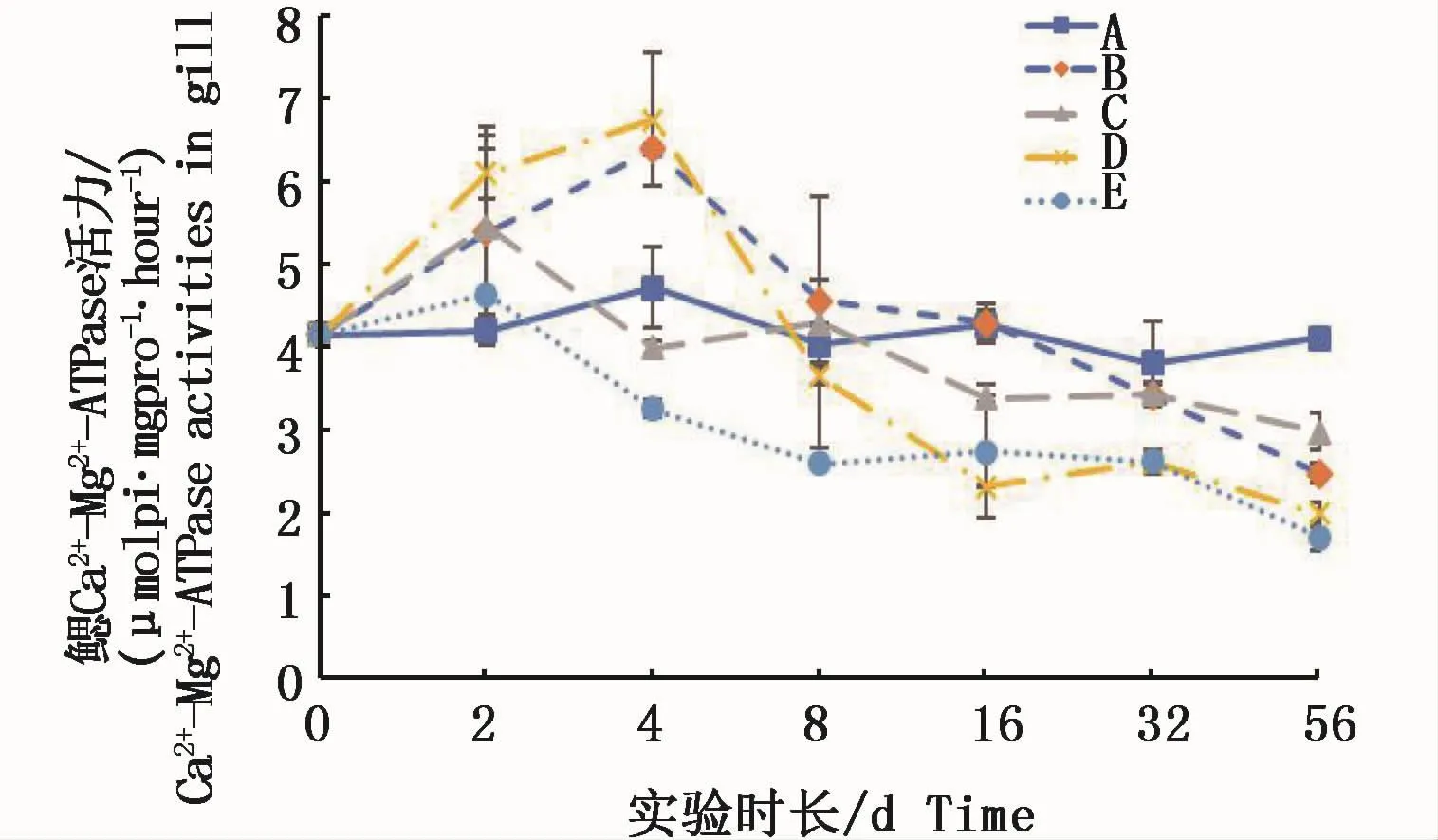
图4 不同处理条件下凡纳滨对虾鳃Ca2+-Mg2+-ATPase活力变化Fig.4 Changes of Ca2+-Mg2+-ATPase activities in L.vannamei gills under different treatments注:A:空白对照组;B:0.15 m2铜板·m-3水体;C:0.3 m2铜板·m-3水体;D:0.25 mg Cu2+·L-1水体;E:0.5 mg Cu2+·L-1水体Note:A:Blank group;B:0.15 m2 copper plate·m-3;C:0.3 m2 copper plate·m-3;D:0.25 mg Cu2+·L-1;E:0.5 mg Cu2+·L-1
肝胰腺中 Ca2+-Mg2+-ATPase活力,不论何种溶解态均呈现出实验前期上升、后期下降的态势。络合铜形态的试验组在实验4 d均显著高于对照组(P<0.05),离子态的试验组在4 d已经降至低于对照组,且高浓度离子态的试验组与对照组呈显著性差异(P<0.05)。实验结束时56 d各试验组均显著低于对照组(P<0.05)。结果表明,水体中不论何种溶解态的铜,短时间会增加肝胰腺中Ca2+-Mg2+-ATPase的活力,而长时间则均对肝胰腺中Ca2+-Mg2+-ATPase活力产生抑制(图5)。
2.5 2种溶解态铜对凡纳滨对虾不同组织中Cu-Zn-SOD活力的影响
凡纳滨对虾鳃组织的中Cu-Zn-SOD活力在2种溶解态铜的水体中实验前期随时间延长而升高,8 d均达到峰值,与对照组有显著性差异(P<0.05)。16 d各试验组均呈现回落态势,但仍与对照组有显著性差异(P<0.05);32 d各试验组又呈现出上升并出现第二次峰值;实验结束时(56 d)高络合态和高离子态试验组均骤降且显著低于对照组(P<0.05),0.15 m2铜板·m-3和低Cu2+试验组也分别下降至接近对照组,但与对照组无显著性差异(P>0.05)(图6)。
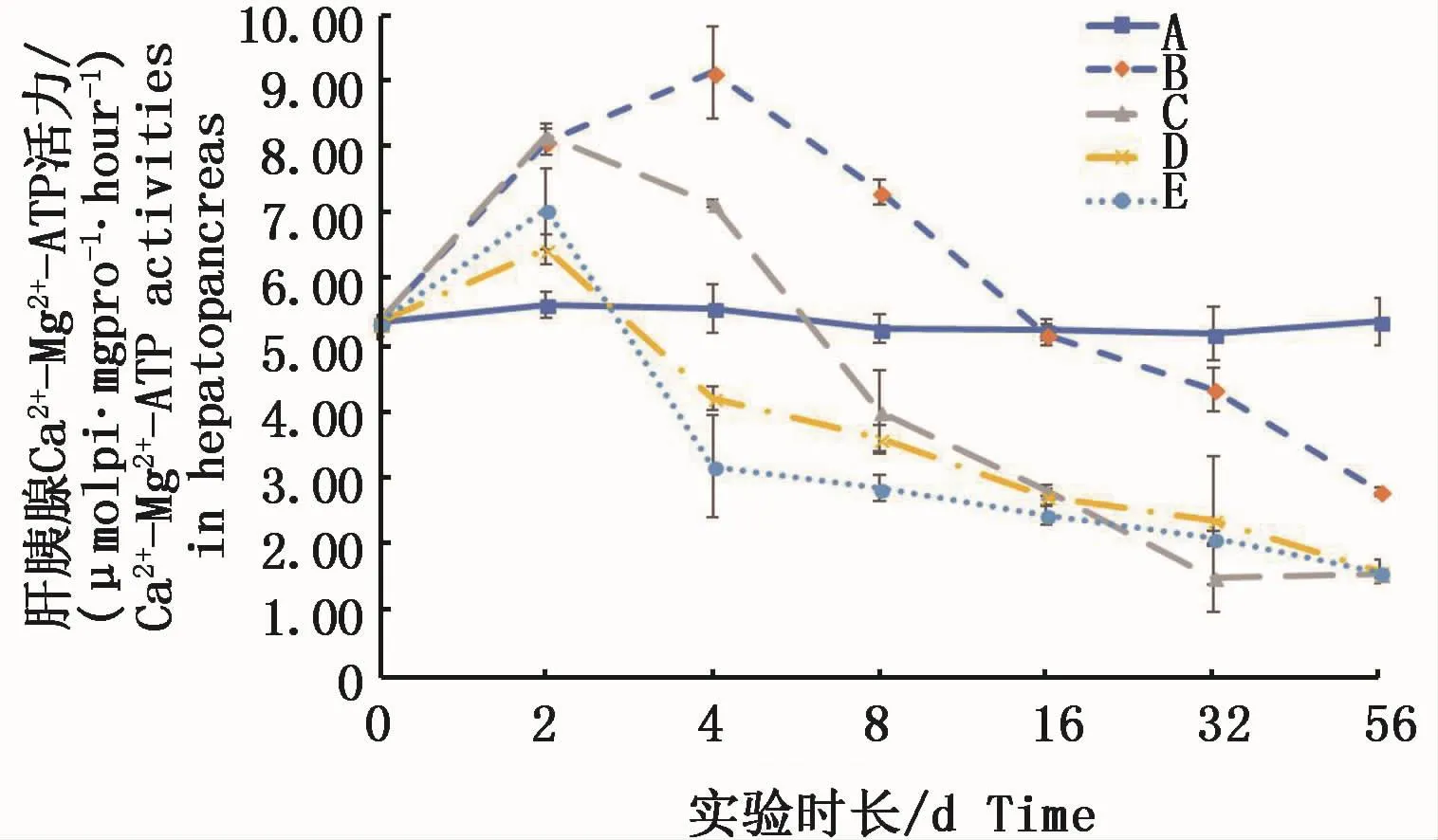
图5 不同处理条件下凡纳滨对虾肝胰腺Ca2+-Mg2+-ATPase活力变化Fig.5 Changes of Ca2+-Mg2+-ATPase activities in L.vannamei hepatopancreas under different treatments注:A:空白对照组;B:0.15 m2铜板·m-3水体;C:0.3 m2铜板·m-3水体;D:0.25 mg Cu2+·L-1水体;E:0.5 mg Cu2+·L-1水体Note:A:Blank group;B:0.15 m2 copper plate·m-3;C:0.3 m2 copper plate·m-3;D:0.25 mg Cu2+·L-1;E:0.5 mg Cu2+·L-1
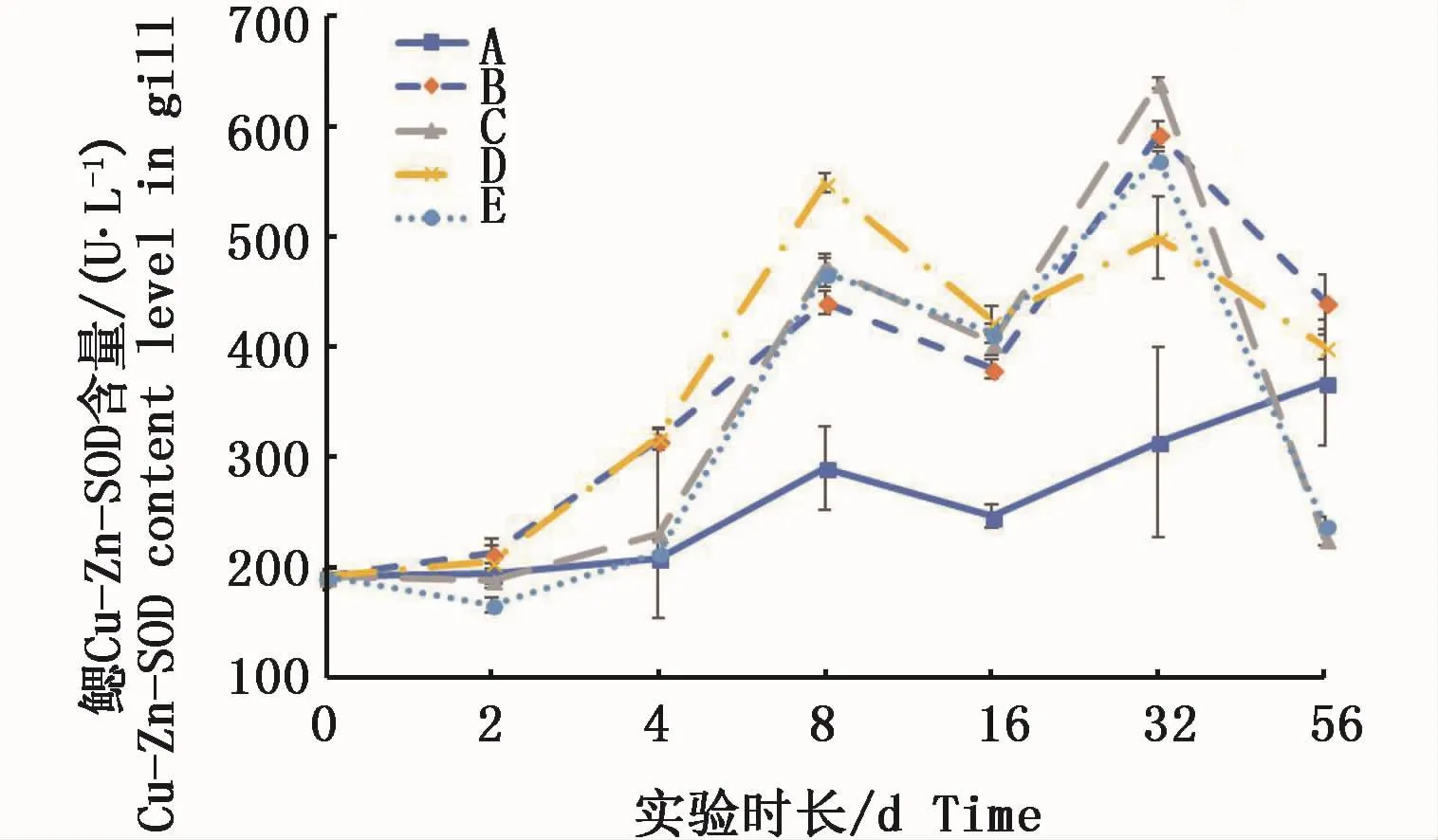
图6 不同处理条件下凡纳滨对虾鳃Cu-Zn-SOD活力变化Fig.6 Changes of Cu-Zn-SOD activities in L.vannamei gills under different treatments注:A:空白对照组;B:0.15 m2铜板·m-3水体;C:0.3 m2铜板·m-3水体;D:0.25 mg Cu2+·L-1水体;E:0.5 mg Cu2+·L-1水体Note:A:Blank group;B:0.15 m2 copper plate·m-3;C:0.3 m2 copper plate·m-3;D:0.25 mg Cu2+·L-1;E:0.5 mg Cu2+·L-1
肝胰腺组织中的Cu-Zn-SOD活力在16 d前变化基本平稳,除2 d时络合态试验组均呈现出与对照组有差异外,其它各取样点各试验组均与对照组差异不显著;32 d时各试验组的Cu-Zn-SOD活力都骤升,达到对照组的2倍以上,56 d又同时回落,但仍与对照组之间有显著性差异(P<0.05)(图7)。
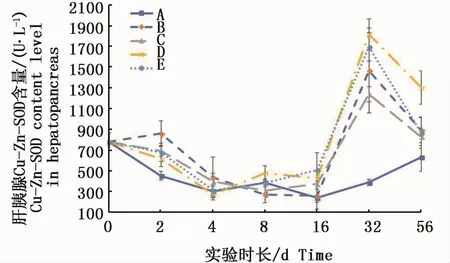
图7 不同处理条件下凡纳滨对虾肝胰腺Cu-Zn-SOD活力变化Fig.7 Changes of Cu-Zn-SOD activities in L.vannamei hepatopancreas under different treatments注:A:空白对照组;B:0.15 m2铜板·m-3水体;C:0.3 m2铜板·m-3水体;D:0.25 mg Cu2+·L-1水体;E:0.5 mg Cu2+·L-1水体Note:A:Blank group;B:0.15 m2 copper plate·m-3;C:0.3 m2 copper plate·m-3;D:0.25 mg Cu2+·L-1;E:0.5 mg Cu2+·L-1
血淋巴中的Cu-Zn-SOD活力基本呈现出低浓度试验组高于对照组、高浓度试验组低于或接近对照组。各试验组与对照组相似,均呈波浪起伏状变化。
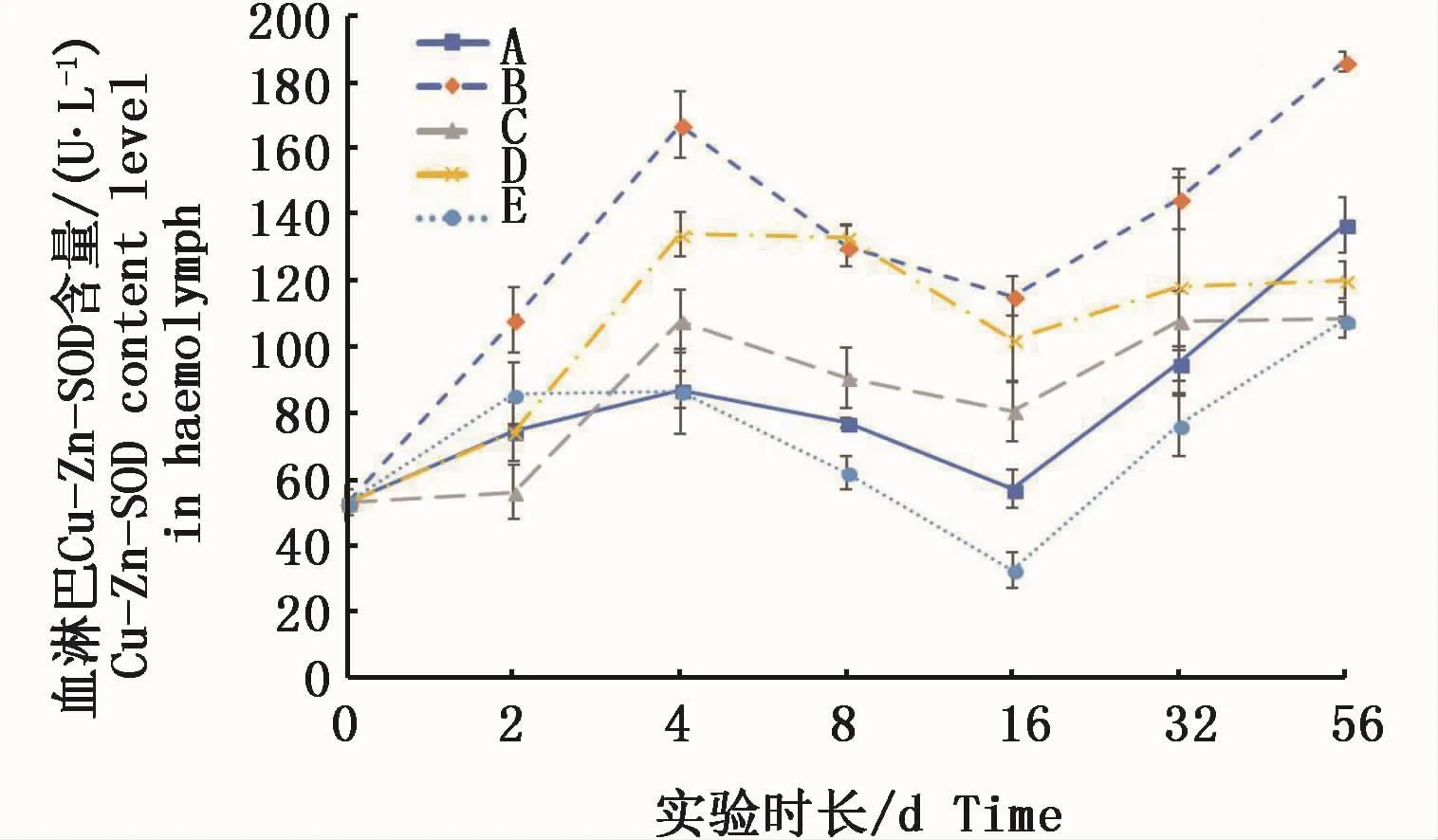
图8 不同处理条件下凡纳滨对虾血淋巴Cu-Zn-SOD活力变化Fig.8 Changes of Cu-Zn-SOD activities in L.vannamei haemolymph under different treatments注:A:空白对照组;B:0.15 m2铜板·m-3水体;C:0.3 m2铜板·m-3水体;D:0.25 mg Cu2+·L-1水体;E:0.5 mg Cu2+·L-1水体Note:A:Blank group;B:0.15 m2 copper plate·m-3;C:0.3 m2 copper plate·m-3;D:0.25 mg Cu2+·L-1;E:0.5 mg Cu2+·L-1
3 讨论
3.1 海水养殖环境铜源控制方法分析
物理腐蚀原理中认为,金属铜表面与海水的摩擦系数为0.1左右,相较于其它材料,此摩擦系数能够很大程度上降低物理磨损和物理腐蚀[12]。此外,电化学腐蚀原理认为,金属铜在海水中可以形成一层Cu-Al-Mg共析氧化物的致密、均匀、与基体结合良好的氧化膜,该氧化膜能在铜的阳极以及阴极电解中起到重要保护作用[13]。本实验数据表明,长期养殖环境中不间断充气的条件下,金属铜释放效率在48 h内与面积呈正比,通过适量的换水可保证水体总铜含量安全可控,可保证水体内铜含量水平准确。另外,铜合金具有较好耐腐蚀性能[14],本研究中56 d实验后取出的铜板并未发现明显的腐蚀痕迹。一定程度上说明LC6911铜合金不会因在海水内存在时间过长或养殖主体存在发生严重化学腐蚀现象。
3.2 水环境中铜水平对凡纳滨对虾肌肉中铜含量的影响
甲壳类在含铜的水体中,鳃是最先富集的组织之一。在自然状况下,鳃中铜含量最高,其次是肝胰腺,而肌肉中的铜含量最低[15]。铜无论是通过摄入的饵料带入、还是通过鳃进入生物体,在代谢过程中,当铜供大于求时就会暂存于肝胰腺中。蓄积于肝胰腺等组织中的铜以Cu2+形式通过血液循环到达肌肉以供代谢需要[16]。从本研究中可以看出(图1),水体中的铜不论是何种溶解形态均会导致凡纳滨对虾肌肉中的铜含量升高,但随实验时间的增加,铜含量则逐渐减少。根据已有资料报道,细胞膜上有离子通道,是否存在除离子通道外的其它形态的通道,则需进一步研究。一般认为铜较难在水产动物体内富集。本实验也证明了对虾肌肉组织中不会随时间或水体中的铜水平升高而大量富集,反而随时间的延长铜含量会减少。本实验条件下,是否鳃组织中铜含量最高以及肝胰腺中的铜含量是否富集,有待进一步的实验证实。
3.3 2种溶解态铜对凡纳滨对虾铜代谢的影响
近几年铜对水产动物的毒性、毒理、生长、代谢及细胞生理、生化作用的研究已有不少报道[17-20]。研究认为,以铜为中心原子的血蓝蛋白对水产经济动物的代谢和免疫至关重要。事实上,有证据表明一价铜在海水中大量是以络合态的形式存在的[6],而一价铜和二价铜之间的氧化还原电位差可能对细胞膜上蛋白酶类有不同的作用。关于铜的离子态、化合态难溶物及络合态的不同作用机理还值得深入研究。
有报道认为,铜缺乏可使机体内一些重要的抗氧化酶如Cu-Zn-SOD、血浆铜蓝蛋白(CP)、谷胱甘肽过氧化物酶(GSH-Px)等的活性下降,导致自由基增加,而自由基也会攻击细胞膜上的蛋白酶类,如ATP酶[22],ATP酶活力减弱使得细胞内Mg2+、K+离子浓度降低,会使细胞内DNA合成受阻,从而影响组织细胞的物质交换和呼吸代谢功能[23]。而铜含量对抗氧化酶和代谢酶都有着直接的影响。
3.4 铜对 Cu2+-ATPase、Ca2+-Mg2+-ATPase和Cu-Zn-SOD的影响
Cu2+-ATPase在负责维持生物细胞和组织铜含量稳定、调节铜在吸收平衡上具有重要意义[24]。生物在 Cu2+胁迫条件下短期内会刺激Cu2+-ATPase活性的增强,并且认为当细胞对铜的需求达到饱和后,铜不会被源源不断地“转入”细胞中,并且 Cu2+-ATPase活力不会立即降低[25]。因此可以认为水体铜的存在对 Cu2+-ATPase会起到激活作用。从本实验的结果看,随铜含量的增加,各组织中的Cu2+-ATPase呈不断上升的态势,符合上述的观点。水体中的Cu2+能够通过某种机制抑制代谢酶活力,如镶嵌转运亚基的基团或竞争性抑制离子通道,从而导致体内离子组分的失衡[26]。当 Ca2+在细胞内聚积,可与各种酶蛋白结合,使其ATP生成量骤降,影响整个细胞的能量代谢[6]。本实验中 Ca2+-Mg2+-ATPase呈先升后降变化可能与水体中的铜含量积聚的浓度有关。
Cu-Zn-SOD在不同组织器官中活力有显著差异,一般认为SOD活力从高到低是遵循肝胰腺、鳃、肌肉这样的规律[24]。本实验中也得出同样的结果,在实验的任何阶段都是肝胰腺中Cu-Zn-SOD活力显著高于血淋巴和鳃部组织。随着实验组铜含量增加,各组织中的Cu-Zn-SOD活力有所提高,但并不呈正比。本实验中2种ATP酶的活力均不与Cu-Zn-SOD活力变化相对应。这是否说明了水体中铜含量的增加促进了 Cu2+-ATPase酶的活力,使得铜进入机体内,当机体内铜达到一定量时改变了代谢能源的水平而影响到抗氧化酶的活力,反映在Cu-Zn-SOD活力呈波浪起伏变化?需要进一步研究证实。
