APE1在非小细胞肺癌脑转移中表达特点及其与预后的关系*
2018-07-26李梦侠杨镇洲陆军军医大学大坪医院野战外科研究所肿瘤中心重庆400042重庆医科大学附属第二医院肿瘤科重庆40000
夏 蕾,肖 何,李梦侠,杨镇洲,王 东△(.陆军军医大学大坪医院野战外科研究所肿瘤中心,重庆400042;2.重庆医科大学附属第二医院肿瘤科,重庆40000)
肺癌脑转移的发生率为23%~65%,约占恶性肿瘤脑转移的50%,是最常见的脑转移瘤[1]。随着非小细胞肺癌(NSCLC)诊治水平的提高,NSCLC脑转移的发生率也得到进一步提高,而一旦发生脑转移,其预后极差,生存期大多为2~4个月[2]。化疗药物由于难以透过血脑屏障而对脑转移灶疗效有限,即使积极采取全脑放疗(WBRT)、立体定向放疗(SRS),或者手术切除脑单发转移灶等都不能达到令人满意的局控率和生存率。当前,随着NSCLC综合治疗的日趋完善,如何有效提高NSCLC脑转移患者的生存期及改善其生活质量已成为临床肿瘤学领域的研究热点。
脱嘌呤脱嘧啶核酸内切酶1/氧化还原因子(APE1/Ref-1)是一种重要的低氧诱导细胞凋亡、坏死和氧化应激的保护基因,具有氧化还原和DNA损伤修复双重功能,能通过改善生物体对缺氧和氧化应激的适应性,可以最大限度地减轻细胞损伤[3]。APE1是DNA碱基切除修复(BER)通路中的关键限速酶[4],是细胞基因毒性药物损伤、放射性及其他氧化损伤的重要修复因子。APE1可以通过氧化还原机制调节 AP-1、p53、myb、HIF-1α,NF-κB等转录因子的DNA结合活性,从而参与细胞的增殖与凋亡、细胞的氧化与应激、细胞周期调控等多种关键的细胞反应[5]。作者前期的研究已证实,APE1在NSCLC中呈显著高表达[6-9],但目前关于APE1蛋白在NSCLC脑转移的表达水平、亚细胞定位等特征尚不清楚,也尚未明确与放、化疗敏感性及预后相关性。
本研究选择接受肺原发灶及脑转移灶手术的NSCLC脑转移患者,采用免疫组织化学方法检测肺原发灶及脑转移灶的APE1的表达状况及亚细胞定位改变情况,进一步阐明APE1在NSCLC肺原发病灶及脑转移中的差异性表达与疗效、预后的相关性,为改善NSCLC脑转移患者的生存质量和生存期提供新的依据。
1 资料与方法
1.1 一般资料 收集2010年1月至2015年1月陆军军医大学大坪医院术后病理检查确诊为NSCLC伴脑转移患者共11例。肺原发灶及脑转移灶患者均经过手术治疗。其中男8例,女3例;年龄26~72岁,中位年龄58岁;鳞癌 2例(18.2%),腺癌 9例(81.8%)。
通过病历记录和问卷调查获得研究对象的相关资料,包括以下方面内容:(1)个人基本信息。年龄、性别、身高、体重、吸烟、家族史等。(2)疾病信息。病理类型、临床分期[10-11]、美国东部肿瘤协作组(ECOG)体例状况(PS)评分、手术情况等。(3)首次治疗信息。化疗方案、周期,放疗方案、周期,疗效评价,不良反应等。(4)随访信息:随访时间、末次随访时间、肺部及颅内无病生存期(DFS)、总生存期(OS)等。(5)吸烟史:吸烟小于或等于100支及从不吸烟为从不吸烟;吸烟大于100支且戒烟大于或等于1年为过去吸烟;吸烟100支且戒烟小于或等于1年或目前仍吸烟为现在吸烟。
1.2 方法
1.2.1 肺原发灶与脑转移灶APE1免疫组织化学检测 11例肺原发灶及脑转移灶手术标本均经10%甲醛溶液固定,石蜡包埋,4µm连续切片。鼠抗人APE1单克隆抗体购自NovusBiologicals公司,工作浓度为1∶100;以磷酸盐缓冲液(PBS)替代一抗作为阴性对照。采用二步法4µm连续石蜡切片,二甲苯脱蜡,乙醇梯度水化,3%过氧化氢-甲醇溶液室温10 min,微波抗原修复,滴加一抗,4℃过夜,PowerVi-sionTM复合物 50µL,37℃孵育30 min,DAB-H2O2显色,苏木素复染。以PBS代替一抗作为阴性对照。
1.2.2 APE1免疫组织化学结果判定 APE1免疫组织化学阳性信号为棕黄色细小颗粒,每张切片随机选取5个具有代表性的视野(400×),所有病理切片由2名经验丰富的病理科医师在没有临床病理资料的情况下进行评分。若结果存在差异则被再次评估,直到达成共识。以细胞质或细胞核着色的细胞大于10%为癌细胞胞质或胞核阳性表达。胞质表达或核质共表达统称为胞质异位表达。
1.2.3 化疗及放疗方案 患者接受的含铂两药联合方案如下:(1)TP 方案。紫杉醇(135 mg/m2,第 1天)+顺铂(75 mg/m2,第 1 天);(2)DP 方案。多西他赛(75 mg/m2,第1天)+顺铂(75 mg/m2,第1天)。患者接受的靶向治疗方案如下:盐酸厄洛替尼片150 mg/d,每天1次。替莫唑胺胶囊75 mg/m2放疗同步口服。患者接受的放疗方案如下:全脑两视野对穿照射DT 40 Gy/20f/4w,SRS。
1.2.4 预后及疗效判定 主要观察指标:无病生存期(DFS)和总生存期(OS)。
1.2.4.1 次要观察指标 客观有效率(ORR)、疾病控制率(DCR)。
1.2.4.2 疗效评定标准 术后局部出现病情进展,经常规治疗以CT、磁共振成像(MRI)等影像学手段对靶病灶或转移灶进行检查,按照2009年《1.1版实体瘤评价标准(RECIST)》进行疗效评价[12],包括完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD)。ORR=CR+PR;DCR=CR+PR+SD。
1.2.5 随访 前半年每个月随访1次,半年后每2个月随访1次,直至患者死亡。随访的同时评估患者的生存质量、体重减轻程度等。随访截止时间为2016年6月1日,失访或存活作为截尾数据。
1.3 统计学处理 统计分析前对所有资料和数据作统一的标准化处理。将病例资料录入Excel表中进行整理,并经过反复检查核对,再按统计分析格式生成代码性数据。采用SPSS19.0统计软件进行数据处理。ORR、DCR和不良反应的比较采用Pearsonχ2检验和Fisher's精确概率检验进行分析。生存分析采用Kaplan-Meier法,各因素水平间比较用Log-rank检验。Cox等比例风险模型分析预后相关因素,计算每个因素的死亡相对危险比(HR)及其95%置信区间(95%CI)。检验水准α=0.05,双侧概率检验。P<0.05为差异有统计学意义。
2 结 果
2.1 患者的临床资料及临床结果 本研究11例晚期NSCLC脑转移患者的肺部病灶及脑转移病灶均先后行手术治疗,其中男 8例(72.7%),女 3例(27.3%);年龄26~72岁,中位年龄58岁。病理类型腺癌9例(81.8%),鳞癌 2例(18.2%)。其中首诊分期ⅢA期患者 1例(9.1%),ⅢB期 4例(36.4%),Ⅳ期 6例(54.5%),ECOG评分均小于或等于2分。从不吸烟5例(45.4%),曾经吸烟 3例(27.3%),正在吸烟 3例(27.3%)。4例(36.4%)患者首诊即出现脑转移,其余7例(63.7%)在治疗过程中才出现脑转移。
采用TP方案的患者8例(72.7%),口服厄洛替尼2例(18.2%),口服替莫唑胺 1例(9.1%)。化疗周期 2~8周期,中位化疗周期4周期。采用WBRT2例(18.2%),SRS4例(36.3%),SRS+WBRT1例(9.1%),脑病灶未行任何放射治疗4例(36.3%)。
肺原发病灶化疗疗效评价:CR 3例(27.3%),PR 6例(54.5%),SD 1例(9.1%),PD 1例(9.1%);化疗 ORR 为81.8%。脑转移病灶WBRT及SRS疗效评价:CR 3例(27.3%),PR 4例(36.3%),SD 1例(9.1%),PD 3例(27.3%);局部治疗的ORR为63.6%。
随访终止时间为2016年6月1日,随访时间6~38个月,中位随访时间为17个月,10例(90.91%)患者在此期间死亡。中位 DFSlung为 12个月(95%CI0.000~24.947),中位 DFSbrain为 7 个月(95%CI0.526~13.474),中位 OS为 20个月(95%CI 13.934~26.066)。见表1。
2.2 APE1在肺原发灶与脑转移灶免疫组织化学结果APE1阳性产物呈棕黄色颗粒状,呈细胞核表达,细胞核/浆共表达,或细胞质表达。其中,肺原发病灶中单纯细胞核表达为7例(63.6%)(图lA),细胞核/细胞质联合表达2例(18.2%)(图1B),单纯性细胞质表达为1例(9.1%)(图1C),APE1表达阴性者为1例(9.1%)。而脑转移灶单纯细胞核表达为9例(81.8%)(图2A),细胞核/细胞质联合表达1例(9.1%)(图2B),单纯性细胞质表达为1例(9.1%)(图2C)。
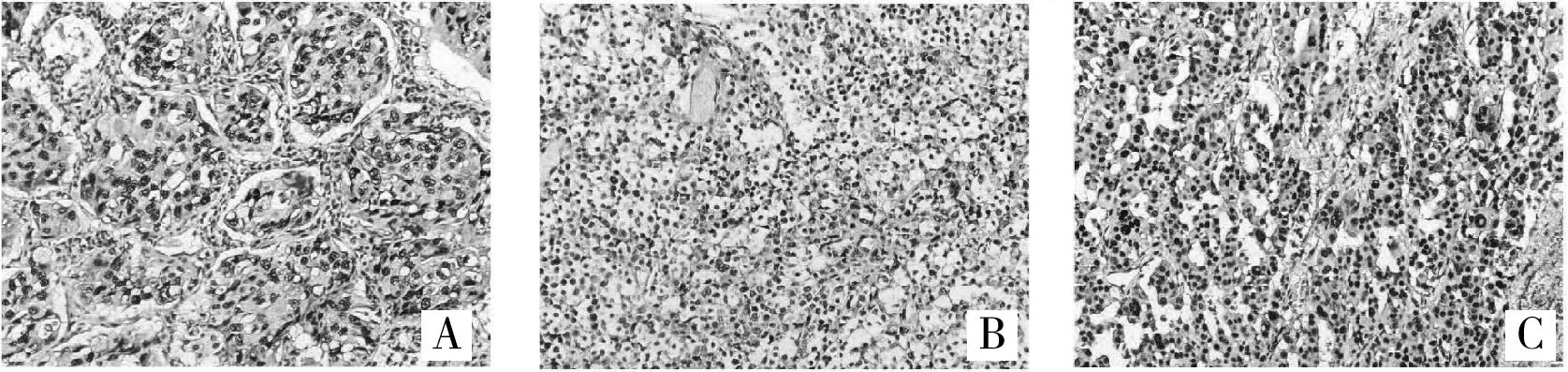
图1 肺原发灶APE1蛋白表达(SP,400×)
肺原发病灶及脑转移病灶APE1的表达强度也存在一定差异。肺原发灶中6例(54.5%)患者表达强度为+++,1例(9.1%)患者表达强度为++,3例(27.3%)患者表达强度为+;脑转移病灶中APE1表达强度为+++有 8例(72.7%),表达强度为++有 1例(9.1%),表达强度为+2例(18.2%),脑转移灶多呈APE1高表达状态。进一步配对分析发现,11例患者中肺原发病灶及脑转移病灶APE1的表达水平一致6例(54.5%),均为高表达;APE1的亚细胞定位一致5例(45.5%),且均为核表达。有2例患者肺原发病灶及脑转移病灶APE1的表达强度及其亚细胞定位均一致。但统计分析结果提示,肺原发灶APE1的表达强度及亚细胞定位与脑转移病灶APE1并无明显相关性(P>0.05)。
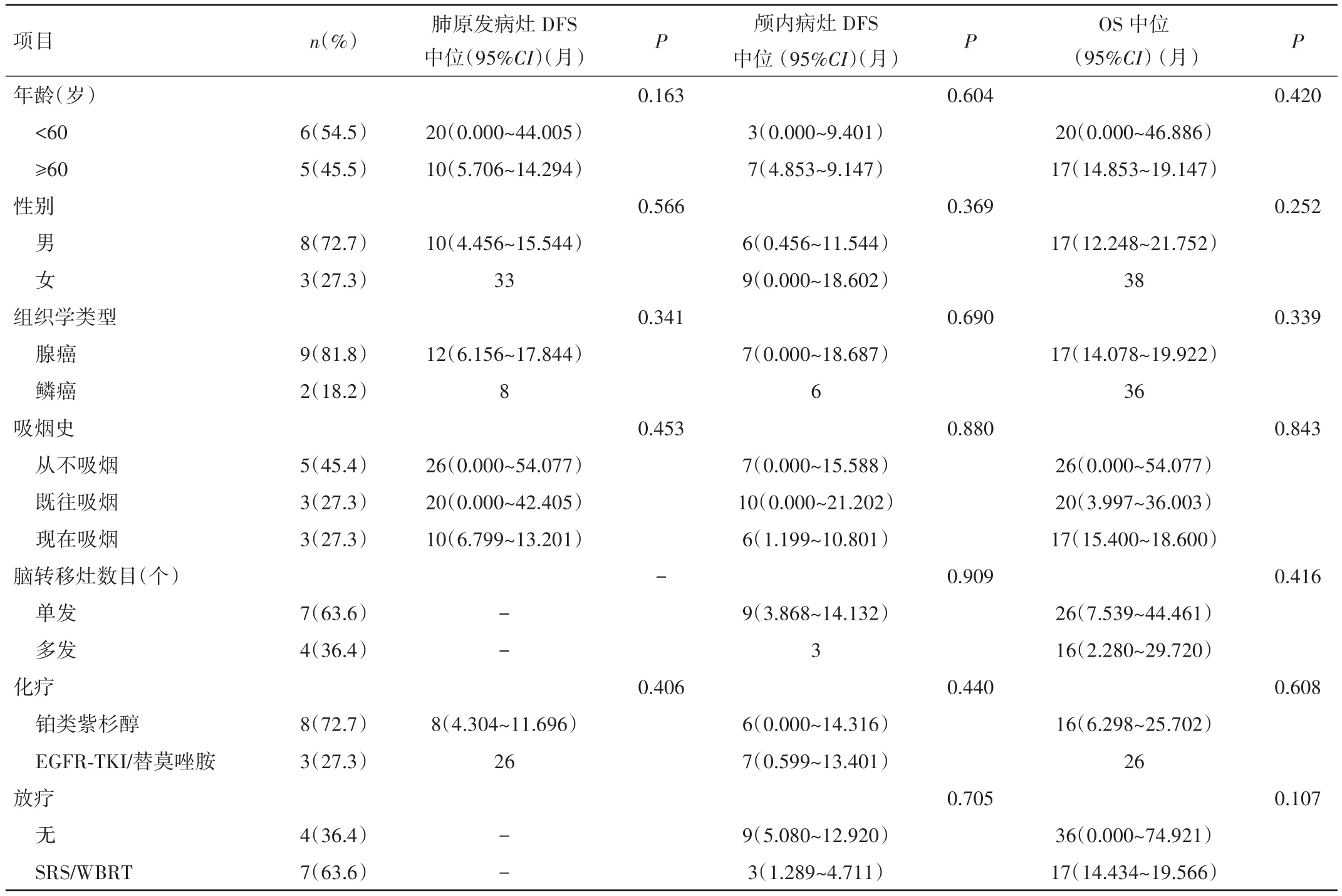
表1 影响DFS和OS的单因素分析
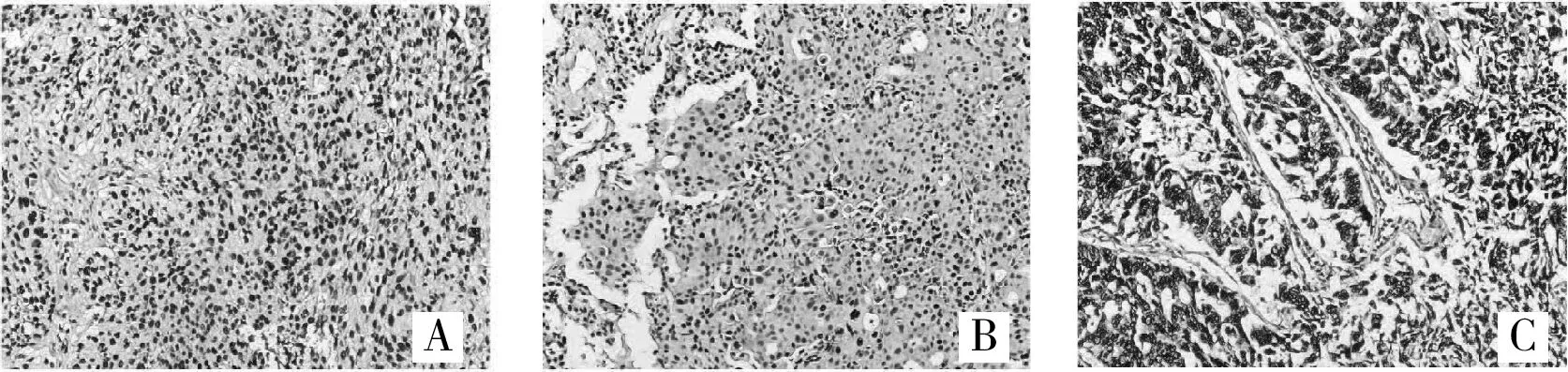
图2 脑转移灶APE1蛋白表达(SP,400×)
2.3 生存分析 11例患者存活1例,死亡10例;生存期为6~38个月,1、2年生存率分别为72.7%、36.4%。<60岁的患者肺部病灶中位DFS为20个月,长于大于60岁患者(20个月vs.10个月,P=0.163),OS也延长3个月(20个月vs.17个月,P=0.420);3例女性患者DFS及OS均较8例男性患者明显延长(肺原发病灶DFS:33个月vs.10个月,P=0.566;脑转移病灶DFS:9个月vs.6个月,P=0.369;OS:38个月vs.17个月,P=0.252)。鳞癌、从未吸烟、单发脑转移的患者局部无病生存率及总生存率均更好。与8例仅接受TP方案化疗的患者相比,3例接受过靶向治疗的患者肺原发病灶DFS明显延长(8个月vs.28个月,P=0.406),OS也有10个月的获益(16个月vs.26个月,P=0.608)。肺原发病灶APE1的表达水平越高,越容易出现脑转移(9个月vs.7个月,P=0.862),细胞质异位表达者较核表达者更早出现脑转移(9个月vs.7个月,P=0.383)。见表1。
2.4 APE1的表达特点与ORR、DCR、DFS和 OS的关系 4例肺原发病灶APE1低表达者DCR达100.0%,而7例高表达者仅为85.7%。肺原发病灶APE1低表达组术后DFS为20个月,而高表达组为10个月(Log-Rank Test,P=0.166)。其中 1例肺原发病灶 APE1阴性患者,在随访期间内,肺部未出现局部的复发或进展,肺部无疾病进展期达到36个月。仅2例患者脑转移灶APE1为低表达,其ORR、DCR均为100.0%,脑转移病灶DFS达10个月,反之,高表达的9例患者中ORR仅为55.5%(5/9),脑转移病灶DFS仅为6个月。
肺原发病灶APE1核表达者的DFS较细胞质异位表达者延长了12个月(20个月vs.8个月,P=0.828),同时,OS也明显优于细胞质异位表达者(20个月vs.16个月,P=0.875)。脑转移病灶APE1的亚细胞定位也呈现出与肺原发灶亚细胞定位一致的趋势:核表达者DFS长于胞质异位表达者(7个月vs.3个月,P=0.666),且OS延长了10个月(20个月vs.10个月,P=0.935)。有5例患者肺原发病灶及脑转移病灶APE1的亚细胞定位一致,均为细胞核表达,其中位OS甚至达到了26个月,而且该组人群T、N分期均较早,仅2例患者为N2、N3。另6例患者肺原发病灶或脑转移病灶APE1均出现了细胞质异位表达,其中位OS仅为16个月(P=0.415),且 N 分期较晚,均为 N2、N3。见表2。
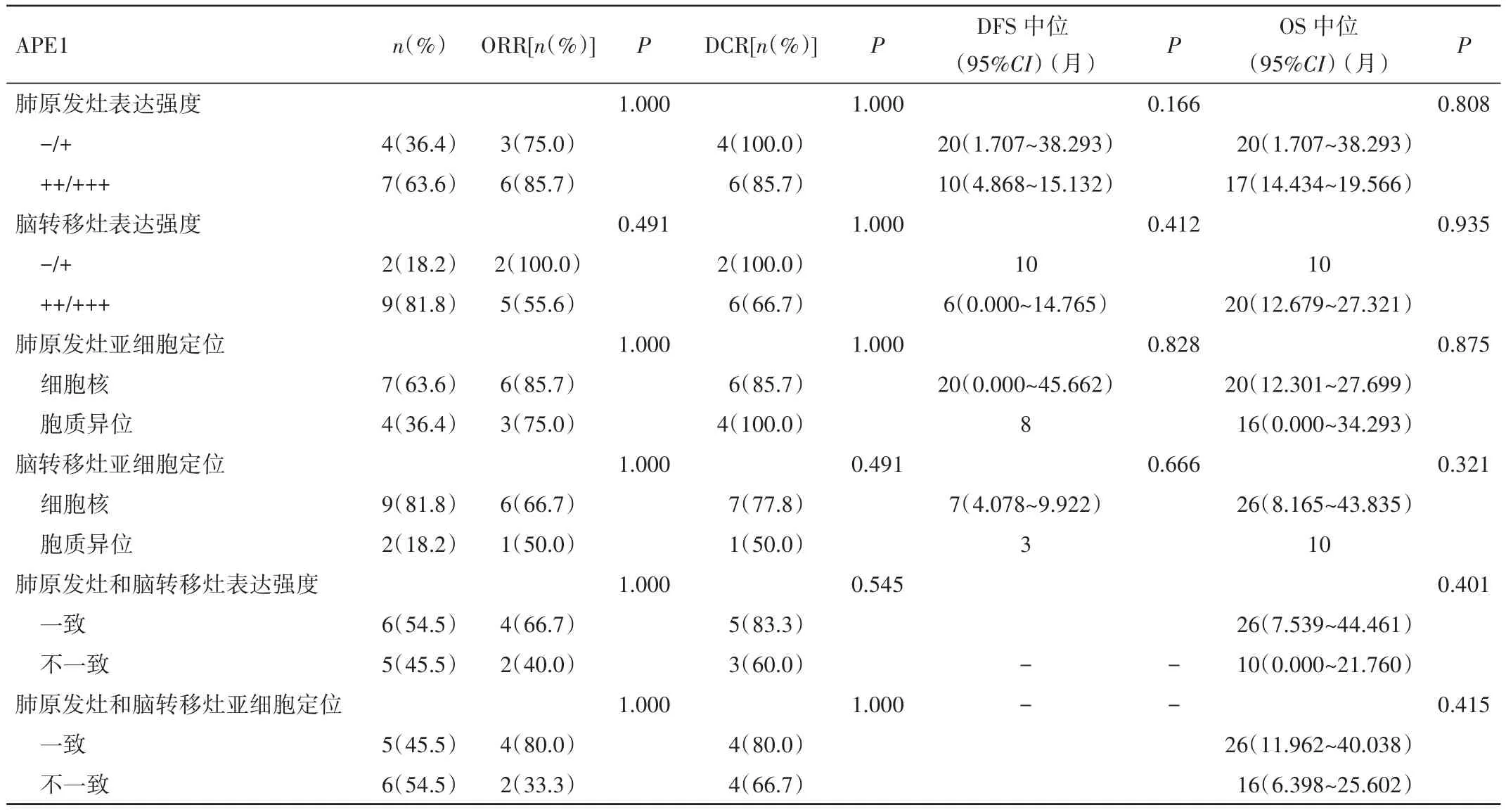
表2 APE1的表达特点与ORR、DCR、DFS和OS的关系
3 讨 论
NSCLC一旦发生脑转移,其预后极差,生存期仅2~4个月[2]。鉴于目前即使积极采取常用的肿瘤治疗手段如化疗、WBRT、SRS甚至手术切除单发脑转移病灶等都不能达到令人满意的DCR和生存率,患者的生存质量和预后仍较差。因此,很多学者致力于探讨有关NSCLC脑转移的新治疗靶点和通路,尝试新的研究策略,以提高治疗效果。
APE1/Ref-1作为DNA碱基切除修复(BER)通路中的关键限速酶[3−4],不但能修复辐射、烷化剂和氧化引起的DNA损伤,而且能通过氧化还原机制调节多种转录因子(如 AP-1、p53、myb、HIF-1α、NF-κB 等)的 DNA结合活性及下游靶基因的表达,从而参与细胞的增殖与凋亡、细胞的氧化与应激、细胞周期调控等多种关键的细胞反应[5]。KAKOLYRIS等[13]在多种肿瘤组织中均发现与相应正常组织不同的APE1细胞分布形式,其中大肠癌较为典型。在正常的大肠黏膜、隐窝底部分化较低的细胞中主要APE1位于核内,但高分化和肠上皮表面细胞则主要在胞质;在腺瘤和癌中核内限制型分布丧失,取而代之的是以胞质分布为主的核-质共分布[13]。PUGLISI等[14]在另一项关于乳腺癌的研究中也发现、APE1细胞核、胞质定位与预后差显著相关,APE胞核、胞质定位不依赖其他预后因素,如组织学分级、淋巴结有无转移和肿瘤大小的独立预后因子。在卵巢癌中细胞质表达通常是恶性的指征,与预后不良关系密切[15]。目前,已有研究证实,APE1亚细胞分布模式与肿瘤的侵袭性和预后有密切关系;核内型总是与较好的预后特征相关,例如较好的分化状态、低度血管生成及淋巴结阴性等[16]。反之,胞质型和核-质型染色状态则与不良的预后因素相关,比如,肿瘤血管生成的同时合并淋巴结和p53阳性[17]。除亚细胞定位发生变化外,在定量研究中发现肿瘤组织中APE1表达水平明显改变。在宫颈癌、NSCLC、横纹肌肉瘤和头颈部鳞癌组织中,都能观察到核内APE1水平明显上升[18-22]。本课题组前期研究分析了60例人骨肉瘤组织,发现其中72%的APE1表达水平较高,推测其高水平APE1可能与骨肉瘤放、化疗抵抗和预后不良相关[23]。并且采用免疫组织化学的方法检测103例手术切除的NSCLC组织中APE1的表达,APE1低表达组无疾病进展期显著长于APE1高表达组。该结果进一步表明,APE1基因表达增强可能是导致NSCLC患者放、化疗效果差,预后不良的重要因素[23]。有研究还发现,在肺癌、乳腺癌、前列腺癌、宫颈癌等多种肿瘤中发现APE1扩增和(或)过表达,并与肿瘤细胞的恶性转化、浸润和转移密切相关[16,18-22]。因此,目前普遍认为,APE1水平和其细胞分布的失调可作为预测肿瘤的侵袭性、肿瘤放射治疗和化学治疗的敏感性及预后的生物学指标[4,24-25]。
本研究为回顾性小样本研究,对11例曾接受肺原发灶及脑转移灶手术的NSCLC脑转移患者进行了较为全面的分析,探讨了肺原发病灶及脑转移病灶APE1的表达强度及其亚细胞定位与治疗的ORR、DCR、DFS及OS的相关性。从DFS和OS的单因素分析可以看出,女性、鳞癌、从未吸烟、单发脑转移的患者对治疗更为敏感,疗效更好,局部控制时间更长,预后较好。与仅接受化疗的患者相比,接受过靶向治疗的患者有效率更高,本研究的这一结果与其他研究报道的:对于EGFR突变的患者,TKI类药物的有效率优于含铂双药方案的大约20%的客观有效率是一致的[26-28];除了该方法具有更好的ORR外,接受过靶向治疗的肺部DFS达到了26个月,比单纯化疗高出18个月,与颅内DFS两者差别不明显,说明化疗药物及TKIs药物均不能有效地透过血脑屏障,对脑转移病灶的作用有限,DFS的获益部分转化为最终的OS的获益(16个月vs.26个月,P=0.608),这与 NEJGSG002、OPTIMAL 等第一代 EGFRTKIs药物重要的随机临床研究结果一致[26-33]。对DFS和OS的多因素分析结果提示,性别、年龄、吸烟状况、组织学类型、T分期、PS评分、肺部病灶APE1的表达强度及亚细胞定位、发生脑部转移的时间等均与DFS、OS无明显相关性,只有N分期和脑部病灶APE1的表达强度可能是脑转病灶DFS的独立预后因素,N分期越晚及脑转移病灶APE1高表达者越容易出现脑转移病灶的进展。但是,因总例数较少,无法得出明确结论,仅能显示一定的趋势。
APE1在11例患者肺原发病灶及脑转移病灶的细胞核和(或)细胞质中均可见表达,脑转移灶基因突变情况与原发灶不一致,脑转移灶中存在更高的APE1表达。ASCO 会议 BARTOLOTTI等[34]、ZHANG 等[35]报道了一项旨在评价NSCLC脑转移患者肺原发病灶EGFR突变率及EGFR-TKI治疗有效率的回顾性研究,提示脑转移NSCLC患者肺原发病灶存在更高的EGFR突变。KLOOSTERMAN等[36]对21例结直肠癌患者的47份肿瘤原发灶及其转移病灶标本的1 264种癌症相关基因进行了测序发现,在转移灶中70种表达于原发病灶的单核苷酸变异(SNV)丢失,而出现了83种在数条关键通路中起作用的新变异,并且在对筛选合适的患者进行靶向治疗时,转移病灶变异较原发病灶更能代表肿瘤基因组的完整状。本研究结果显示,仅有2例患者肺原发病灶及脑转移病灶APE1的表达强度及其亚细胞定位均一致,NSCLC患者脑转移病灶存在更高的APE1表达。综上所述,肿瘤的原发病灶和转移病灶之间的基因变异具有不一致性。因此,不能简单地通过肺原发病灶某个基因的表达特点来预测脑转移病灶中该基因的表达,且作为治疗预测预后的指标。在NSCLC脑转移的演进过程中,是否有关键基因的丢失或产生新的基因变异,目前尚无人可以给出明确的回答,还值得进一步深入研究。
在APE1的表达特点与ORR、DCR的相关性分析中发现,APE1的高表达与放、化疗抵抗,预后差相关。同样,对于治疗过程中才出现脑转移的患者,脑转移发生的时间与肺原发病灶APE1的表达强度及亚细胞定位存在明显的相关性。表达强度越高及胞质异位表达者,越容易出现脑转移,这说明APE1的扩增或过表达与肿瘤细胞的侵袭和转移相关。
最后,APE1的表达特点与DFS和OS的相关性是本研究的主要目标,无论是肺原发病灶还是脑转移病灶,APE1表达强度越高,越容易出现局部复发,肺原发病灶与脑转移病灶APE1核表达者的DFS优于胞质异位表达者。而肺原发病灶APE1核表达者OS更长。但值得注意的是,有1例患者肺原发病灶APE1表达阴性,脑转移病灶表达为+,肺部病灶持续稳定,远处转移导致其治疗失败,而OS达到了36个月;而首诊时即出现脑转移的4例患者其脑转移病灶APE1的表达均为高表达,以上结果均提示APE1表达越高,其侵袭能力增强,治疗敏感性下降,预后越差。此外,作者还发现,APE1的亚细胞定位与T、N分期相关,核表达者T、N分期均较早,而胞质异位表达,N分期较晚,均为N2、N3,说明APE1亚细胞分布模式与肿瘤的侵袭性和预后有密切关系,核内型总是与较早的T分期、较少的淋巴结转移、较好的预后相关;相反,胞质型和核-质型染色状态则与不良的预后因素相关。综上所述,无论是肺原发病灶或是脑转移病灶,APE1表达强度越高,其疗效越差,预后越差;而APE1表达阴性或低表达的患者生存期明显延长;APE1的细胞质异位表达则提示APE1随着肿瘤病程的进展而增强,表现为由细胞核表达向细胞质表达过渡;当细胞质出现APE1强表达时可作为恶性生物学行为的标志,虽然这一结果无显著统计学差异,但与作者前期352例大样本回顾性研究已证实APE1基因的多态性与含铂方案一线化疗的晚期NSCLC的预后、不良反应具有相关性这一结果保持了高度一致性[19]。
总之,本研究证实APE1在NSCLC肺原发病灶及脑转移病灶中的表达水平及其细胞分布具有差异,APE1的高表达及细胞质异位表达可降低其治疗敏感性,与预后差相关。本研究的局限性在于样本量不足,不能很好地对数据进行分层分析。本研究已发现显著的临床趋势,还需要通过扩大样本量来进一步验证。后续的研究首选需增加样本量,同时侧重于功能的检测,如DNA修复能力的测定将用于进一步研究DNA碱基切除修复基因单核苷酸多态性及与治疗反应性和患者预后的关系,为基于分子变异的个体化治疗这一新的治疗模式提供理论依据。
