Wistar大鼠CBRH⁃3肝癌模型的构建*
2018-07-26杨炜冉立峰周崑朱辉王智彪重庆医科大学生物医学工程学院省部共建国家重点实验室培育基地重庆市超声医学工程重点实验室重庆市生物医学工程学重点实验室重庆市微无创医学协同创新中心重庆40006重庆医科大学附属第二医院HIFU肿瘤治疗中心重庆40006
杨炜,冉立峰,周崑,朱辉,王智彪(.重庆医科大学生物医学工程学院/省部共建国家重点实验室培育基地/重庆市超声医学工程重点实验室/重庆市生物医学工程学重点实验室/重庆市微无创医学协同创新中心,重庆40006;.重庆医科大学附属第二医院HIFU肿瘤治疗中心,重庆40006)
肝癌是致死率仅次于胃癌、食道癌的第三大恶性肿瘤。随着现代医疗科技的发展,肝癌的治疗也有了很大的进展,且有多种治疗方式,包括外科手术和非手术治疗,非手术治疗包括介入、射频、微波、放疗和高强度聚焦超声(HIFU)[1-2],这些治疗方式各有优势和特点,但要治愈肝癌仍然是医学界的难点。HIFU作为一种新型的无创治疗手段,近年来发展迅速,被广泛应用于各种非空腔脏器实体良恶性肿瘤、肝癌、腹膜后肿瘤、乳腺肿瘤、子宫肌瘤的治疗中。随着该技术的发展,还适应于多种非肿瘤良性疾病,能够从体外无创地、适形地消融体内的肿瘤。目前,HIFU已经成为肝癌治疗的重要手段之一[3-4]。但是HIFU治疗肝癌的机制还有待进一步研究。因此,为了研究HIFU治疗肝癌的机制,以期能使HIFU更好地应用于临床,建立合适的肝癌模型就具有重要的临床意义[5]。本文拟采用CBRH-3细胞株来构建大鼠肝癌模型,取得了比较令人满意的模型效果,现报道如下。
1 材料与方法
1.1 材料
1.1.1 实验动物 Wistar大鼠:雄性30只,鼠龄10周,体重60 g,由陆军军医大学大坪医院实验动物中心提供;裸鼠:雄性20只,体重20 g,由重庆医科大学实验动物中心提供。
1.1.2 材料 CBRH-3(wistar大鼠肝癌细胞株,贴壁细胞),购于北京银紫晶生物医药技术有限公司;胎牛血清由GIBCO公司生产。
1.2 方法
1.2.1 培养CBRH-3细胞株 将大鼠CBRH-3细胞株培养、扩增、传代,从液氮罐里取出细胞冻存管,迅速放入38℃水浴中,并摇动,在1 min内使其完全融化,然后在无菌下取出细胞,在1 000 r/min速度下离心5 min,弃上层液,加入适量培养液(含胎牛血清10%的DMEM细胞培养液),然后接种于培养瓶中,置37℃恒温CO2培养箱静置培养,第2天更换1次培养液,继续培养,观察细胞生长情况,若细胞密度达到90%时给予传代。倒出培养液,用磷酸盐缓冲溶液(PBS)洗1次,倒入0.25%的胰酶约1 mL。在显微镜下观察,如果细胞变圆,则加入DMEM培养液终止消化,巴氏管给予吹打使细胞脱落成细胞悬液,在1 000 r/min速度下离心5 min,弃去培养液,倒入新鲜的培养液,巴氏管吹打成细胞悬液,分入新的培养瓶中继续培养,按1∶3传代。
1.2.2 裸鼠皮下种植肿瘤细胞 将CBRH-3细胞株制成1×107mL-1的细胞悬液,注射入裸鼠背部两侧皮下,每侧注射0.1 mL,2周后注射部位观察长出直径1~2 cm大小肿块,用颈椎脱臼法处死裸鼠,无菌手术切下肿块,放到生理盐水中清洗,并把肿块切成0.3~1.0 mm3组织大小的碎片备用。
1.2.3 Wistar大鼠肝癌模型的制备 用8%硫化钠溶液将Wistar大鼠腹部脱毛,使其仰卧绑定于手术台,用10%的水合氯醛按照0.3 mg/100 mg对大鼠进行腹腔注射麻醉,在腹正中自剑突往下切开约1.5 cm创口,进腹后暴露肝脏,在肉眼直视用小镊子在肝脏上切一小口,长约5~10 mm,用纱布压迫止血后取一瘤块放入其内,缝合切口。必要时用吸收性明胶海绵颗粒进行填塞,如没有发现活动性出血后关闭腹腔,为预防感染给予肌内注射青霉素8万U。将大鼠交回饲养中心继续饲养,继续观察2周,术前1周及术后1周每天给每只大鼠注射地塞米松2 mg,大鼠的饮食、大小便及精神状态无明显变化。
2 结 果
2.1 磁共振成像(MRI)观察肿瘤的生长情况 在裸鼠腹腔移植传代CBRH-3细胞株接种后2周,除2只死亡外,58只中有51只在彩色多普勒超声和MRI(GE 1.5T)上显示直径大小约1~2 cm的肿瘤(2只出现2个肿块),彩色多普勒超声提示大多数肿块为高回声,只有少数呈低回声的表现;MRI检测采用FSE序列T2WI和T1WI脂肪抑制序列,发现51只均在相应部位出现圆形或类圆形肿块影,T1WI呈均匀低信号、T2WI和T2WI脂肪抑制呈高信号,所有的肿块均呈结节状,信号均匀,边界清楚,周围未见明显子灶,肿瘤无明显纤维包裹、钙化、凝固性坏死、出血、囊变和转移征象。有部分大鼠伴有腹腔积液和腹膜后种植转移灶。见图1、2。
2.2 大体观察及病理组织切片 肿瘤移植2周后,处死大鼠,肉眼观察肿瘤组织生长、内部结构特点及与周围正常肝组织的情况;取出肝脏肿瘤,放入10%甲醛中固定,并进行石蜡包埋切片以观察肿瘤的组织病理学特征(图3、4)。肿块为鱼肉状灰白组织,无出血或者坏死改变,和周围正常肝脏分界清楚,病理组织学:光学显微镜下检查发现,肿瘤细胞呈巢状或弥漫状分布,胞核大浓染,异型性明显,细胞大小不一,周边伴行多支小血管,血供丰富,胞质量少,为肝癌肿瘤。

图1 裸鼠肿瘤
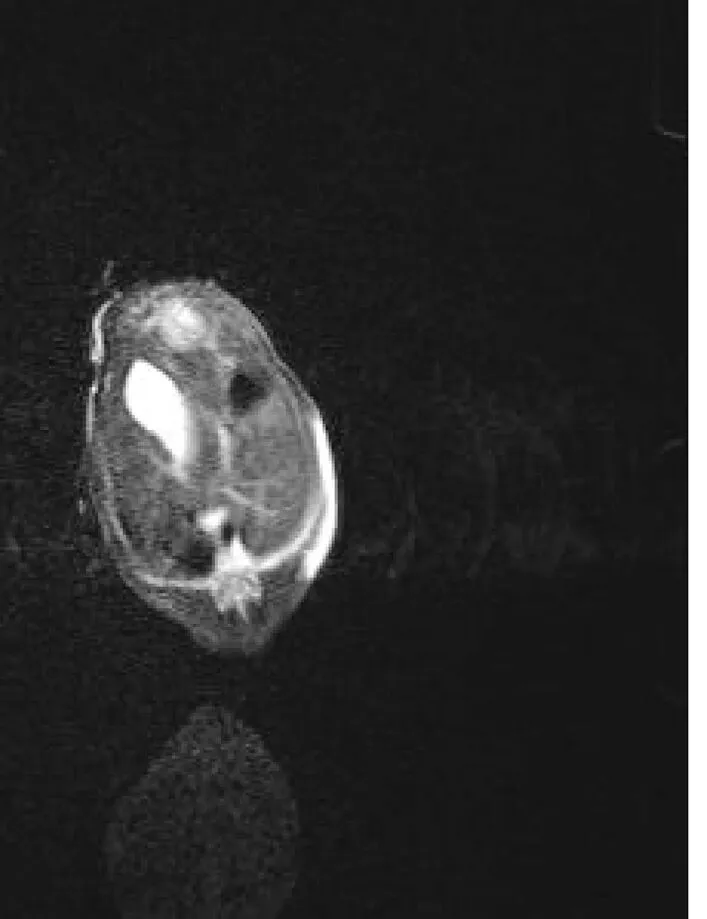
图2 MRI检查结果

图3 Wistar大鼠肝移植瘤
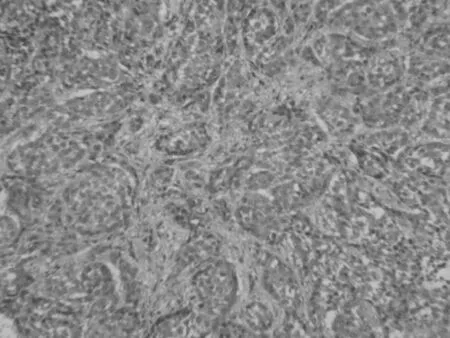
图4 Wistar大鼠肿瘤显微镜下(HE,200×)
3 讨 论
原发性肝癌是典型的富血供肿瘤[6-7],在中国是发病率最高的恶性肿瘤之一。其病变进展快,对患者危害大,病死率高,也是广大科学工作者研究的重点。目前肝癌的治疗方法主要为肝切除术和非手术治疗。但肝癌的发病十分隐匿,临床上仅有不到30%的患者就诊时可获得手术治疗的机会,同时患者术后肝癌复发率很高,患者肿瘤复发后的处理也相对较为困难,大部分患者只能接受非手术治疗,应用最广泛的非手术治疗方式是肝动脉化疗栓塞术(TACE)[8-9],其作用机制主要是用碘化油加化学药物栓塞肿瘤供血血管,使其缺血缺氧而发生坏死,并能够提高肿瘤局部化疗药浓度及作用时间,近期疗效确切,经过一段时间后栓塞剂会被清除,造成肿瘤复发,故其远期效果并不确切。HIFU是一种非侵入性治疗,具有创伤小,无放、化疗不良反应,且可重复进行的治疗手段。目前,在肝癌治疗领域已开始被接受用于无创治疗,取得了较好的临床效果。HIFU治疗肿瘤的机制是高温效应和空化效应,对于HIFU治疗肿瘤尤其是肝癌的研究还需要大量的动物实验和临床试验进行相关的研究。因此必须快捷、高速、经济地建立一种合适的肝癌动物模型,以利于促进HIFU治疗肝癌的理论和实践的发展。
近年来,大鼠肝癌模型分为3种,分别是诱发性模型[10]、自发性模型和移植性模型。诱发型常用二甲基亚硝胺(DENA)等化学物质诱发,建模周期较长,往往伴有肝硬化,肿瘤多为弥漫型或小结节型,无法满足各种试验性治疗的需要和影像学诊断等方面的研究;自发性肝癌模型是动物自然发生的,未经任何人工诱导。这类模型的缺点是培育及观察时间较长、耗费较大、发生率较低,难以满足研究的要求,目前已很少被采用。而移植性肝癌模型多呈结节肿块型,边缘较清晰,在影像诊断学方面和正常肝实质易于分别,进行各类实验研究,便于模拟各种实验模型。作者在肝癌实验中的动物常选用可移植Walker-256癌肉瘤的Wistar大鼠[11-12]和移植VX2鳞癌的新西兰大白兔[13-15],Wistar大鼠移植性肝癌模型国内研究较多,因其肿瘤血供与人类原发性肝癌相似,该模型的肿瘤血供特点为在瘤体直径小于3 mm时主要由门静脉供血,直径大于3 mm时主要由肝动脉供血。研究表明,其血供特点和生长行为与人类肝癌极相似。兔VX2肝癌模型是少数建立在大动物体内的肝脏富血供肿瘤模型,可以进行Seldinger法操作,从而最大限度地模拟临床经TACE治疗肝癌的操作过程,该模型也是供介入治疗药物代谢动力学研究较好的模型。但是这2种肿瘤模型的肿瘤细胞来源均不是肝癌细胞株,甲胎蛋白(AFP)阴性,故并不是真正意义上的肝细胞性肝癌模型。因此,本研究使用CBRH-3肝癌细胞株来构建肝癌模型。大鼠肝癌细胞株来源于用DNA诱发的大鼠原发性肝癌,病理鉴定为肝细胞性肝癌,细胞具有其起源的体内肝癌细胞的超微结构特点,且可分泌AFP,体外培养观察,细胞保持恶性类上皮细胞的形态特点,单层细胞培养可见细胞重叠堆积的生长现象,是很好的大鼠肝细胞癌瘤株,拟高效建立可以完全模拟临床肝癌的动物模型,有利于对HIFU治疗肿瘤的机制的深入研究。
作者通过对Wistar大鼠的CBRH-3肝癌模型的病理及影像学综合分析,认为该模型具有如下特点:(1)易于复制,移植成功率高,模型性能稳定,死亡率低;(2)肿瘤生长方式与临床肝细胞癌生长方式相似,呈膨胀浸润性生长结节状;(3)MRI表现与人体肿瘤相似,易于影像学诊断;(4)可快捷设计选择肿瘤移植生长部位。
总之,Wistar大鼠的CBRH-3肝癌模型的生物学特性与人类原发性肝癌相似,该方法简单安全,制作简单,造模周期短,适用于HIFU治疗肝脏肿瘤的效应和机制的深入研究,为HIFU治疗肝癌创造了良好的实验基础,值得推广。
