STK1基因对山梨醇高渗胁迫下玉米大斑病菌菌丝生长和发育的调控
2018-07-25张淑红张运峰范永山
张淑红,张运峰,范永山
(唐山师范学院 生命科学系,河北 唐山063000)
玉米大斑病(Northern Corn Leaf Blight)是由玉米大斑病菌(Setosphaeriaturcica)所引起的以叶部产生大型病斑症状为主的玉米病害,其分布广、危害重,是世界性的真菌病害[1-2]。玉米大斑病菌利用无性分生孢子传播,以侵染性菌丝在玉米寄主组织内扩展,并通过产生HT毒素(Helminthosporiumturcicumtoxin)抑制寄主的防御体系,从而引起病害症状[3-4]。MAPK信号转导途径对玉米大斑病菌分生孢子萌发、附着胞产生、致病性和HT毒素活性都有重要的调控作用[5-8]。巩校东等[9-10]研究发现,玉米大斑病菌至少存在Hog1、Slt2、Fus3/Kss1和Ime2等4条MAPK途径。谷守芹[11]利用候选基因法克隆了3个MAPK基因STK1、STK2和STK3,其中STK1基因属于Hog1-MAPK途径,主要与渗透胁迫和应激胁迫调节有关;STK2基因属于Slt2-MAPK途径,主要与病原菌的致病性和孢子发育有关;STK3基因属于Fus3/Kss1-MAPK途径,主要与细胞壁合成有关。Li 等[12]研究发现,STK1基因不仅调控玉米大斑病菌的渗透胁迫调节,而且与菌丝、分生孢子和附着胞发育、毒素合成及致病性都有关。因此,STK1基因是调控玉米大斑病菌生长、发育和致病性的重要MAPK基因。
王梅娟等[13]研究发现,在1.0 mol/L NaCl高渗胁迫条件下玉米大斑病菌生长受到抑制,甘油浓度增加,同时STK1基因的表达量稳定增加,从而明确甘油是玉米大斑病菌主要的一种渗透调节物质。谷守芹[11]和Li 等[12,14]的研究也证明,在NaCl、KCl、LiCl等盐胁迫条件下STK1基因具有重要的渗透调节功能。植物病原真菌进化了多条信号应答途径来适应环境中的渗透压变化,其中高渗透性甘油促分裂原激酶信号转导途径(HOG-MAPK)是植物病原真菌中最主要的渗透胁迫调节途径。该途径通过促进甘油积累、延缓细胞生长及调节其他生理条件抵抗渗透胁迫刺激[15]。在稻瘟病菌(Magnaportlregrisea)、炭疽病菌(Colletotrichnnrlagenarinm)、稻平脐蠕孢菌(Bipolarisoryzae)、栗疫病菌(Cryphonectriaparasitica)、小麦壳针孢(Mycosphaerellagraminicola)、灰葡萄孢菌(Botrytiscinerca)等植物病原真菌中均发现MAPK途径,并克隆了相应的Hog-MAPK同源基因[16]。但是在植物病原真菌高渗胁迫研究中,主要研究的是盐胁迫对生长、发育和致病性的影响,对山梨醇等有机分子的渗透胁迫研究却鲜见报道。
本研究利用玉米大斑病菌STK1基因的敲除突变体(knockout mutants,KO),比较该突变体与野生型菌株(WT)在山梨醇胁迫下菌落生长速度、菌丝形态及脂类物质在菌丝细胞内沉积情况等方面的差异,分析玉米大斑病菌在山梨醇高渗胁迫下的渗透调节机制,为进一步明确STK1基因对玉米大斑病菌渗透胁迫调节的分子机理,以及STK1基因在玉米大斑病菌生长、发育和致病性等方面的调控功能奠定基础。
1 材料与方法
1.1 供试菌种
玉米大斑病菌野生菌株(WT)01-23 及其STK1基因敲除突变体(KO)STM-35,均由河北农业大学谷守芹教授提供。
1.2 试验材料和供试培养基
油红O染液[17]:取油红0.5 g,加异丙醇至100 mL,60 ℃水浴中加温溶解30 min,配成油红O 储备液,置于棕色小磨沙口瓶保存。临用前取0.6 mL油红O加蒸馏水0.4 mL,混合静置10 min后用0.45 μm滤膜过滤除菌。
PDA培养基:马铃薯200 g,葡萄糖20 g,琼脂粉12 g,水1 000 mL。
DPA培养基:葡萄糖20 g,蛋白胨5 g,琼脂粉12 g,水1 000 mL。
1.3 试验方法
1.3.1 菌株培养和活化 将试管内保存的野生菌株 01-23 和突变体STM-35 分别接种到PDA培养基上,25 ℃黑暗倒置培养6 d后,再次转接到PDA平皿上,培养至菌落直径达到5 cm左右。
1.3.2 适宜高渗胁迫分析培养基的筛选 将野生菌株01-23分别接种于PDA和DPA培养基上,25 ℃黑暗倒置培养6 d后,挑取菌丝于洁净载玻片上,滴入适量PBS缓冲液,置于显微镜下观察。
1.3.3 高渗胁迫处理 无菌条件下,用打孔器(直径为7 mm)在01-23和STM-35菌落外缘打取菌盘,然后接种至3 种不同山梨醇浓度(1.0,1.5,2.0 mol/L)的DPA 培养基平板上,置于恒温培养箱中25 ℃黑暗培养,以在无山梨醇的DPA 培养基上生长的菌株为对照(CK)。
1.3.4 菌落、菌丝形态观察及生长速率测定 将菌株在高渗固体培养基上培养8 d 后,观察菌落形态,采用十字交叉法测量菌落直径,计算抑制率,显微观察菌丝的形态特征及发育情况。
抑制率=(对照菌落直径-高渗处理菌落直径)/(对照菌落直径)×100%。
1.3.5 脂类物质沉积的形态学观察 将2.0 mol/L山梨醇处理的WT和KO菌株利用油红O染液进行脂肪染色、制片,并在显微镜下观察脂类物质沉积的形态学变化。染色参照陈侃等[17]的方法略作修改,具体步骤:取培养10 d的菌株,向培养皿中加入3 mL无菌水,轻轻刮取菌丝,用双层擦镜纸过滤,滤液经12 000 r/min离心5 min后去掉上清,收集沉淀,用液氮反复冻融5次,转入4%中性甲醛中固定12 h,取出用PBS漂洗后放入60%异丙醇中浸泡30 min,取出后加入50 μL油红O染液,黑暗条件下染色24 h,置于60%异丙醇中脱色,显微镜下观察染色情况并照相。
1.4 数据统计分析
利用IBM SPSS Statistics (version 19)软件(SPSS Inc.)对试验数据进行ANOVA方差分析。
2 结果与分析
2.1 玉米大斑病菌高渗胁迫培养基的筛选
由于PDA培养基中马铃薯浸提液中含有盐离子,并且不同马铃薯品种及熬煮时间都可能对其浸提液中盐离子浓度产生影响,从而干扰本试验中高渗胁迫分析结果。而蛋白胨作为一种化学产品,不仅排除了生产工艺的干扰,而且蛋白胨中不含盐离子或盐离子非常少,不会影响本试验中高渗胁迫分析结果,因此本研究采用蛋白胨代替马铃薯浸提液的DPA培养基进行高渗胁迫分析。通过比较WT菌株与KO菌株在PDA和DPA培养基上的菌丝形态,结果发现,在PDA培养基上WT菌株与KO菌株生长菌丝形态有较明显的区别,WT菌株的菌丝细胞内有明显颗粒状内容物出现,而KO菌株的菌丝细胞内无明显颗粒状内容物。在DPA培养基上,WT菌株与KO菌株的菌丝细胞内均有明显的颗粒状物出现,2种菌株的菌丝状态相似。因此,DPA培养基更适于分析STK1基因对渗透胁迫的调控作用。
2.2 山梨醇高渗胁迫对玉米大斑病菌菌落生长的影响
山梨醇高渗胁迫对玉米大斑病菌菌落生长速度的影响见图1。
由图1可以看出,在1.0 mol/L山梨醇胁迫条件下,KO菌株与WT菌株的菌落生长速度没有显著差异,但在1.5和2.0 mol/L山梨醇胁迫条件下,KO菌株的菌落生长速度都显著低于WT菌株,表明KO菌株对较高浓度山梨醇的渗透胁迫比WT菌株更敏感。
对WT菌株,未加山梨醇和山梨醇浓度为1.0 mol/L 的DPA培养基中,WT菌株的菌落生长速度基本上一致;当山梨醇浓度大于1.0 mol/L时,浓度越大,菌落生长速度越慢(图1-A),即高浓度山梨醇对WT菌株菌落生长速度有显著抑制作用。
对KO菌株,在1.0 mol/L山梨醇高渗胁迫条件下,KO菌株的生长速度显著加快,当山梨醇浓度增加到1.5和2.0 mol/L时,菌落生长速度又显著减慢,说明一定浓度山梨醇高渗胁迫对KO菌株的菌落生长速度有促进作用,但高浓度山梨醇却有抑制作用(图1-A)。
由图1-B可以看出,除在1.0 mol/L山梨醇胁迫条件下KO菌株的菌落生长速度得到显著的促进作用以外,其它处理的菌落生长速度均受到显著的抑制作用。在1.5和2.0 mol/L山梨醇渗透胁迫下,KO菌株菌落生长速度的抑制率显著高于WT菌株。
2.3 山梨醇高渗胁迫对玉米大斑病菌菌落形态和颜色的影响
在山梨醇高渗胁迫条件下,WT菌株和KO菌株的菌落形态没有显著变化,但菌落颜色变化非常明显。在山梨醇高渗胁迫条件下,WT菌株的菌落颜色由黑色变为灰白色,而KO菌株则在1.5 mol/L山梨醇胁迫条件下菌落颜色变深,在1.0和2.0 mol/L山梨醇胁迫条件下菌落颜色变浅(图2)。
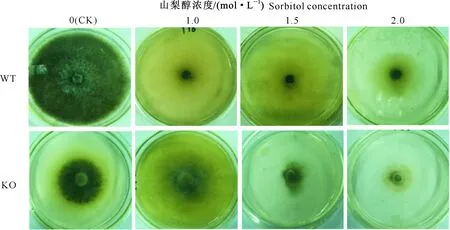
图2 山梨醇高渗胁迫对玉米大斑病菌菌落形态和颜色的影响Fig.2 Effects of sorbitol hypertonic stress on colony morphology and color of Setosphaeria turcica
2.4 山梨醇高渗胁迫对玉米大斑病菌菌丝形态的影响
山梨醇高渗胁迫对玉米大斑病菌菌丝形态的影响结果见图3。由图3可以看出,在无山梨醇添加的DPA培养基上,WT菌株和KO菌株的菌丝形态无明显差别。在1.0 mol/L山梨醇胁迫条件下,KO菌株的菌丝形态没有明显变化,而WT菌株的菌丝细胞内出现了大量的小型颗粒状物质。在1.5 mol/L山梨醇胁迫条件下,KO菌株的菌丝细胞内也出现了大量的小型颗粒状物质,而WT菌株的菌丝细胞内出现了较多的大型颗粒状物质。在2.0 mol/L 山梨醇胁迫条件下,KO菌株的菌丝变粗,原生质体浓缩成颗粒状,而WT菌株的菌丝细胞内出现很多空隙。
2.5 山梨醇高渗胁迫对玉米大斑病菌菌丝细胞内脂类物质沉积的影响
由于脂类物质是玉米大斑病菌菌丝内主要的渗透胁迫调节物质[13],在图3中出现的颗粒状物质极有可能是脂类物质的积累。因此,本研究利用油红O染色剂,对WT菌株和KO菌株在2.0 mol/L山梨醇高渗胁迫条件下菌丝细胞内脂类物质的沉积情况进行显微观察,结果(图4)发现,与高渗胁迫处理前相比,2.0 mol/L山梨醇高渗胁迫后,WT菌株菌丝细胞内的脂滴数量明显增多,并且脂滴体积明显增加,而KO菌株的菌丝细胞变粗膨大,脂滴数量有所减少,但脂滴体积显著变大。脂滴的分布情况也明显不同,在高渗胁迫处理前,WT菌株和KO菌株的脂滴分布都不均匀,但山梨醇高渗胁迫处理后,WT菌株的脂滴大小及分布都比较均匀一致,而KO菌株大脂滴和小脂滴并存且分布极不均匀,位于中部或偏于某一侧。该试验结果与图3的表现基本一致。

图3 山梨醇高渗胁迫对玉米大斑病菌菌丝形态的影响Fig.3 Effects of sorbitol hypertonic stress on hypha morphology of Setosphaeria turcica

图4 山梨醇高渗胁迫对玉米大斑病菌菌丝细胞内脂类物质沉积的影响Fig.4 Effects of sorbitol hypertonic stress on lipid deposition in hypha cells of Setosphaeria turcica
3 讨论与结论
山梨醇是一种重要的渗透胁迫调节物质,它可以与水、甘油和丙二醇混溶,因此具有与NaCl、KCl等盐分子不同的化学性质[18]。在植物的耐盐胁迫研究中,200 μg/mL 山梨醇浸种处理可促进无花果种子萌发,加速可溶性糖和脯氨酸积累,增强无花果幼苗渗透调节,有效降低盐胁迫对幼苗细胞造成的伤害,提高无花果幼苗耐盐性[19]。因此,山梨醇渗透胁迫与盐胁迫具有不同的渗透调节机制。在本课题组的前期研究中发现,在相同的盐离子浓度条件下,与野生型(WT)菌株相比,STK1基因敲除突变体(KO)菌株的菌丝生长缓慢,细胞内容物减少,生理状况降低[12,14]。但是本试验的研究结果表明,在1.0 mol/L山梨醇渗透胁迫条件下,玉米大斑病菌KO菌株生长状况与WT菌株没有显著差异,只有当山梨醇浓度提高到1.5 mol/L以上时,才显著抑制了KO菌株的菌丝生长速度。因此,STK1基因在山梨醇高渗胁迫调节过程中存在一个滞后的信号应答过程。另外,与非渗透胁迫相比,在1.0 mol/L山梨醇渗透胁迫条件下,KO菌株菌丝生长速度不但未受到抑制,反而得到促进,说明1.0 mol/L山梨醇处理使玉米大斑病菌菌丝恢复了部分渗透胁迫调节功能,即1.0 mol/L山梨醇处理可能增强了菌丝的渗透胁迫调节能力,“补偿”了STK1被敲除后造成的某些功能障碍。该试验结果与山梨醇是桃[20]、烟草[21]等植物渗透调节物质和医药领域渗透剂[22]的结论是一致的,并且Stavniichuk等[23]研究表明,山梨醇通路与MAPK通路可协同调控糖尿病的发生。但是,更高浓度的山梨醇对这一未知途径也产生了一定的阻遏作用,使玉米大斑病菌的渗透胁迫调节能力受到了不可逆的抑制作用,不仅菌落生长速度受到抑制,而且细胞壁色素的合成受到干扰,菌丝颜色变浅;细胞内物质的降解能力下降,出现颗粒状物质积累。研究表明,参与渗透胁迫调节的细胞壁色素物质为黑色素,而这些颗粒状物质极有可能是渗透胁迫调节物质[24-25]。王梅娟等[13]研究表明,玉米大斑病菌的渗透胁迫调节物质主要为甘油,而真菌细胞内甘油主要来自于脂肪的降解。因此,菌丝细胞内脂类物质沉积形成的脂滴大小和分布与渗透胁迫调节能力密切相关。在本试验中发现,山梨醇高渗胁迫条件下,脂类物质的沉积与颗粒状物质的分布基本一致。利用油红O染色观察脂类物质在菌丝内的沉积情况,发现STK1基因缺失后脂滴的大小及分布均与野生型菌株不同,因此,STK1基因很可能通过调控脂类物质合成进行渗透胁迫调节。
