牛ODF2和PDF2转录组测序筛选卵泡发育的相关基因
2018-07-24李鹏飞郝庆玲毕锡麟朱芷葳吕丽华山西农业大学生命科学学院山西农业大学动物科技学院山西太谷03080
李鹏飞, 郝庆玲, 毕锡麟, 王 锴, 朱芷葳, 吕丽华(.山西农业大学生命科学学院;.山西农业大学动物科技学院,山西 太谷 03080)
牛卵泡的发育过程受多方面因素的调节.对卵泡发育阶段的划分也较为复杂,在1927—1986年的大量文献中,对牛卵泡发育阶段的划分一直沿用有腔卵泡生长和闭锁的概念[1].超声波监测技术的应用和发展,为无损伤监测和采集特定阶段的牛卵泡,并深入研究影响牛卵泡发育提供了条件.Romereim et al[2]通过基因芯片对牛颗粒细胞(granulesa cells, GCs)和膜细胞、大黄体细胞和小黄体细胞进行转录组检测和分析,筛选牛卵泡发育和黄体形成的调控基因;Terenina et al[3]通过高通量测序分析猪生长卵泡和闭锁卵泡GCs表达谱,筛选出1 684个调控卵泡发育的重要基因,其中包括11个调控闭锁的标记基因.牛卵泡在发育过程中,原始卵泡经募集后进入发育期,随着卵泡GCs的增殖分化,GCs增大增多,随之出现卵泡的优势化,即卵泡发育偏差期的出现.偏差期的出现将牛卵泡发育过程分为两个阶段,即偏差期前和偏差期后的卵泡,偏差期前的第二大卵泡(the second largest follicle at onset of predeviation, PDF2)在发育过程中可能成为优势卵泡并最终排卵,而偏差期后的第二大卵泡(the second largest follicle at onset of deviation, ODF2)随着优势化卵泡的出现,最终走向闭锁.本课题组通过Illumina平台对牛发情期内出现偏差前的最大卵泡(PDF1)、PDF2、出现偏差后的最大卵泡(ODF1)和ODF2等4个转录组进行了深度测序,对影响牛卵泡发育的基因进行挖掘[4-5],并对CART、TEDDM1、AGTR2和CMKLR1等部分基因进行了深入研究[6-8].本试验对ODF2和PDF2进行转录组分析,深入挖掘影响牛卵泡发育的调控基因,旨在为进一步厘清基因调控对卵泡发育的影响提供参考.
1 材料与方法
1.1 试验动物及样品采集
选择6头性成熟雌性青年牛,标准饲养管理水平下同期发情处理,每12 h采用B超声波仪检测一次并详细绘制双侧卵巢各发育卵泡变化图.其中,3头牛在卵泡波出现偏差前屠宰采集PDF2;另3头牛在卵泡波出现偏差后屠宰采集ODF2.将各卵泡置于4 ℃的DPBS中待处理.
1.2 方法
1.2.1 GCs的分离及总RNA的抽提 依次将各卵泡置于盛有DPBS的平皿中,一分为二剪开卵泡并用刮刀分离GCs,弃卵泡膜;将GCs和DPBS一并转移至EP管,于2 000 r·min-1离心15 min,弃上清;添加500 μL RNAiso Plus抽提总RNA.
1.2.2 文库构建及测序 分别取各组RNA样品8 μL,Oligo磁珠富集后裂解;裂解产物作为模板,加入随机引物及一系列缓冲液合成cDNA第一链和第二链;用QiaQuick PCR kit试剂盒纯化,经EB洗脱、末端修复、加尾及5′和3′接头;电泳回收片段并进行PCR扩增,构建完整的cDNA文库;用Illumina HiSeq 2000平台测序.
1.2.3 转录组差异表达基因的筛选 参考Audic et al[9]的方法筛选差异表达基因,参数设定为:截断值≥0.5,ODF2-RPKM/PDF2-RPKM≥2,PDF2-RPKM/ODF2-RPKM≥2,FDR校正值的P<0.05,获得差异表达基因.
1.2.4 差异表达基因GO和KEGG通路分析 使用DAVID 6.7在线软件(https://david.ncifcrf.gov/)对筛选出的差异表达基因进行GO和KEGG通路分析,文本框输入基因列表,物种设定为牛,设定P<0.05,分别获得基因功能聚类和KEGG通路分析结果.
1.2.5 卵泡发育相关基因的筛选 选取KEGG通路和GO分析中的关键通路和富集基因,经基因功能查询系统GeneCards(http://www.genecards.org/)筛选与牛卵泡发育密切相关的基因.
2 结果与分析
2.1 高表达基因的筛选
转录组测序共获得35 325个基因.其中,高表达基因有15 536个(截断值≥0.5),表1列出了表达量最高的10个基因,可见ODF2和PDF2中的高表达基因表达差异较小,表明这些高表达基因贯穿牛卵泡发育的整个过程,对维持卵泡的正常发育具有重要作用.如GSTA3参与类固醇合成过程;SERPINE2具有抑制蛋白酶活性的功能;INHA、INHBA和FST具有抑制促卵泡素分泌的作用;也有间接调控细胞凋亡的基因,如SRGN.
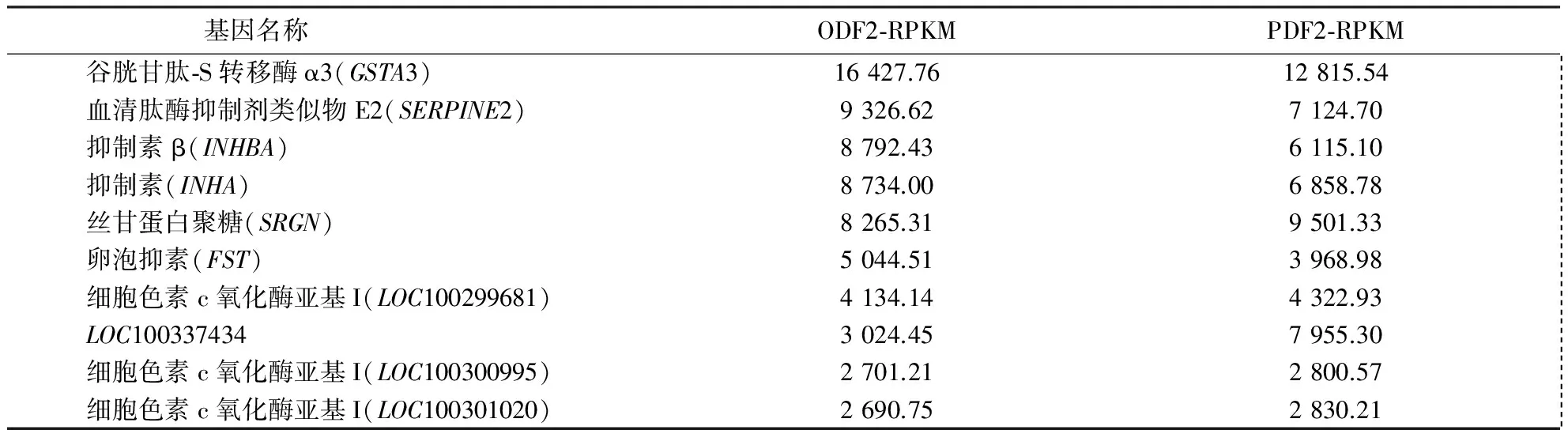
表1 转录组ODF2和PDF2中表达量最高的基因Table 1 The highest expression genes in ODF2 and PDF2 follicles
2.2 高差异表达基因的筛选
对高表达基因进行进一步的筛选,共发现504个差异表达基因.其中,ODF2相对于PDF2上调的差异表达基因有198个;PDF2相对于ODF2上调的差异表达基因有306个.表2列出了双向表达差异倍数最高的10个基因及其功能注释,其中有参与转录调控的RN5-8S1和ZKSCAN1,有参与负调控卵泡发育的神经肽CARTPT和ULBP3,也有参与免疫调控的SPP1和BOLA-N.

表2 ODF2和PDF2中高差异表达基因及其功能1)Table 2 List of high differential expression genes in ODF2 vs. PDF2 and their functions
1)-表示数据库基因功能查询无结果.
2.3 ODF2和PDF2转录组差异表达基因的GO分析
对504个差异表达基因进行GO分析,其中,350个基因获得注释,分三大类:生物过程占39.49%,细胞组分占46.96%,分子功能占13.55%(图1~3).通过GO分析可较为直观地筛选一些重要基因,如参与细胞发育的基因共有37个(图1),其中,STK11、ARID4B、SOX4、GREM1和TGFBR3等部分基因在其他转录组的筛选中也出现过;通过调节跨膜受体蛋白激酶活性参与分子功能的基因有NTRK1、TGFBR3、KIT和EPHA2(图2);参与胞内物质组分的基因有182个,参与细胞骨架形成的基因有39个(图3).
2.4 ODF2和PDF2转录组差异表达基因的KEGG通路分析
KEGG通路分析结果(表3)表明,差异表达基因参与10条显著富集的信号通路调节.其中在牛卵泡GCs发育调控中研究较多的通路有3条:参与PI3K-Akt信号通路调节的基因有12个,参与Wnt信号通路调节的基因有11个,参与mTOR信号通路调节的基因有4个.

图1 差异表达基因生物过程功能注释Fig.1 Biological process functional annotation of differentially expressed genes
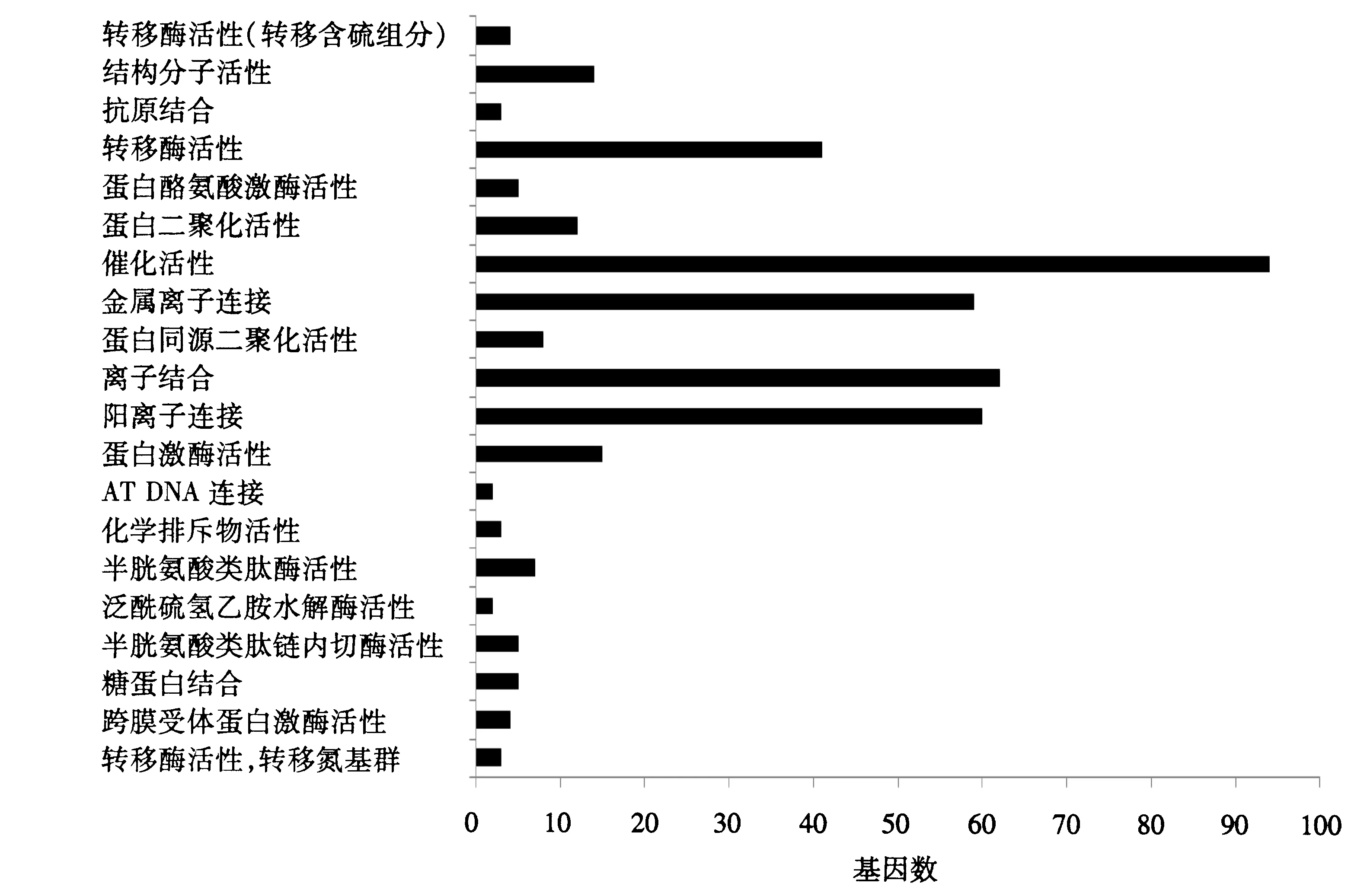
图2 差异表达基因分子功能注释Fig.2 Molecular functional annotation of differentially expressed genes
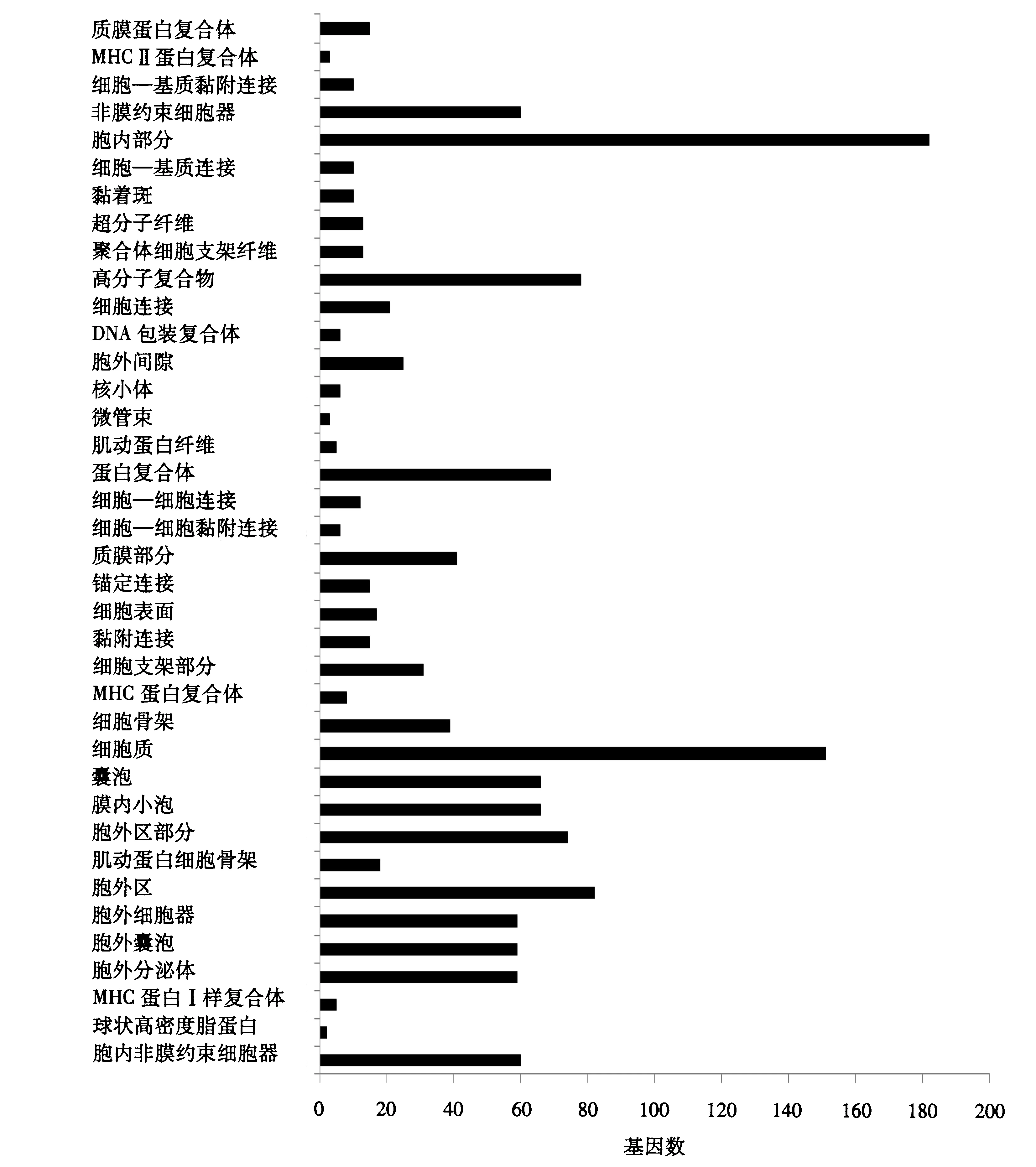
图3 差异表达基因细胞组分功能注释Fig.3 Cellular component functional annotation of differentially expressed genes

表3 差异表达基因KEGG通路功能注释Table 3 KEGG pathway functional annotation of differentially expressed genes
2.5 卵泡发育相关基因的筛选
经KEGG通路和GO功能富集分析后,筛选直接与卵泡发育相关的功能聚类和信号通路调控基因进行GeneCards功能查询,共获得18个与卵泡发育密切相关的差异表达基因,各差异基因表达倍数及功能注释见表4.
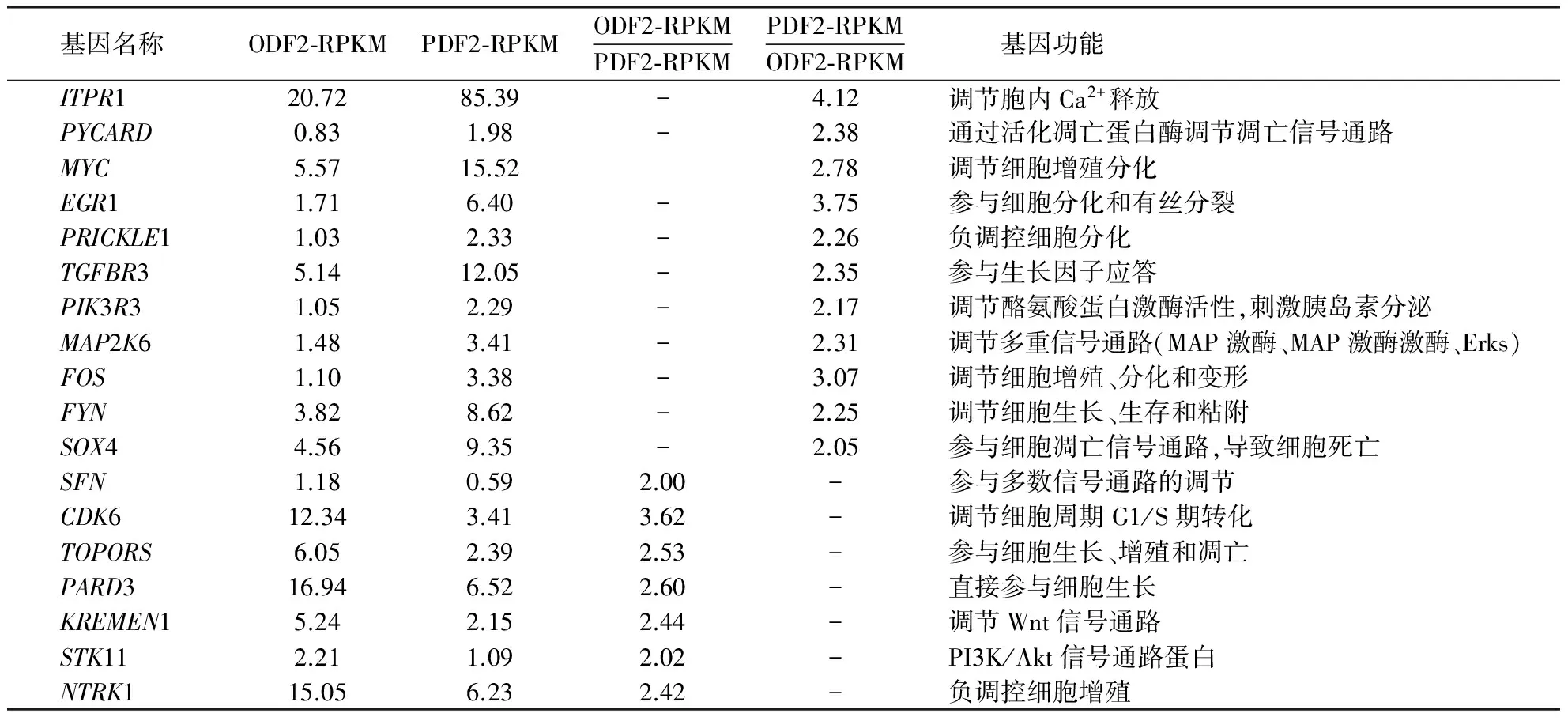
表4 卵泡发育相关基因的筛选Table 4 Candidate genes associated with follicular development
3 讨论
近年来,高通量RNA测序技术成为转录组分析的重要工具[10],尤其在卵巢卵泡发育和成熟的相关研究中广泛应用[11].通过全基因组转录组分析,获得许多差异表达基因编码的信号分子,如GDF9、BAX、BAD、NDUFA13、IFI6和CAV1基因对绵羊繁殖力有重要影响[12].同样,在牛卵泡发育波中,对黄体生成素波峰前后的卵泡GCs进行转录组分析,发现部分基因表达量的上调对排卵具有重要调控作用[11].这表明转录组分析技术筛选卵泡发育调控基因的应用效果较好;且Illumina测序平台具有试验误差小,重复性好的特点[13].因此,本试验通过Illumina测序技术对不同生理阶段的发育卵泡进行转录组分析,旨在进一步获得影响牛卵泡发育的调控基因.
磷脂酰肌醇3激酶—蛋白激酶B(PI3K-Akt)作为经典信号通路,其活性受类脂磷酸酶PTEN调节,PI3Ks通路参与细胞分化、增殖和凋亡功能的调节.研究发现,PI3K与下游蛋白激酶B(PKB或Akt)形成的通路对调节癌细胞增殖和存活具有重要作用[14].Ma et al[15]研究表明,雄激素通过PI3K-Akt通路磷酸化作用影响动物正常排卵.卵泡刺激素对小鼠卵泡GCs氧化性损伤具有保护作用,其机理是通过PI3K-Akt-mTOR通路的激活,使得卵泡刺激素调节的氧化诱导自噬激活,保证了卵泡GCs的存活[16].KEGG通路分析表明,有12个基因参与PI3K-Akt信号通路调节,其中,STK11、CDK6、MYC和PIK3R3通过细胞周期、增殖分化和激素分泌调节参与牛卵泡的发育过程.
mTOR是丝氨酸/苏氨酸蛋白激酶,其C末端TOR区域与PI3K催化区高度同源,mTOR通路受多种细胞信号调节,如促有丝分裂生长因子和胰岛素等[17],参与青春期发育、促性腺激素分泌、卵泡发育和成熟的调节[18].研究表明,阻断mTOR通路可诱导小鼠有腔卵泡形成的延长[18];张毅敏等[19]研究也表明,针刺疗法治疗小鼠卵巢功能早衰,其疗效与雌激素处理相当,作用机制可能是通过上调PI3K/Akt/mTOR信号通路中的基因或蛋白表达实现的.本试验结果表明,STK11、ULK3、PIK3R3和EIF4E2参与了牛卵泡mTOR信号通路的调节,其中,STK11、PIK3R3和EIF4E2也参与了PI3K-Akt信号通路调节,这也表明在卵泡发育的过程中,PI3K-Akt通路与mTOR通路互相交织,共同调节卵泡的发育进程.
Wnt通路是一组通过细胞表面受体将信号向胞内转导的蛋白,该通路分为经典Wnt信号通路、非经典Wnt信号通路以及Wnt/Ca2+信号通路,3条通路均是通过Wnt-蛋白配体连接卷曲家族受体激活,参与动物胚胎发育和细胞增殖[20].Hossein et al[21]研究表明,Wnt信号通路的激活直接诱导小鼠卵泡GCs的终末分化,促进卵泡成熟;Aydos et al[22]通过基因芯片技术对人体多囊卵巢综合征患者卵泡GCs和卵丘细胞表达谱进行了转录组分析,结果表明,GCs和卵丘细胞表面的Wnt信号通路受到抑制,影响卵泡和卵母细胞的成熟,进而导致疾病发生.本试验共获得11个基因参与卵泡GCs表面Wnt信号通路的调控.
4 结论
经牛卵巢ODF2和PDF2转录组分析,共获得504个差异表达基因,获得10条显著富集的信号通路可能参与牛卵泡发育的调控;筛选出18个可能与牛卵泡发育密切相关的基因.
