PCV-2d基因型的PCR-RFLP诊断方法的建立
2018-07-24郑庆礼吴昊宸黄瑞玲许文煌张誓育王全溪福建农林大学动物科学学院福建福州350002
郑庆礼, 吴昊宸, 黄瑞玲, 许文煌, 张誓育, 王全溪(福建农林大学动物科学学院,福建 福州 350002)
猪圆环病毒(porcine circovirus, PCV)被认为目前所发现的最小病毒[1].根据研究表明,PCV1并不导致猪群致病,而PCV2可以导致猪群发病[2].PCV2发现于20世纪90年代末,该病毒给养猪业造成巨大的损失[3].PCV2可引起猪的免疫抑制,可导致猪群发生断奶仔猪多系统衰弱综合征(postweaning multisystem wasting syndrome, PMWS)、猪皮炎肾病综合征(porcine dermatitis and nephropathy syndrome, PDNS)等[4].PCV2主要开放阅读框架有ORF1、ORF2和ORF3,其中ORF2编码的是主要的结构蛋白Cap蛋白,能使机体产生中和抗体[5].PCV2的基因型可分为PCV-2a、PCV-2b、PCV-2c、PCV-2d和PCV-2e等基因型[6].PCV-2b是国内流行的主要基因型,PCV2d仅次于PCV2b[5].在PCV的前期研究中,普遍认为PCV2b具有高致病性,而后研究表明,PCV-2a与PCV-2b的毒力并没有显著差异[7].根据Xiao et al报道,美国PCV-2d的流行程度从2012年的37.8%升高到2016年的72%,该研究结果表明,PCV-2d已代替PCV-2b成为流行株[8].PCV-2c目前仅在丹麦和巴西被发现,我国尚未发现PCV-2c型[9-10].PCV-2e基因型并不常见[11].
近年来,由于PCV2疫苗的使用,PCV2的流行得到有效控制.由于PCV2的基因型较多,经常出现免疫失败.有研究表明,PCV-2b的中和抗体可以中和PCV-2d病毒,但是不能完全清除猪体内的PCV-2d病毒[12].因此,有必要建立能够鉴别PCV-2d的诊断方法.本研究利用PCR-RFLP技术,建立了PCV-2d基因型的诊断方法,该研究结果对于临床快速诊断PCV-2d具有重要意义.
1 材料与方法
1.1 样品的采集与处理
本实验室保存的PCV-2d的克隆质粒.
1.2 仪器和试剂
主要仪器:Dl9700型PCR仪(北京东林生物技术公司)和DYY16D电泳仪(北京六一生物技术有限公司).
主要试剂:动物组织DNA提取试剂盒、Eeay Taq Mix、DL 2000 DNA Marker(北京全式金生物技术有限公司);DNA凝胶回收试剂盒(康为世纪生物科技有限公司);MSPI酶[New England Biolabs (NEB)公司].
1.3 引物设计及酶切位点选择
根据NCBI上GenBank公布的PCV-2的基因序列,利用Oligo7设计引物,PCV-2扩增的引物序列,PCV-2-F:5′-CGGGATCCATGACGTATCCAAGGAGGC-3′;PCV-2-R:5′-TTAGGGTTTAAGTGGGGGGT-3′,扩增产物702 bp;引物均由上海生物工程股份有限公司合成 .利用NEB在线软件对PCV2基因型进行酶切分析,发现PCV-2d含特有MSPI酶切位点,PCV-2d的酶切位点位于475 bp,可将PCV2d分为2个片段475和327 bp.
1.4 特异性试验
分别以猪瘟病毒(CFV)cDNA,伪狂犬病毒(PR) ,蓝耳病毒(PRRSV)cDNA,流行性腹泻(PEDV)cDNA的核酸为模板,用设计的引物及上述的条件进行PCR扩增,PCR产物经1%琼脂糖凝胶120 V恒压电泳30 min,凝胶成像系统观察反应结果并拍照.
1.5 PCR反应体系的优化
1.5.1 退火温度的优化 PCR反应体系25 μL:模板2 μL,Eeay Taq Mix 12.5 μL,上、下游引物各1 μL,ddH2O 8.5 μL.PCR反应条件:95 ℃变性 5 min,95 ℃变性30 s,退火30 s,温度设置梯度分别为50 ℃、52 ℃、54 ℃、56 ℃、58 ℃、60 ℃,72 ℃延伸30 s,30个循环,72 ℃延伸8 min.PCR产物经1%琼脂糖凝胶120 V恒压电泳30 min,凝胶成像系统观察反应结果并拍照,筛选出最合适的退火温度.
1.5.2 模板量的优化 PCR反应体系25 μL,模板量设置梯度1.0、1.5、2.0、2.5、3.0、3.5 μL,Eeay Taq Mix 12.5 μL,上、下游引物各1 μL,ddH2O相应补足至25 μL.PCR反应条件:95 ℃变性5 min,95 ℃变性30 s,退火温度58 ℃ 30 s,72 ℃延伸30 s,30个循环,72 ℃延伸8 min.反应完成后,PCR产物经1%琼脂糖凝胶120 V恒压电泳30 min,凝胶成像系统观察反应结果并拍照,筛选出最合适的模板量.
1.5.3 循环数的优化 PCR反应体系25 μL,模板2 μL,Eeay Taq Mix 12.5μL,上、下游引物各1 μL,ddH2O 8.5 μL.PCR反应条件:95 ℃变性5 min,95 ℃变性30 s,退火58 ℃ 30 s,72 ℃延伸30 s,循环数设置梯度,分别为25、30、35、40个循环,72 ℃延伸8 min,PCR产物经1%琼脂糖凝胶120 V恒压电泳30 min,凝胶成像系统观察反应结果并拍照,筛选出最合适的循环数.
1.5.4 遗传进化树构建及同源性分析 将阳性样品的PCR产物送生工测序,并构建遗传进化树,进行同源性分析.
1.6 PCR产物的RFLP
取PCV-2d基因型的PCR产物,用MSPI限制性内切酶进行酶切.酶切体系(12.5 μL):PCR产物8 μL,MSPI 1 μL,10*Cut Buffer 1.5 μL,ddH2O 8 μL.酶切时间为2 h.将酶切产物经1%琼脂糖凝胶120 V恒压电泳30 min, 凝胶成像系统观察反应结果并拍照.
1.7 PCR-RFLP的反应体系优化
1.7.1 PCR-RFLP体系酶量的条件优化 酶切体系(12.5 μL),PCR产物8 μL,酶量设置梯度0.25、0.5、1.0、1.5、2.0 μL,10*Cut Buffer 1.5 μL,ddH2O相应补足至12.5 μL.PCV-2d进行酶切2 h.将酶切产物经1%琼脂糖凝胶120 V恒压电泳30 min,Alpha凝胶成像系统观察反应结果并拍照.
1.7.2 PCR-RFLP体系酶切时间的条件优化 酶切体系(12.5 μL):PCR产物8 μL ,MSPI 1 μL,10×Cut Buffer 1.5 μL,ddH2O 2 μL.酶切时间为0.5 h、1 h、1.5 h、2 h、2.5 h.将酶切产物经1%琼脂糖凝胶120 V恒压电泳30 min,凝胶成像系统观察反应结果并拍照.
1.8 敏感性、重复性酶切的PCR-RFLP分析
将初始浓度为1 μg·μL-1的PCV-2d克隆质粒用ddH2O进行10倍稀释,共设置7个梯度,以稀释后的DNA为模板,进行PCR扩增,并将PCR产物进行酶切,最后将酶切产物经1%琼脂糖凝胶120 V恒压电泳30 min,凝胶成像系统观察反应结果并拍照.
1.9 PCR-RFLP方法在临床样品检测中的应用
将临床已确定为PCV2的24份DNA进行PCR,对PCR产物用MSPI酶进行酶切,最后将酶切产物经1%琼脂糖凝胶120 V恒压电泳30 min,凝胶成像系统观察反应结果并拍照.
2 结果与分析
2.1 特异性试验结果
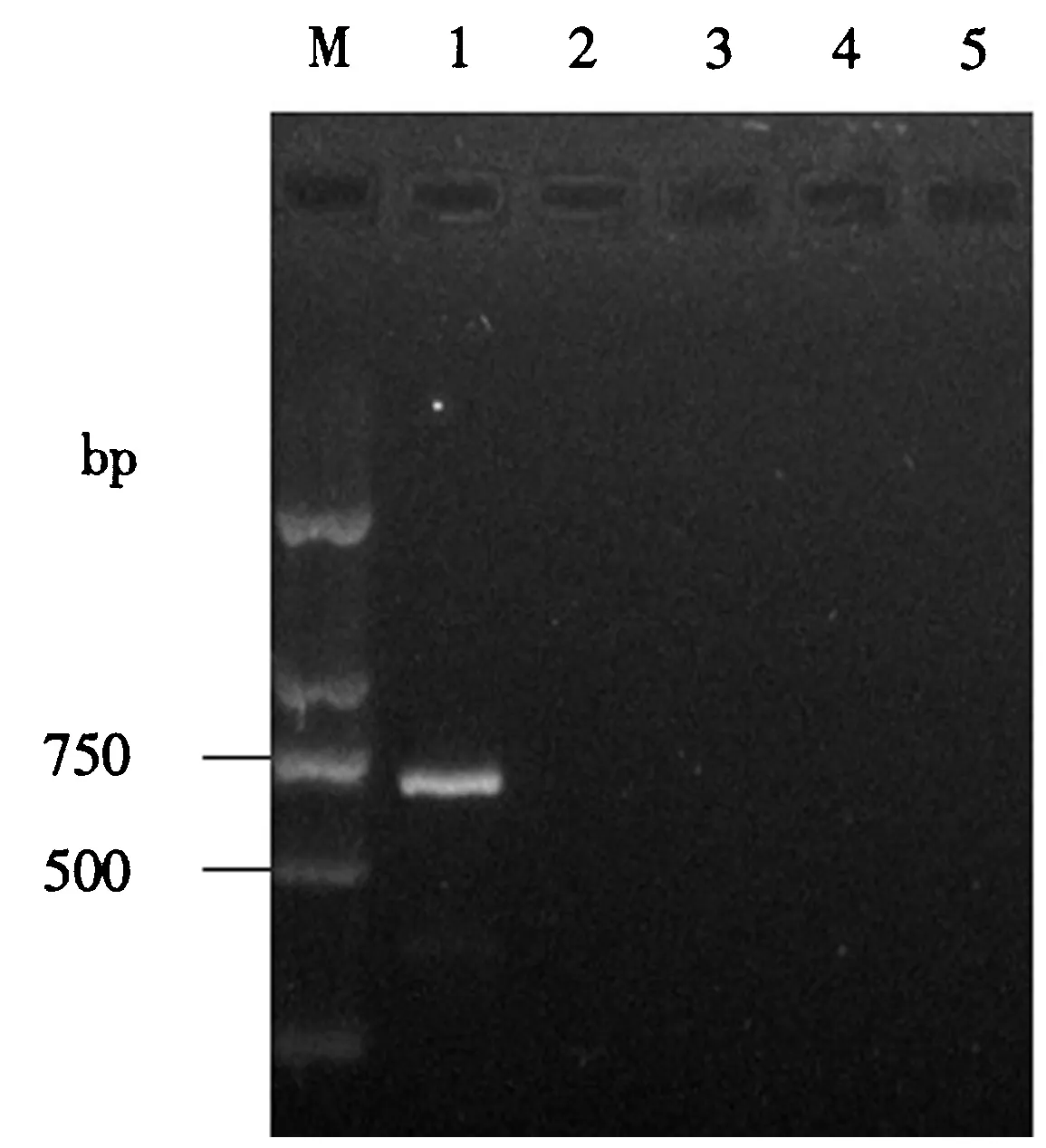
M:DNA分子质量标准;1:PCV2;2:CFV;3:PR;4:PRRSV;5:PEDV.图1 PCR特异性试验结果Fig.1 The result of PCR specific test
用oligo7设计的引物,PCV2-702能够扩增与预期相符合的条带.以猪瘟病毒(CFV),伪狂犬病毒(PR),蓝耳病毒(PRRSV),流行性腹泻(PEDV)的DNA或cDNA为模板,分别进行PCR扩增后进行凝胶电泳,并未见明显扩增条带(图1).
2.2 PCR反应体系的优化结果
退火温度的优化结果表明,退火温度为58 ℃时,PCR产物无杂带(图2A).模板量的优化结果表明,模板量为2 μL时,PCR产物与大于2 μL时的亮度差异不显著(图2B).循环数的优化结果表明,循环数为35个循环时,PCR产物与40个循环的亮度差异不显著(图2C).因此,PCR的反应体系25 μL,模板2 μL,Eeay Taq Mix 12.5 μL,上、下游引物各1 μL,ddH2O 8.5 μL.PCR反应条件:95 ℃变性5 min,95 ℃变性30 s,退火58 ℃ 30 s,72 ℃延伸30 s, 35个循环,72 ℃延伸10 min为最优化的PCR反应体系.测序结果的遗传进化树和同源性分析结果表明,该引物的扩增产物正确(图3).

A:退火温度优化PCR试验结果(M:DNA分子质量标准;1:50 ℃,2:52 ℃,3:54 ℃,4:56 ℃,5:58 ℃);B:模板量优化PCR试验结果(M:DNA分子质量标准;1:1 μL;2:1.5 μL;3:2 μL;4:2.5 μL;5: 3 μL;6:3.5 μL);C:循环数优化PCR试验结果(M:DNA分子质量标准;1:25个循环;2:30个循环;3:35个循环;4:40个循环).图2 PCR反应的优化结果Fig.2 Optimization results of PCR reaction

图3 测序基因遗传进化树Fig.3 Sequenced genetic evolution tree
2.3 PCR产物的RFLP
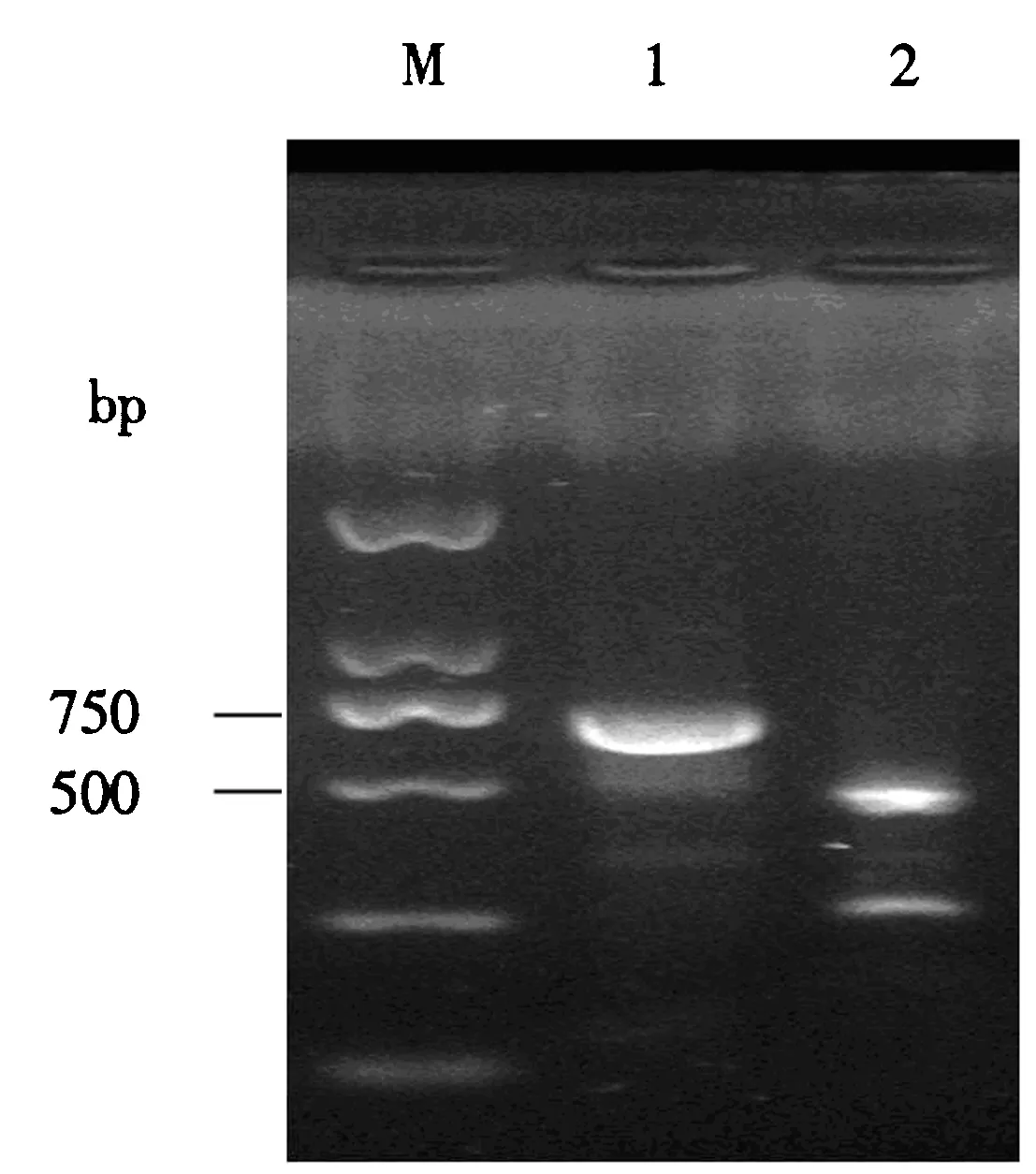
M:DNA分子质量标准;1:PCV-2d基因型的PCR产物未酶切;2:PCV-2d基因型的PCR产物酶切.图4 PCR产物酶切结果Fig.4 Enzyme digestion result of PCR product
用MSPI限制性内切酶对PCV-2d基因型的PCR产物进行酶切.结果表明,PCV-2d型病毒可被酶切出2个条带,且与预期的酶切片段长度符合(图4).
2.4 PCR-RFLP体系酶量、酶切时间条件优化结果
PCR-RFLP酶量的优化结果表明,当酶量为1.0、1.5、2 μL时,条带亮度差异不显著(图5A);酶切时间的优化结果表明,当酶切时间为1 h时,条带亮度最为明显(图5B).由此可见酶切体系12.5 μL,PCR产物8 μL,MSPI 1 μL,10×Cut Buffer 1.5 μL,ddH2O 2 μL.酶切时间1 h为最优化的PCR-RFLP的反应体系.
2.5 敏感性、重复性酶切的PCR-RFLP分析结果
PCV-2d敏感性的PCR-RFLP结果表明,重复性的的PCR-RFLP结果表明,PCV2d的PCR-RFLP重复性好(图6A).当DNA稀释倍数为100倍时,仍能有酶切结果,100倍以上的稀释梯度则看不到酶切结果(图6B).
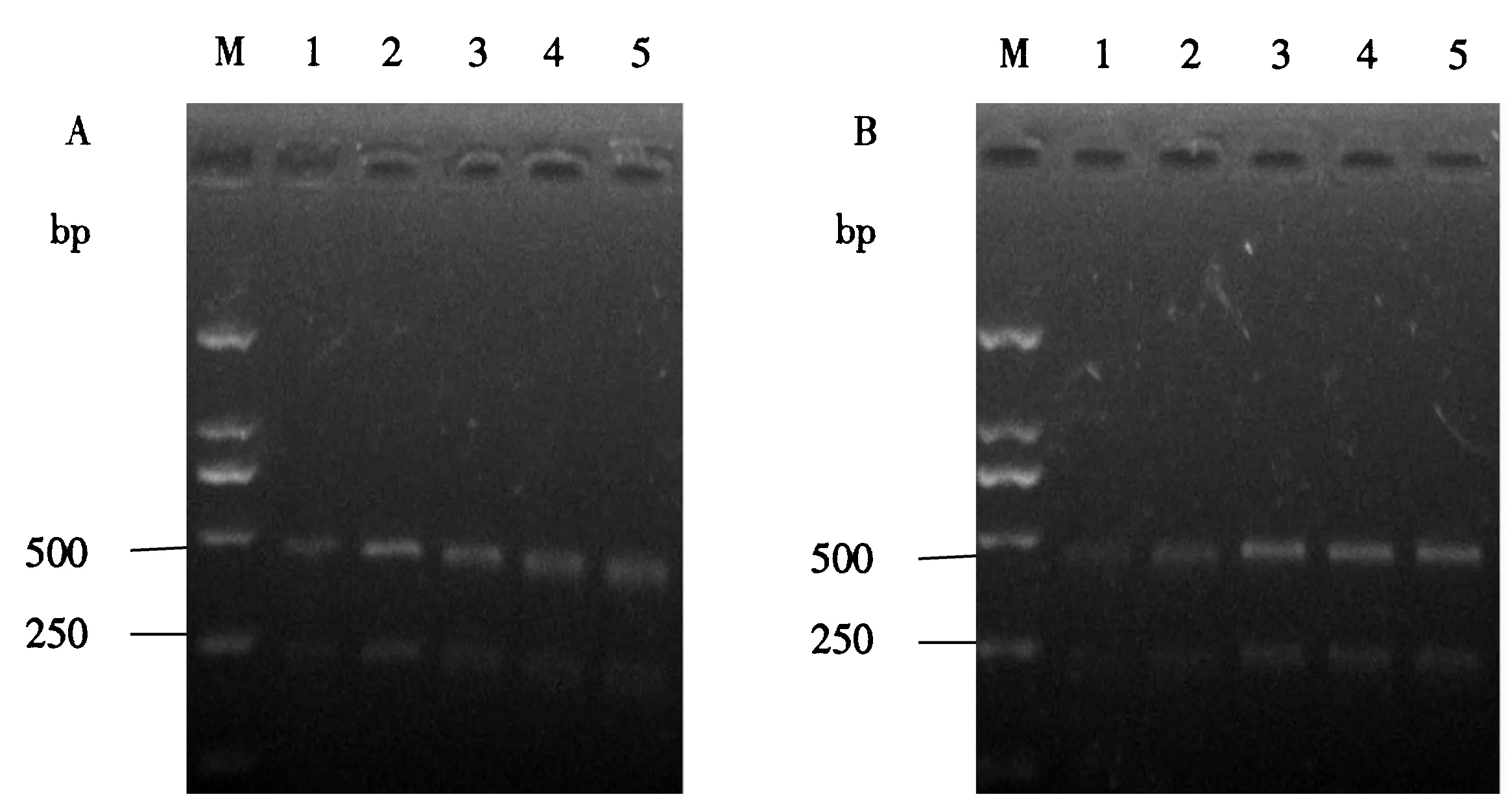
A:PCR-RFLP体系酶量的条件优化电泳图(M:DNA分子质量标准;1:MSPI 0.25 μL;2:MSPI 0.5 μL;3:MSPI 1 μL;4:MSPI 1.5 μL;5:MSPI 2 μL);B:PCR-RFLP体系酶切时间的条件优化电泳图(M:DNA分子质量标准;1:酶切0.5 h;2:酶切1 h;3:酶切1.5 h;4:酶切时间2 h;5:酶切时间2.5 h).图5 PCR-RFLP体系优化结果Fig.5 Optimization results of PCR-RFLP
2.6 敏感性、重复性酶切的PCR-RFLP分析结果
临床送检的确定为PCV2的24份病料,能被MSPI酶切的有8份,PCV-2d阳性率为33.3%(图7).

A:PCR-RFLP的重复性电泳图(M:DNA分子质量标准;1、3、5:MSPI酶切;2、4、6:未用酶切);B:PCR-RFLP的敏感性分析电泳图(M:DNA分子质量标准;1:DNA为原浓度;2:DNA稀释10倍;3:DNA稀释102倍;4:DNA稀释103倍;5:DNA稀释104倍;6:DNA稀释105倍;7:DNA稀释106倍).图6 敏感性、重复性试验结果Fig.6 Specificity and sensitivity test results

M:DNA分子质量标准;1:-24:临床待测样品.图7 临床样品的检测结果Fig.7 Test results of clinical samples
3 讨论
2000年以来,郎洪武首次报道国内PCV2的存在,该病毒引起的相关疾病严重影响了猪群的健康,给养猪业造成严重的经济损失[13].2006年,我国爆发的无名高热也与PCV2的感染有关[14].不同地区的流行病学调查显示,浙江省及周边地区2007至2012的PCV2阳性检出率为41.4%;山西2010—2012年PCV2阳性检出率为56.98%;而广西在2012—2015年的PCV2的阳性率达50.7%[15-17].以上的数据表明PCV2感染严重影响着我国不同地区的养猪业.目前,并未见PCV2有发生明显变异的相关报道,但同一地区存在多种血清型并不鲜见.当前,市面上流通的PCV2疫苗的均为2 a基因型的灭活苗或亚单位疫苗[18].有研究表明,PCV-2a可以与PCV2b产生交叉保护,但PCV-2a并不能为PCV-2d提供完全保护[12].因此在临床上,出现猪群免疫了疫苗却还是发病的情况,这可能与发病基因型和注射疫苗的基因型不符合有关.可见PCV2基因型的诊断显得尤为重要.
本研究利用PCR-RFLP方法,并通过不同的限制性内切酶的配合使用,可对现在流行的PCV-2d基因型进行鉴别,操作简便、可靠.PCR-RFLP技术是在PCR技术基础上发展起来的,是分子生物学的重要分析方法之一.1980年DAVID et al[19]建立了限制性片段长度多态分析方法,该方法能够对某些核酸序列进行切割,使其核酸分成若干个片段.本研究利用PCR-RFLP技术对PCV-2a、PCV-2b和PCV-2d进行酶切分析,根据酶切产生的片段的不同,从而鉴别PCV2d的基因型.通过设计针对PCV2的特异性引物,并对PCR-RFLP反应体系和反应条件进行了优化,建立了能够进行快速、准确鉴别PCV2d基因型的检测方法.该鉴别方法,对于进一步研究PCV-2d的流行情况,致病机理,防控措施具有重要的意义.
