陕西茯茶中“金花菌”的ITS序列特性分析
2018-07-12吕嘉枥孟雁南史朝烨
吕嘉枥, 孟雁南, 史朝烨, 罗 潇
(陕西科技大学 食品与生物工程学院, 陕西 西安 710021)
0 引言
金花菌是产生有性型,即子囊孢子阶段和无性型,即分生孢子阶段的多型真菌[1,2],是茯砖茶中的优势菌群,能在茯砖茶内部产生大量肉眼可见的金黄色颗粒[3],是该菌在茯砖茶中产生的有性闭囊壳,俗称金花,对茯砖茶风味的形成具有重要作用[4],金花菌的数量也是衡量茯砖茶品质的重要依据.
自1990年齐祖同将冠突散囊菌正式命名后[1],研究者对不同茯砖茶来源的“金花菌”进行了分类鉴定.黄浩等[5,6]根据菌落菌体形态特征和ITS序列分析将散茶发花中金花菌鉴定为冠突散囊菌(Eurotiumcristatum),无性型为针刺曲霉(AspergillusspiculosusBlaser).
而近年来的研究发现,茯砖茶中的金花菌具有多样性[7],是由一群形态特征相似、生理生化相近的菌群组成.胡治远等[8]对湖南地区茯砖茶样中的金花菌进行分离鉴定发现其中金花菌有冠突散囊菌、谢瓦散囊菌、肋状散囊菌、阿姆斯特丹散囊菌和蜡叶散囊菌,之后又首次提出茯砖茶中的冠突散囊菌具有遗传多样性[9];随后,王晗等[10]对散囊菌的NRPS保守基因进行聚类研究分析时发现不同冠突散囊菌中的NRPS基因分布和基因数呈现出比较多样的变化,进一步说明了冠突散囊菌具有遗传差异;王文涛等[11]认为散囊菌形态上的较大差异可能是由ITS序列变化引起,也有可能是由NRPS基因引起.
早期对茯砖茶中金花菌的鉴定主要是通过比较子囊孢子和分生孢子的特征,但金花菌的形态特征复杂,不同种之间仅有微小的差别,很难根据形态差异将茯砖茶中的金花菌鉴定至种.本研究拟通过对茯砖茶中分离得到的金花菌进行ITS序列特性分析,为茯砖茶中金花菌的鉴定提供一定理论依据.
1 材料与方法
1.1 实验菌种
M1:冠突散囊菌(Eurotiumcristatum) CICC2 650,购于中国工业微生物菌种保藏管理中心;
M2~M7:由陕西科技大学微生物研究室从陕西所产茯砖茶中分离纯化得到.
1.2 主要培养基组成
改良察氏培养基(CZG):蔗糖 4.0 g,NaCl 5.0 g,K2HPO40.1 g,NH4NO30.3 g,MgSO4·7H2O 0.05 g,琼脂 2.0 g,水 100 mL ,于 121 ℃、1×105Pa 灭菌锅中灭菌 30 min.
1.3 仪器与设备
3730XL测序仪,Applied Biosystems;2720 thermal cycler型PCR仪,Applied Biosystems;5810R板式离心机,Eppendorf;JY04S-3C凝胶成像装置,北京君意东方电泳设备有限公司;JY300C Power Supply电泳仪,北京君意东方电泳设备有限公司.
1.4 实验方法
1.4.1菌株的菌落形态观察
将保存在斜面管中的7株菌株活化24 h,分别接种于CZG培养基,置于28 ℃下培养,每天观察和测量各菌株菌落形态、生长速度及菌落直径.
1.4.2被检菌株的预处理
用已灭过菌的接种铲将CZG培养基上生长的“金花菌”菌丝体刮下,置于1.5 mL无菌离心管中待用.
1.4.3基因组DNA提取
采用擎科货号为TSP101植物基因组DNA提取试剂盒进行金花菌DNA提取.具体方法如下:
取50 mg新鲜菌丝体置于无菌研钵中,加入液氮迅速将菌丝研磨成粉末;将研磨好的菌丝体迅速置于1.5 mL离心管中,加入400μL GP1缓冲液,涡旋振荡1 min,65 ℃水浴10 ~ 30 min,水浴过程中每隔5 min取出颠倒混匀以充分裂解;加入150μL GP2缓冲液,涡旋振荡1 min,冰浴5 min,12 000 rpm离心 5 min;将上清转移至新的离心管中,加入上清等体积的无水乙醇,立即充分振荡混匀,液体全部转入吸附柱中,12 000 rpm离心30 s,弃废液;向吸附柱中加入500μL 缓冲液PW, 12 000 rpm离心30 s,弃废液,将吸附柱放入收集管中;向吸附柱中加入500μL 漂洗液,12 000 rpm离心30 s,弃废液,将吸附柱放入收集管中;重复两次后将吸附柱放回收集管中,12 000 rpm离心2 min,弃废液后将吸附柱在室温条件下放置5~10 min,彻底晾干吸附材料中残余的漂洗液;取出核酸纯化柱,放入一个干净的离心管中,在吸附膜的中央处加入65 ℃预热的TE缓冲液100μL,室温放置2~5 min,使DNA尽可能多得被洗脱,12 000 rpm离心2 min,将溶液收集到离心管中,-20 ℃保存.
1.4.4PCR扩增
采用真菌核糖体基因通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)为引物,使用2×TsingKEMasterMix(CodeNo.:TSE003)体系进行PCR扩增,同时以dH2O做负对照.反应体系如表1所示.
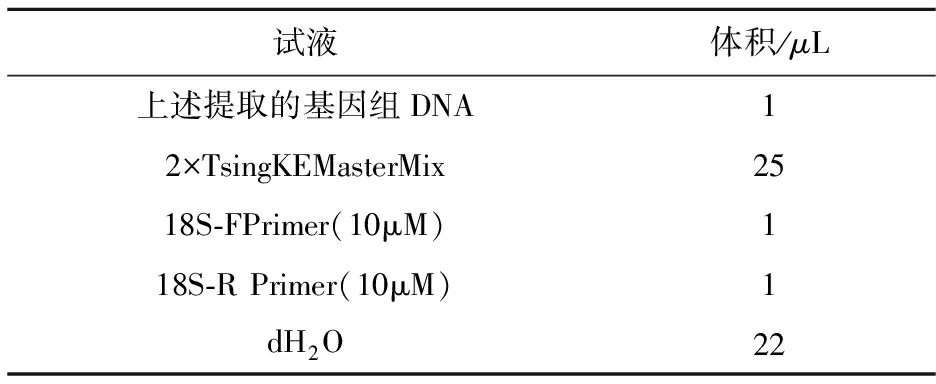
表1 PCR扩增反应体系
扩增条件为:94 ℃预变性5 min,94 ℃变性30 s,50 ℃退火30 s,72 ℃延伸1 min,循环30次,最后72 ℃延伸10 min后得PCR产物,扩增成功的PCR产物,用琼脂糖凝胶回收试剂盒回收.
1.4.5PCR产物纯化
PCR扩增的产物进行1.2%琼脂糖凝胶电泳,电压160 V,上样2μL,采用溴化乙锭(EB)染色,凝胶成像仪中采集图像,图像必须保证条带清晰.之后将扩增成功的PCR产物进行序列分析.
1.4.6序列测定
采用BigDyeTerminator v3.1试剂盒进行一代测序反应及纯化,反应体系如表2所示.

表2 测序反应体系
测序PCR热循环条件为:96 ℃,2 min→(96 ℃,10 sec→50 ℃,10 sec→60 ℃,3 min)×30 cylce→4 ℃保温.之后使用3730XL测序仪测定序列并收集测定数据.
1.4.7系统发育树的构建
将所测得的序列提交到NCBI数据库中进行同源性比对,将同源性较高的序列利用生物分析软件Mega对序列进行分析,并构建序列系统发育树.
2 结果与讨论
2.1 菌落形态特征
7株菌的菌落形态特征如图1所示.对7株菌的形态学进行鉴定时发现,7株菌在菌落形态上差异明显, M2和M5菌株产生灰绿色分生孢子较多,无性繁殖特征较易出现,但M5在培养过程中菌落大小变化不大,菌落背面有褶皱;其余五株菌较易产生金黄色闭囊壳,M3、M4、M7与标准菌株M1形态学相似,在培养过程中菌落颜色加深,由浅黄色逐渐变为橙红色,而M6菌落颜色一直为橄榄黄色.
根据《中国真菌志》[12],并结合形态学将M2、M5初步鉴定为谢瓦曲霉(Aspergilluschevalieri),M1、M3、M4、M7初步鉴定为冠突散囊菌(Eurotiumcristatum),无性型为针刺曲霉(Aspergillusspiculosus),M6初步鉴定为阿姆斯特丹曲霉(Aspergillusamstelodami).
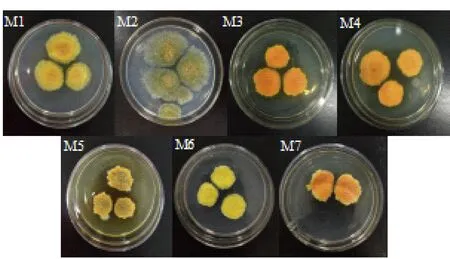
图1 7株菌的菌落形态特征
2.2 ITS区域的PCR扩增
利用试剂盒法提取7株菌的DNA,将提取出的基因组DNA作为模板,以ITS1和ITS4作为引物,进行PCR扩增,扩增产物经1.2%的琼脂糖凝胶电泳检测,结果如图2所示.由图2可以看出,七株菌的PCR产物始终只有一条条带出现,且位于同一水平线上,无拖尾现象出现,电泳条带较为清晰明亮,易于判别,说明提取的DNA是目的条带.所有的条带都在500 bp左右,差异不大.
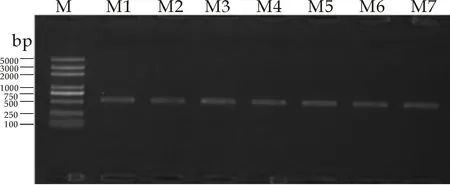
图2 7株菌的ITS-PCR产物电泳图
2.3 ITS序列分析
从茯砖茶中分离出的6株菌M2~M7的基因序列测定结果如下,6株菌株与标准菌株M1的分子序列完全相同,从分子序列可以看出七株菌实属同种.
M1-M7 ITS序列:
AGGATCATTACCGAGTGCGGGCCCTCTGGG
TCCAACCTCCCATCCGTGTCTATCTGTACC
CTGTTGCTTCGGCGTGGCCACGGCCCGCC
GGAGACTAACATTTGAACGCTGTCTGAAG
TTTGCAGTCTGAGTTTTTAGTTAAACAAT
CGTTAAAACTTTCAACAACGGATCTCTT
GGTTCCGGCATCGATGAAGAACGCAGCGA
AATGCGATAATTAATGTGAATTGCAGAAT
TCAGTGAATCATCGAGTCTTTGAACGCA
CATTGCGCCCCCTGGTATTCCGGGGGGCA
TGCCTGTCCGAGCGTCATTGCTGCCCTC
AAGCACGGCTTGTGTGTTGGGCTTCCGT
CCCTGGCAACGGGGACGGGCCCAAAAG
GCAGTGGCGGCACCATGTCTGGTCCTCG
AGCGTATGGGGCTTTGTCACCCGCTCC
CGTAGGTCCAGCTGGCAGCTAGCCTCGC
AACCAATCTTTTTAACCAGGTTGACCT
CGGATCAGGTAGGGATACCCGCTGAACT
TAAGCAT
2.4 ITS序列比对结果分析
将所测得的基因序列通过对18S rDNA ITS区域测序并在美国国家生物技术信息中心(National center ofbiotecllIlology infomation,NCBI)比对鉴定ITS区域,测序结果在NCBI数据库中进行Nucleotide blast比对及同源性搜索,菌株M1~M7 ITS片段为518 bp,与数据库中针刺曲霉、阿姆斯特丹曲霉、谢瓦曲霉ITS序列相似度均达到99.99%,比较结果如表3所示.

表3 ITS序列比对结果
由表3可以看出,陕西茯砖茶中的金花菌可能为针刺曲霉、阿姆斯特丹曲霉、谢瓦曲霉中的一种.以ITS序列对金花菌进行分离鉴定具有很大的不确定性,只能通过ITS将茯砖茶中的金花菌鉴定为曲霉属,具体是哪个种,还需进行进一步的鉴定.赵仁亮等[13]基于rDNA-ITS序列对茯砖茶中分离金花菌进行鉴定时也发现分离到的金花菌与属内多个种的同源性均在99%以上.郭鹏豪等[14]研究发现阿姆斯特丹散囊菌和冠突散囊菌由于ITS序列的高度同源性无法区分鉴定到种.
2.5 ITS聚类分析
综合同源性比对结果,选择已知分类地位的菌株,并以橘青霉(Penicilliumcitrinum)、黑曲霉(Aspergillusniger)作为外源群,应用MEGA5软件中Phylogeny程序绘制系统发育树图.由图3可知,与7株“金花”菌同源性最高的已知分类地位的菌株为曲霉属.且7株菌与已知分类地位的不同种菌均聚为一枝,因此,由构建的整个系统发育树分析,从茯砖茶样中分离获得的7株“金花”菌均属于曲霉属曲霉组,即散囊菌属.
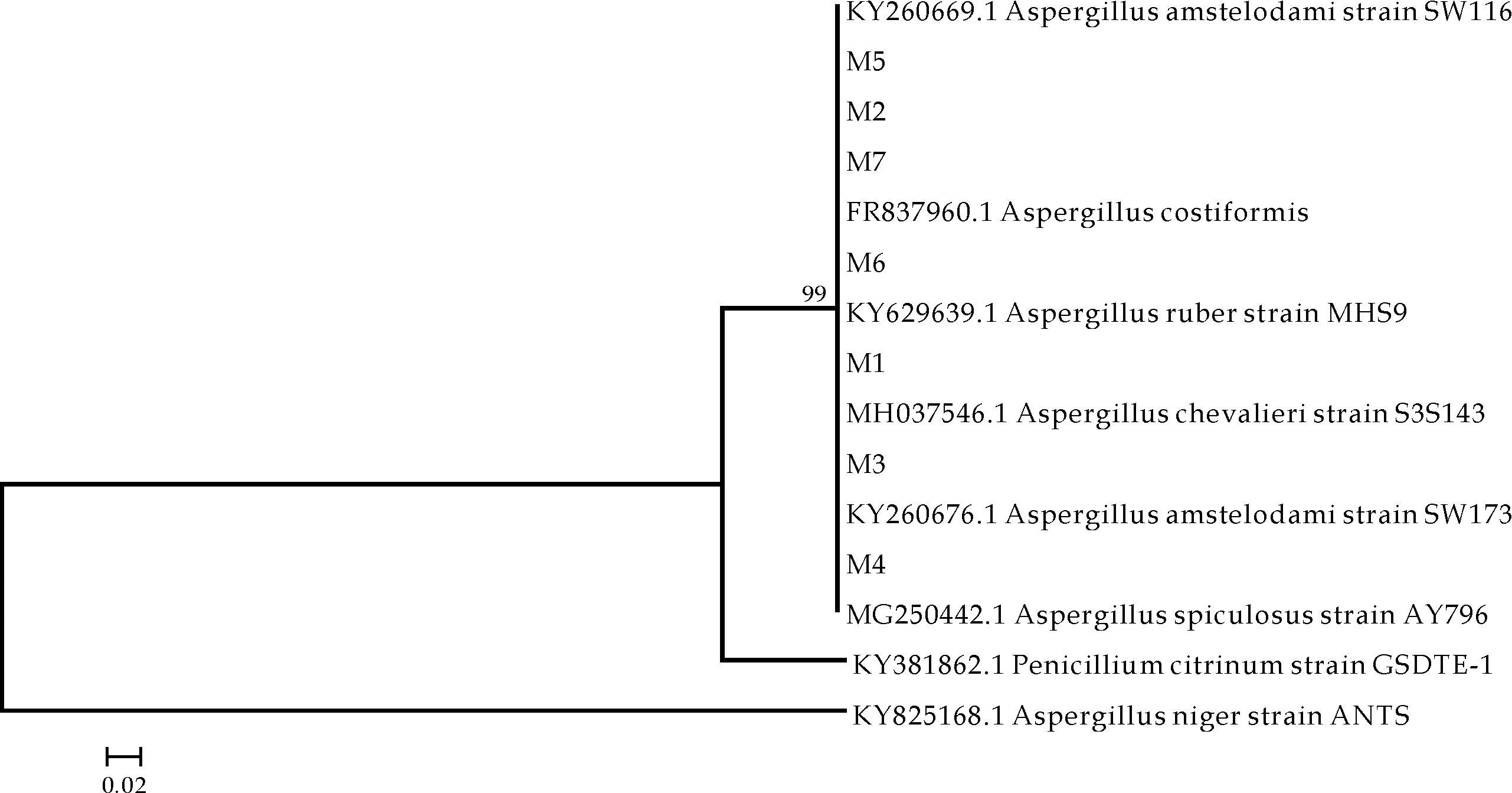
图3 7株“金花”菌基于ITS基因序列构建的系统发育树
由此也可说明,虽然ITS区域因其“种内保守,种间变异”的特征而广泛应用于真菌分类鉴定[15],但其鉴定能力在不同种属间是存在差异的.Stephen W.Peterson[16]根据形态学特征将13个曲霉属下种进行鉴定后,利用ITS序列及MLST对其进一步鉴定发现:曲霉属真菌的ITS序列并不总是唯一识别属种,有的不同种曲霉ITS序列相同,而有的同种曲霉却具有多种ITS基因型,但其MLST基因型在种间不重叠,可将13个曲霉鉴定至种;何亚涛等[17]基于NCBI单基因ITS序列在属一级水平对散囊菌目系统发育进行了较为全面的研究,结果发现单基因 ITS序列的分析结果与散囊菌目的4个科的分类结果并不完全一致;李颖等[18]研究发现内转录间隔区对曲霉的种水平鉴定率要低于形态学方法,只能鉴定到曲霉属或曲霉某种,绝大多数无法鉴定菌株.
3 结论
本研究从陕西茯砖茶中分离得到的6株菌在形态上差异较为明显,且3株菌与冠突散囊菌标准菌株形态一致,根据《中国真菌志》,并结合形态学,初步将M2、M5鉴定为谢瓦曲霉,M1、M3、M4、M7鉴定为针刺曲霉,M6鉴定为阿姆斯特丹曲霉.7株菌PCR产物的电泳条带均处于同一水平线上,分子量大小均为500 bp,差异不大,且7株菌的ITS序列一致,与NCBI中Aspergillusspiculosus、Aspergillusamstelodami、Aspergilluschevalieri的同源性均较高,根据分子生物学和形态学鉴定结果,陕西茯砖茶中分离得到的6株菌可能为针刺曲霉、阿姆斯特丹曲霉、谢瓦曲霉的一种.由此可以看出,ITS序列对金花菌进行分离鉴定与形态学鉴定结果较为一致,但只能通过ITS将茯砖茶中的金花菌鉴定为曲霉属,在属以下的种分辨率不高.
综上所述,茯砖茶中的金花菌在形态学方面差异较大,但经ITS序列分析之后发现其实属同一种,故而判断:
(1)尽管不同来源的“金花”菌最终被鉴定为同种,但其形态特征还是存在差异,可能茯砖茶中的金花菌存在亚种或变种;
(2)散囊菌属真菌中rDNA基因的ITS1和ITS4保守区可用于区分属间以及部分种间差别,而不能很好地反映菌株乃至某些菌种之间的遗传多样性.若需进一步得到种水平信息,则应结合分辨能力更高的基因进一步鉴定,如可选择转录组水平的β-微管蛋白基因、钙调节蛋白基因等,或者可以进行多基因系统发育分析或全基因分析.
