β-环糊精对黄曲霉毒素B1的荧光增敏效应研究
2018-07-12易建华宁建琴宋宏新吴丹丹卫梦绮李亚俊
易建华, 宁建琴, 宋宏新, 郭 芮, 徐 丹, 吴丹丹, 卫梦绮, 李亚俊
(陕西科技大学 食品与生物工程学院, 陕西 西安 710021)
0 引言
AFB1是黄曲霉、寄生曲霉等产毒菌株分泌的强致癌性真菌毒素,已被国际癌症研究机构(IARC)定为Ⅰ类致癌物[1].为保障公众健康,食品安全相关监管机构必须要对食品与饲料中AFB1含量进行监测与控制.目前AFB1常用的检测方法有免疫分析法、仪器分析法,其中免疫分析法简便、快速,但容易出现假阳性;而仪器分析法虽然准确,但普通人较难掌握,因此急需开发一些简便、准确、灵敏的检测技术.AFB1具有荧光性,可根据这一特性开发新型检测方法,但AFB1在溶剂中易发生荧光猝灭现象,导致检测灵敏度降低,只有增强其荧光强度才能提高检测灵敏度.研究发现AFB1、黄曲霉毒素Q1、姜黄素、阿霉素等弱极性化合物能进入β-CD的空腔内形成包合物.包合物的形成既增大了弱极性化合物的溶解性,又避免了溶剂对这些物质的荧光猝灭作用,使其荧光性大大增强[2-10].因此,本实验拟研究影响β-CD增强AFB1荧光强度的因素,并且通过Benesi-Hildebrand法、热力学方法分析包合物的包合特性,为食品中AFB1高灵敏检测方法的建立提供理论支持.
1 材料与方法
1.1 材料与试剂
Costar 96微孔板,美国康宁公司;AFB1标准品,美国sigma公司;β-CD(分析纯),天津科密欧化学试剂有限公司;甲醇、乙醇、正丙醇、异丙醇、正丁醇均为分析纯,天津天力化学试剂有限公司.
1.2 仪器与设备
Varioskan Flash全波长扫描式多功能读数仪,赛默飞世尔科技公司;数控超声波清洗器(KQ-250DE),昆山市超声仪器有限公司.
1.3 实验方法
1.3.1不同因素对β-CD增强AFB1荧光强度的影响
(1)β-CD浓度对β-CD增强AFB1荧光强度的影响
取40μL 500μg/L AFB1标准液于微孔板中,分别加入160μL浓度为2.0×10-2、1.5×10-2、1.25×10-2、1.0×10-2、5.0×10-3、2.5×10-3、1.0×10-3、5.0×10-4mol/L的β-CD溶液,混匀放置1 min,于激发波长365 nm,发射波长440 nm,狭缝5 nm条件下测定AFB1荧光强度,并每隔10 min测定一次,分析包合物稳定性,同时做只含AFB1标准品的试验,每组平行3次.
(2)温度对β-CD增强AFB1荧光强度的影响
按章节1.3.1中(1)所述制备AFB1-β-CD包合物,分别在20 ℃、25 ℃、30 ℃、35 ℃、40 ℃、45 ℃下孵育5 min,于激发波长365 nm,发射波长440 nm,狭缝5 nm条件下测定AFB1荧光强度,同时做只含AFB1标准品的试验,每组平行3次.
(3)金属离子对β-CD增强AFB1荧光性的影响
取40μL 500μg/L AFB1标准液于微孔板中,分别加入160μL 含0.5×10-2mol/L HgCl2、NaCl、KCl、MgCl2、FeCl3、CaCl2的β-CD溶液(β-CD溶液浓度为1.0×10-2mol/L),于激发波长365 nm,发射波长440 nm,狭缝5 nm条件下测定AFB1荧光强度,同时做不加金属离子的对照试验和只含AFB1标准品的试验,每组平行3次.
(4)pH对β-CD增强AFB1荧光性的影响
取40μL 500μg/L AFB1标准液于微孔板中,分别加入160μL pH为5、6、7、8的β-CD溶液(β-CD溶液浓度为1.0×10-2mol/L),于激发波长365 nm,发射波长440 nm,狭缝5 nm条件下测定AFB1荧光强度,同时做不调pH的对照试验和只含AFB1标准品的试验,每组平行3次.
(5)脂肪醇对β-CD增强AFB1荧光性的影响
取40μL 500μg/L AFB1标准液于微孔板中,分别加入80μL 甲醇、乙醇、正丙醇、异丙醇、正丁醇,然后每孔再加入80μL的β-CD溶液(β-CD溶液浓度为1.0×10-2mol/L),于激发波长365 nm,发射波长440 nm,狭缝5 nm条件下测定AFB1荧光强度,同时做不加脂肪醇的对照试验和只含AFB1标准品的试验,每组平行3次.
(6)超声时间对β-CD增强AFB1荧光性的影响
将40μL 500μg/L AFB1标准液与160μL 1.0×10-2mol/L的β-CD溶液混合,分别超声1 min、5 min、10 min、15 min、20 min、25 min、30 min、35 min、40 min、45 min,于激发波长365 nm,发射波长440 nm,狭缝5 nm条件下测定AFB1荧光强度,同时做不超声的对照试验和只含AFB1标准品的试验,每组平行3次.
1.3.2AFB1-β-CD包合物的特性研究[11]
(1)AFB1-β-CD包合物包合比及包合常数的测定
结合章节1.3.1中(1)的实验结果,根据改进的Benesi-Hildebrand方程计算包合比和包合常数:
[AFB1]/(F-F0)=1/[β-CD]·K·α+1/α
(1)
式(1)中:F0和F分别为加入β-CD前后溶液的荧光强度;α为常数;[AFB1]和[β-CD]分别为AFB1和β-CD的总浓度;K是包合常数.
(2)AFB1与β-CD包合反应热力学常数的测定
结合章节1.3.1中(2)的实验结果,根据范德霍夫方程lnK=-ΔH/RT+ΔS/R,以各温度条件下的lnK对温度的倒数(1/T)进行线性回归,根据直线的斜率和截距可求得包合物形成过程中的热力学参数:ΔH和ΔS;再根据热力学定律:ΔH=ΔG+TΔS,可求得包合反应的ΔG,R为气体常数,约为8.314 J/(mol·K).
1.4 数据处理
实验所得数据采用OriginPro 8.0软件进行处理与分析.
2 结果与讨论
2.1 β-CD浓度对AFB1荧光增强的影响
添加不同浓度β-CD后,AFB1荧光强度显著增大,如图1所示,随着β-CD浓度的增加,AFB1荧光强度逐渐增大.AFB1在疏水作用、范德华力、氢键等非共价键的作用下,进入β-CD的空腔中,避免了与溶剂分子的碰撞,降低了荧光的猝灭.当β-CD浓度为1.0×10-2mol/L时AFB1荧光增强效果最明显,增强倍数最大,达到5.99倍;而β-CD浓度大于1.0×10-2mol/L时,增强作用略有降低并趋于平衡,因此为达到最大的荧光增敏效果,应将β-CD浓度调整为1.0×10-2mol/L.

图1 不同浓度β-CD对AFB1荧光强度的影响
2.2 不同浓度β-CD下AFB1荧光增强作用稳定性
AFB1与β-CD超分子体系荧光的稳定性如图2所示.虽然放置时间延长,但超分子体系的荧光强度基本未改变,这与前人研究结果一致,说明AFB1溶液中加入不同浓度的β-CD后,二者能够快速反应形成包合物,且所生成的包合物在长时间内能保持稳定;如张敏等[6,11]研究发现室温条件下AFB1与β-CD混合摇匀放置1 min荧光强度即可稳定,且长时间内保持稳定.

图2 β-CD-AFB1包合物的稳定性
2.3 不同温度对AFB1-β-CD荧光强度的影响
温度对包合反应的影响如图3所示.加入不同浓度的β-CD后,随着温度的逐渐升高,β-CD对AFB1荧光强度的增敏作用逐渐降低,数据显示下降了16.4%~45.26%,说明室温条件有利于包合反应的进行.张敏等[11]、马良等[12]通过对β-CD与AFB1、AFG1包合反应的热力学研究,发现该反应是一个放热反应,低温利于包合物形成.因此为达到最大的荧光增敏效果,应将包合温度设定为20 ℃~25 ℃.
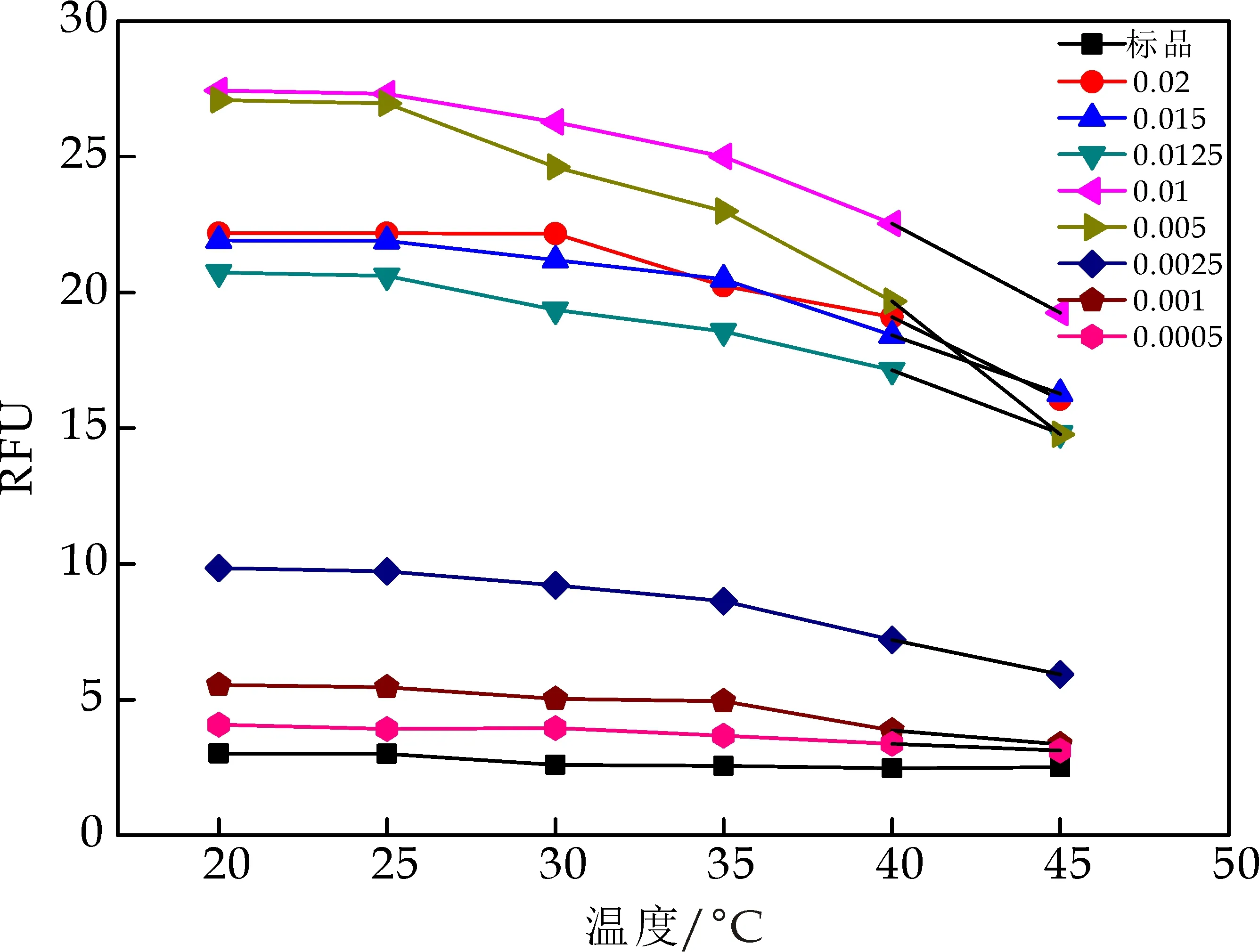
图3 温度对AFB1-β-CD包合物荧光强度的影响
2.4 不同金属离子对AFB1-β-CD荧光增强效应的影响
金属离子在不同程度上会影响β-CD增强AFB1荧光强度的效果,如图4所示.Fe3+、Mg2+、K+、Na+、Ca2+减弱了荧光增强的作用,其中以Fe3+的减弱作用最大;而Hg2+对β-CD增敏AFB1荧光有协同作用,显著增强AFB1的荧光强度,同时发现Hg2+使AFB1的荧光光谱略红移,而其他金属离子基本未改变AFB1的荧光光谱.张敏等[6]发现Hg2+能够与AFB1形成金属螯合物,明显提高AFB1的荧光强度,分析可能是由于Hg属于过渡金属元素,易形成配位数为6的配合物,其几何构型通常是相当于6个配位原子占据八面体或变形八面体的角顶,增强了AFB1-Hg2+共轭平面,加大了刚性结构.因此为提高β-CD对AFB1荧光性的增强作用,应向反应体系添加Hg2+.

图4 不同金属离子对AFB1-β-CD体系荧光强度影响
2.5 pH对AFB1-β-CD荧光增强效应的影响
pH对AFB1-β-CD荧光增强效应的影响如图5所示.将超分子反应体系pH调整到5~8时,能增强β-CD对AFB1荧光增敏效果,使增强效果从6.58倍增加到7.83~8.17倍.这可能是由于用不同pH磷酸盐缓冲液配制AFB1和β-CD溶液,使得包合物体系中的离子强度增加,导致荧光增强效果略有增加.因此为达到最大的荧光增敏效果,应将反应体系pH调整为6.

图5 pH对AFB1-β-CD体系荧光强度影响
2.6 脂肪醇对AFB1-β-CD荧光增强效应的影响
超分子反应体系中加入脂肪醇后,会改变体系的微环境,影响β-CD对AFB1的荧光增敏效果.如图6所示,甲醇、乙醇、正丙醇、异丙醇对β-CD增强AFB1荧光强度的效果有促进作用,但正丁醇有减弱作用.在脂肪醇存在下,AFB1荧光光谱蓝移,说明电子跃迁的能量增大,醇羟基能与环糊精端口形成氢键而减小其微环境的极性,使AFB1更容易进入环糊精腔中,醇分子的烷基链越长,形成氢键能力越大,使空腔微极性减小得越多,但由于正丁醇的空间位阻较大,使AFB1不能全部进入环糊精腔中,就已经封口,所以正丁醇具有减弱荧光增强效果的作用[13].因此为达到最大的荧光增敏效果,应向反应体系添加异丙醇,改变体系微环境.

图6 醇类物质对AFB1-β-CD体系荧光强度影响
2.7 超声对AFB1-β-CD荧光增强效应的影响
超声对AFB1-β-CD荧光增强效应的影响如图7所示.短时超声未影响β-CD对AFB1荧光强度的增敏作用,但随着超声时间的延长,体系的温度会逐渐上升,而温度升高不利于包合反应的进行,使β-CD对AFB1荧光增敏作用降低.
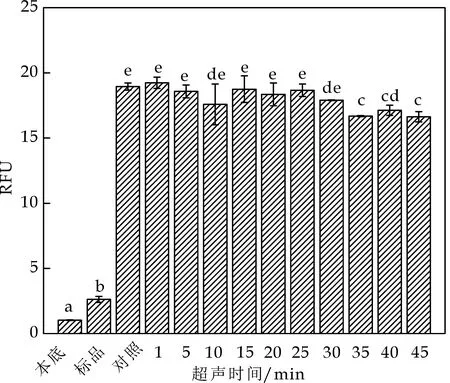
图7 超声对AFB1-β-CD体系荧光强度影响
2.8 AFB1-β-CD包合物的特性研究
根据改进的Benesi-Hildebrand方程计算包合比和包合常数,如图8所示.[AFB1]/(F-F0)对1/[β-CD]双倒数图呈线性关系,说明AFB1与β-CD只形成了1∶1包合;由双倒数图计算得到包合常数,如表1所示.
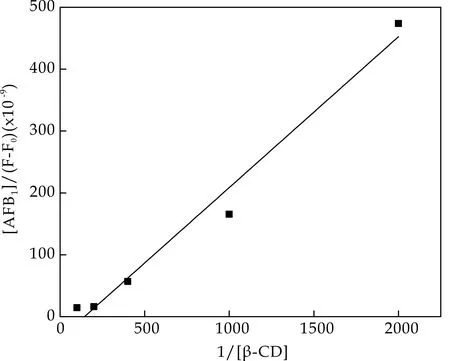
图8 AFB1-β-CD双倒数图

温度/K包合常数/(L/mol)ΔG/(kJ/mol)ΔH/(kJ/mol)ΔS/(kJ/mol)298.5303.7308.9314.13.68×1071.27×1076.95×1066.40×106-42.38-41.83-41.28-40.73-74.03-0.11
由表1可知,ΔS=-0.11 kJ/mol,ΔH=-74.03 kJ/mol,ΔG为-42.38 kJ/mol到-40.73 kJ/mol,且随着温度的升高,K值逐渐减小,说明包合物可能趋于离解,客体分子又从β-CD空腔内重新进入水相,包合物的稳定性降低.在本体系中,ΔG<0说明包合过程是一个自发的过程,ΔH<0说明反应是一个放热过程,ΔS<0说明分子几何形状引起的空间障碍,以及空腔对客体分子平移和旋转自由度的限制在包合过程中起着非常重要的作用[14];Amadasi等[15]利用计算氢键互做的HINT程序分析AFB1与β-CD的包合模型为:AFB1的部分呋喃环进入了腔体,芳香环伸向溶剂并靠近腔体边缘,使得AFB1的羧基与β-CD羟基形成氢键.
3 结论
β-CD对AFB1荧光增强作用受到很多因素的影响,其中β-CD浓度、温度、金属离子、脂肪醇和pH能显著影响AFB1-β-CD的荧光强度,而超声对该体系荧光强度影响不大,具体表现为:随着β-CD浓度增加,体系荧光强度逐渐增大然后略减小并保持恒定;随着温度升高,β-CD对AFB1荧光的增强作用逐渐减弱;Hg2+能提高体系荧光强度,而Fe3+、Mg2+、K+、Na+、Ca2+能减弱体系荧光强度;弱酸性条件和异丙醇的添加能显著增强体系荧光强度.β-CD对AFB1荧光增强的最佳条件:β-CD浓度为0.01 mol/L,异丙醇浓度为50 %(v/v),HgCl2浓度为0.5×10-2mol/L,反应体系pH为6,包合温度为25 ℃.AFB1与β-CD包合比为1∶1,包合常数K=3.68×107L/mol,包合过程的熵变ΔS=-0.11 kJ/mol、焓变ΔH=-74.03 kJ/mol及自由能变化ΔG=-42.38 kJ/mol,说明包合反应是放热反应且能自发进行,焓变是形成超分子包络物的主要驱动力.
