离子色谱-电化学法测定坎地沙坦酯药物中羟胺残留
2018-07-06周长朋李大栓
周长朋,刘 敏,李大栓,马 垒,许 洁
(迪沙药业集团有限公司,山东 威海 264205)
坎地沙坦酯(Candesartan cilexetil),化学名(±)-1-[[(环己氧代)羰基]氧代]乙基-2-乙氧基-1-[[2′-(1H-四氮唑基-5)-[1,1′-联苯基]-4-基]甲基]-1H-苯并咪唑-7-羧酸酯,是一种新型选择性血管紧张素Ⅱ受体(ATI)拮抗剂,可在体内迅速被水解成活性代谢物坎地沙坦,通过与血管平滑肌ATI受体结合而拮抗血管紧张素Ⅱ的血管收缩作用,从而降低末梢血管阻力[1-3]。研究表明[4-5],坎地沙坦酯在给药间隔中可呈剂量依赖性地降低高血压病人心舒张压和收缩压,降压作用持久、平稳,且耐受性良好,不良反应较小,可用于较广范围高血压病的治疗,具有较为广阔的市场前景和良好的实用性。
羟胺是一种还原剂,在坎地沙坦酯合成路线中主要用于还原某些氧化剂,但其对呼吸系统、皮肤、眼部及黏膜具有刺激性,且具有潜在的基因毒性,按照基因毒性杂质指导原则的要求[6],必须在生产过程中进行控制。目前,羟胺的检测方法主要有分光光度法[7-10]、气相色谱法[11]和离子色谱法[12-14],但分光光度法的灵敏度较低,气相色谱法测定时需进行衍生,样品处理方法较为复杂,且可能会对仪器产生一定的污染。离子色谱在检测阴阳离子时具有灵敏度高、重复性好、方便快捷等优势,已在药物领域内广泛应用[15-19]。本文基于离子色谱-电化学检测技术和羟胺的还原性质,建立了坎地沙坦酯药物中羟胺残留的测定方法,并采用固相萃取技术配制供试品溶液。该方法简单、快速,回收率好、灵敏度高,能够对低浓度的羟胺残留进行定性与定量分析,利于对坎地沙坦酯合成反应过程中羟胺的残留进行有效监测。
1 实验部分
1.1 仪器与试剂
ICS-5000离子色谱仪(美国ThermoFisher公司):配有电化学检测器;BT25S精密分析天平(精度:十万分之一,德国赛多利斯公司);Milli-Q超纯水仪(美国Millipore公司);OnGuard Ⅱ RP柱(2.5 mL,美国ThermoFisher公司)。
盐酸羟胺(纯度100%,中国食品药品检定研究院);铵离子标准溶液(1.0 g/L,国家有色金属及电子材料分析测试中心);甲磺酸(纯度99.5%,阿拉丁);50%氢氧化钠溶液(美国ThermoFisher公司);甲醇、乙腈(色谱级,德国Merck公司);二氯甲烷(色谱级,上海阿拉丁生化科技股份有限公司);实验用水为Milli-Q超纯水(电阻率为18.2 MΩ·cm);坎地沙坦酯药品(自制)。
1.2 溶液的制备
对照品溶液:精密称取盐酸羟胺适量于10 mL容量瓶中,用水溶解并定容,混匀后配制成含羟胺0.5 g/L的标准储备液,于4 ℃密封保存。取羟胺标准储备液适量,用30 mmol/L甲磺酸溶液配制成含羟胺0.15 mg/L的溶液,此溶液作为对照品溶液。
供试品溶液:准确称取坎地沙坦酯药品100 mg于20 mL具塞玻璃管中,加8 mL二氯甲烷溶解后再精密加入10 mL 30 mmol/L甲磺酸溶液,振荡30 s后静置分层,取上清液过OnGuard Ⅱ RP柱(先加10 mL甲醇活化,再加10 mL 30 mmol/L甲磺酸溶液活化)后再经0.22 μm滤膜过滤,即得。
系统适用性溶液:取羟胺标准储备液、铵离子标准溶液适量,用30 mmol/L甲磺酸溶液配制成分别含羟胺0.25 mg/L、铵离子1.0 mg/L的标准中间液,此溶液作为系统适用性溶液。
1.3 色谱条件
色谱柱:Ionpac CS16(250 mm×5 mm)阳离子交换色谱柱;流动相:30 mmol/L甲磺酸溶液,等度洗脱,流速:1.0 mL/min;检测器:电化学检测器,电极材料为金电极,参比电极为pH-Ag/AgCl复合电极,电极模式为pH,电位波形为氨基酸六电位;柱温40 ℃;进样体积25 μL。
2 结果与讨论
2.1 供试品溶液的配制
坎地沙坦酯易溶于二氯甲烷、甲醇、乙腈等有机溶剂,几乎不溶于水,可采用甲醇溶解样品后再加水定容,但坎地沙坦酯溶液会对色谱柱有一定的损伤。文献[14]将甲磺酸雷沙吉兰药物以甲磺酸溶液溶解后采用在线固相萃取/离子色谱技术直接检测,操作步骤较为简便,但对仪器配置的要求较高,且对于非水溶性药品的应用较为局限。OnGuard Ⅱ RP柱的主要功能团为二乙烯基苯,对疏水性有机化合物有非常好的吸附效果,因此本文借鉴食品中药物残留检测的液液萃取方法[20],将坎地沙坦酯药物溶于二氯甲烷后再用水萃取羟胺,水相过OnGuard Ⅱ RP柱后注入色谱仪,可确保去除全部有机物。该条件下,样品的色谱图背景较为干净,无任何有机物峰干扰,但回收率仅为70%左右,分析原因可能是RP柱中含部分氨基化合物,羟胺在碱性环境下可与其他物质发生氧化还原反应,导致过柱时损失。尝试采用30 mmol/L甲磺酸溶液萃取羟胺和活化RP柱,回收率显著提高(均在90%左右),且样品色谱图背景较为干净,分析原因是甲磺酸溶液可为羟胺提供一定的酸性环境,使得羟胺较为稳定,过柱时基本不会损失,回收率明显提高。
2.2 检测方式的选择
离子色谱常用的检测器主要有电导检测器和电化学检测器两种,其中电导检测器主要针对离子型化合物,其原理是测定溶液过电导池时的电导率。羟胺在水中可以进行弱电离,其水溶液呈弱碱性,但使用电导检测器测定时其响应值非常弱,完全达不到检测要求。电化学检测器主要测量物质的电信号变化,可检测具有氧化还原性质的化合物,如含硝基、氨基等的有机化合物及无机阴、阳离子等;而羟胺是一种还原剂,可在碱性环境下于电极表面发生氧化还原反应,从而产生信号。因此,本研究采用电化学检测器测定羟胺,样品经色谱柱分离后加氢氧化钠溶液进行柱后衍生,一方面可将盐酸羟胺等全部转化为具有强还原性的羟胺,参与氧化还原反应;另一方面还可以为羟胺的氧化还原反应提供足够的碱性环境。该条件下的检测信号较高,可满足限度的相应要求[6]。
2.3 系统适用性试验
精密量取系统适用性溶液25 μL注入离子色谱仪,记录色谱图。羟胺、铵离子依次出峰,两者的分离度为6.56。以30 mmol/L甲磺酸溶液为空白,注入离子色谱仪,记录色谱图,在羟胺出峰处无杂峰干扰,空白及系统适用性溶液的色谱图见图1。
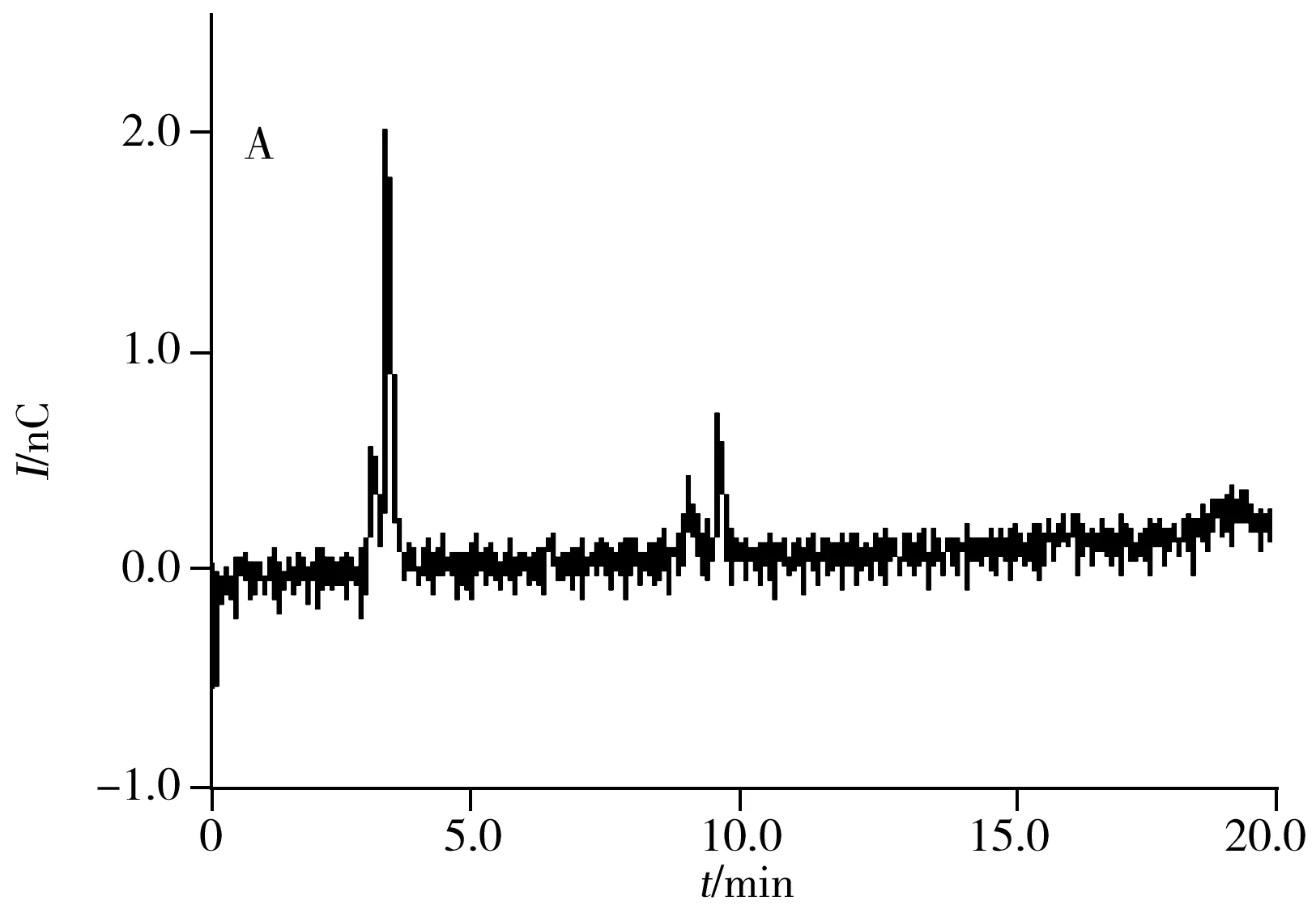
2.4 耐用性
取系统适用性溶液25 μL注入离子色谱仪,记录色谱图,同时分别改变淋洗液浓度(27、33 mmol/L)、柱温(35、45 ℃)和流速(0.9、1.1 mL/min)进行测定,记录色谱图,观察系统适用性的改变情况。结果表明,当色谱条件参数有微小变化时,羟胺与铵离子的分离度为6.39~6.89(均大于1.5),证明方法耐用性良好。
2.5 检出限、定量下限与精密度
取对照品溶液适量,加30 mmol/L甲磺酸溶液逐级稀释后注入离子色谱仪,记录色谱图,按信噪比S/N=3和S/N=10分别计算得羟胺的检出限和定量下限为0.007 24 mg/L和0.014 47 mg/L。取对照品溶液25 μL注入离子色谱仪,记录色谱图,重复进样6次,得到羟胺保留时间及峰面积的相对标准偏差(RSD)分别为0.11%和1.6%。
2.6 线性关系
在杂质限度200%范围内,分别配制定量下限(0.014 47 mg/L)、50%限度(0.072 36 mg/L)、100%限度(0.144 7 mg/L)、150%限度(0.217 1 mg/L)、200%限度(0.289 4 mg/L)5个质量浓度的羟胺标准溶液,分别注入离子色谱仪,记录色谱图,以峰面积(Y)对质量浓度(X,mg/L)绘制标准曲线。结果表明,羟胺在0.014 47~0.289 4 mg/L质量浓度范围内线性关系良好,线性方程为Y=24.481X+0.007 9,相关系数r=0.999。
2.7 准确度与重复性
采用不含羟胺的坎地沙坦酯药品为空白基质,分别添加80%限度、100%限度、120%限度浓度的羟胺对照品做回收率和精密度实验,每个加标浓度做3个样品。结果表明,羟胺的回收率为98.1%~103.1%,准确度良好,具体结果见表1。坎地沙坦酯空白溶液及添加羟胺的色谱图见图2。

表1 坎地沙坦酯中羟胺的加标回收率Table 1 Recoveries of hydroxylamine in candesartan cilexetil
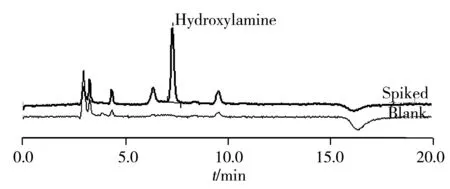
图2 坎地沙坦酯空白溶液及添加羟胺的色谱图Fig.2 Chromatograms of candesartan cilexetil blank and candesartan cilexetil blank spiked with hydroxylamine
采用不含羟胺的坎地沙坦酯药品为空白基质,添加100%限度浓度的羟胺对照品做重复性实验,平行测定6个样品。结果表明,6个平行测定结果的RSD为1.9%,方法的重复性良好。
2.8 应 用
将所建方法应用于检测合成的坎地沙坦酯药物小试3批、中试3批及工艺验证3批共9份样品,所有样品均未检出羟胺残留。
3 结 论
本文首次建立了离子色谱-电化学法测定坎地沙坦酯药物中羟胺残留的方法,采用固相萃取技术配制供试品溶液,阳离子交换色谱柱分离后加氢氧化钠溶液进行柱后衍生,利用电化学检测器实现羟胺的检测。方法的灵敏度高,分离度好,回收率、精密度及定量下限均能满足检测要求,是检测坎地沙坦酯药物中羟胺残留的有效方法。将本方法应用于坎地沙坦酯小试3批、中试3批及工艺验证3批共9份样品,所有样品均未检出羟胺残留,有效地指导了坎地沙坦酯合成反应进程,在坎地沙坦酯药物研发过程起到了良好的监督作用。
参考文献:
[1] Tang X J,Chen M.AvancesinCardiovascularDiseases(唐显军,陈明.心血管病学进展),2004,25(3):172-175.
[2] Wu K W,Wu C J,Sun T M.CentralSouthPharmacy(吴奎伟,吴成军,孙铁民.中南药学),2014,12(8):785-787.
[3] Xie X Y,Li Y,Lin W,Chen C,Liao X R,Chen Y.Chin.J.Pharmacist.(谢向阳,李旸,林雯,陈晨,廖祥茹,陈鹰.中国药师),2015,18(4):664-668.
[4] Sun Z M.Chin.Pharm.(孙在茂.中国药房),2015,26(21):2922-2924.
[5] Lu F Y.J.DrugsClin.(鲁风云.现代药物与临床),2013,5(9):958-961.
[6] European Medicines Agency.Guideline on the Limits of Genotoxic Impurities.http://www.ema.eu-ropa.eu/docs/en_GB/document_library/Scientific_guideline/2009/09/WC500002903.pdf,2006-06-28/2013-12-13.
[7] Yang M.Chem.Ind.Eng.(杨明.化学工业与工程),1999,16(4):233-235.
[8] Li J X,Wen X R,Wu X P.Chin.J.Anal.Lab.(李京雄,温欣荣,吴秀萍.分析试验室),2013,32(3):86-88.
[9] Zhan G Q,Luo D B,Zhang Y B.J.Instrum.Anal.(詹国庆,罗登柏,张永波.分析测试学报),2004,23(5):128-129.
[10] Ma W X,Liu W M.Chin.J.Pharm.(马卫兴,刘文明.中国医药工业杂志),1993,24(7):315-316.
[11] Ding H W,Chen G G,Ren L L,Gao P.Chin.J.Pharm.(丁宏伟,陈国广,任丽莉,高盼.中国医药工业杂志),2016,47(4):454-456.
[12] Xu C.Mod.Agrochem.(徐晨.现代农药),2017,16(1):36-40.
[13] Jiang T,Li X B,Zhao H X,Liu J,Du Y G.Chin.J.Med.Pharm.(姜涛,李孝壁,赵海霞,刘建,杜永刚.医药),2016,5(12):168-169.
[14] Zhang X W,Zheng H G,Chen L L.Chin.Pharm.J.(张晓伟,郑洪国,陈礼莉.中国药学杂志 ),2017,52(20):1801-1804.
[15] Yang L,Hou Y,Wang B X,Yang S H,Zou Y,Yang Y,Yang Y,Liu J.J.Instrum.Anal.(杨蕾,侯英,王保兴,杨式华,邹悦,杨燕,杨勇,刘静.分析测试学报),2010,29(2):164-170.
[16] Zhang S F,Lin Z Z,Chen X Z,Zhang D L,Wang L S.J.Instrum.Anal.(张水锋,林珍珍,陈小珍,张东雷,王立世.分析测试学报),2012,31(1):85-89.
[17] Zeng X L,Ye M L,Chen Y X,Zhu Y.J.Instrum.Anal.(曾雪灵,叶明立,陈永欣,朱岩.分析测试学报),2006,25(3):92-94.
[18] Li J,Li X,Luo J,Xu C G,Liu H J.Chin.J.Pharm.(李继,李霞,罗晶,徐长根,刘海静.中国医药工业杂志),2015,46(2):197-199.
[19] Huang Q Q,Zhong N F,Hong G Y.Chin.J.HealthLab.Technol.(黄巧巧,钟乃飞,洪高云.中国卫生检验杂志),2014,24(4):505-507.
[20] GB/T 21311-2007.Determination of Residues of Nitrofuran Metabolites in Foodstuffs of Animal Origin-HPLC-MS/MS.National Standards of the People’s Republic of China(动物源性食品中硝基呋喃类药物代谢物残留量检测方法 高效液相色谱/串联质谱法.中华人民共和国国家标准).
