不孕不育症患者外周血EMAb、AsAb与AMH的检测价值研究
2018-07-03文海燕姜艳艳缪丽琳
文海燕,姜艳艳,缪丽琳
(广东省东莞市厚街医院,广东 东莞 523000)
不孕不育症是21世纪危害人类生殖健康的常见疾病之一,已成为当前临床生殖医学研究的一个焦点。不孕不育的致病原因极其复杂,与人们生活习惯和居住环境的改变密切相关,有10%~20%患者病因仍不明了,可能与免疫性因素相关。经研究证实,阻碍精卵结合、抑制胚胎着床、减弱精子活性等多个干扰生殖途径都与生殖免疫系统的抗体相关,在生殖系统疾病中免疫因素的作用往往是不可替代的[1-3]。抗苗勒管激素(anti-mullerian hormone,AMH)一方面能调节卵泡的生长发育,另一方面也抑制了卵泡刺激素的敏感程度和卵泡的收集状态,能明确反映卵巢的存储量[4]。本研究探讨了外周血AMH、抗精子抗体(antisperm antibody,AsAb)和抗子宫内膜抗体(anti endometrial antibody,EMAb)检测不孕不育患者中的检测价值,旨在为临床不孕不育的诊断、治疗提供参考。
1 临床资料
1.1研究对象 选取2013年8月—2016年3月来我院就诊的不孕症患者70例为试验组,年龄23~40(25.5±1.8)岁,婚后未采取任何避孕措施的不孕时间2~5(2.7±1.1)年。纳入条件:结婚至少2年,夫妻有正常性生活,未采取任何避孕措施并且无孕史;男女双方无家传性遗传病史且夫妇双方染色体正常;排除生殖器发育异常、内分泌功能紊乱、外周血染色异常等不适合怀孕患者以及男方生殖功能障碍者。同时选取同一阶段健康并且近2年内具有正常生育史的育龄女性50例作为对照组,年龄21~39(26.2±2.4)岁,经检查其泌尿外科及妇科均无异常。2组研究对象对检测诊断均知情同意,且基本情况比较差异均无统计学意义(P均>0.05),具有可比性。
1.2研究方法
1.2.1标本采集 于清晨空腹抽取2组研究对象的静脉血液2mL,女性于月经后第2天清晨抽取,经离心分离后留取血清,并置于-20 ℃保存待检。
1.2.2检测方法 采用酶联免疫法测定2组研究对象外周血EMAb、AsAb、AMH水平,从欧蒙医学诊断技术有限公司购入试剂盒,严格按照说明书的流程来进行实验操作。用酶标仪测出试验组孔和标本孔的OD值,通过试验组的OD值计算Cutoff值, 若标本孔的OD>Cutoff值为阳性,反之为阴性,试剂盒选自美国DSL公司。
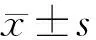
2 结 果
2.12组外周血EMAb、AsAb、AMH水平比较 不孕症组外周血EMAb、AsAb、AMH水平均高于对照组(P均<0.05)。见表1。
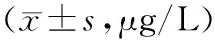
表1 2组外周血EMAb、AsAb、AMH水平比较
2.22组EMAb、AsAb、AMH阳性率比较 不孕症组EMAb、AsAb、AMH阳性率均高于对照组(P均<0.05)。见表2。
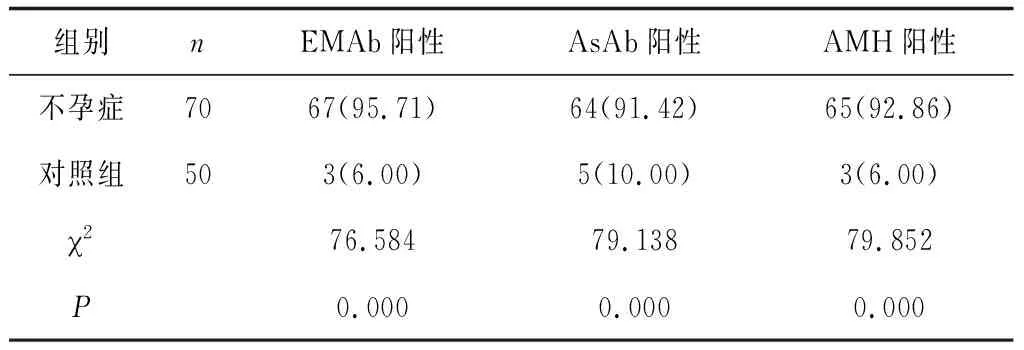
表2 2组EMAb、AsAb、AMH阳性率比较 例(%)
2.3外周血EMAb、AsAb、AMH在不孕症中的应用价值 根据不孕症外周血EMAb、AsAb、AMH水平绘制ROC曲线,EMAb的AUC为0.822,95%CI[0.698,0.963],最佳诊断界限为4.25ng/L,在此界限值的敏感性为81.4%,特异性为86.5%,阳性预测值为82.2%,阴性预测值为89.0%;AsAb的AUC为0.801,95%CI[0.730,0.980],最佳诊断界限为5.12 ng/L,在此界限值的敏感性为82.3%,特异性为87.4%,阳性预测值为82.2%,阴性预测值为84.9 %;AMH的AUC为0.782,95%CI[0.722,0.967],最佳诊断界限为4.69 ng/L,在此界限值的敏感性为82.2%,特异性为81.5%,阳性预测值为79.9%,阴性预测值为82.7%。见图1。
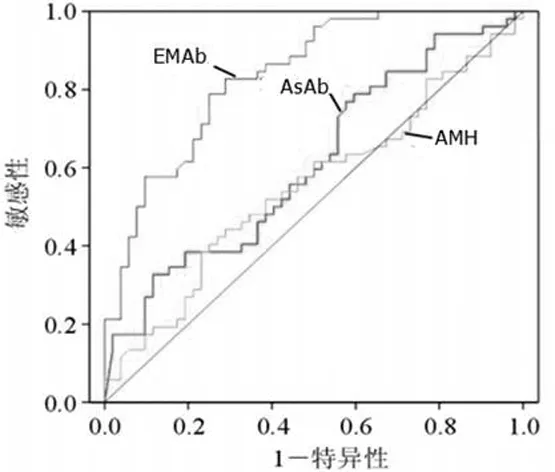
图1 外周血EMAb、AsAb、AMH在不孕症中检测的ROC曲线
3 讨 论
自身免疫机制近些年来普遍受到不孕不育学者的重视,且在生殖系统疾病的病理过程中发挥着重要作用。研究发现,炎症、遗传和全身性疾病等各方面疾病因素都会导致不孕不育的发生[5-6],而免疫因素在生殖系统中发挥着越来越重要的枢纽作用。阻碍精卵结合、抑制胚胎着床、减弱精子活性等这些干扰生殖的途径都受到免疫性抗体的影响。近年研究证实导致免疫性不孕不育的重要因素之一与AsAb密切相关。AsAb是一种特异性抗体,精子进入女性生殖道后,与精子表面抗原相结合,通过获能而阻止精子穿透宫颈黏液,很大程度上降低了精子的存活率和顶体反应,导致女性自然流产率升高,对女性的不孕不育以及受孕能力都会造成严重的影响[7-8]。正常情况下,女性身体内的完整生殖道具有一定的免疫调节功能,精子进入女性体内时,身体的免疫系统会立即产生反馈机制,不会特异性结合产生抗体。但当女性的生殖道被病毒感染、外力损伤或经期同房与精子接触时,其生理屏障遭到破坏,使得机体产生免疫应答反应产生AsAb。本研究中,不孕症组外周血AsAb水平及阳性率均高于对照组,表明精子的凝集过程、精子和卵子的融合过程以及精子的活力都与女性生殖道和外周血中的AsAb相关,从而引起免疫性不孕。
与AsAb的研究类似,EMAb作为一种自身抗体,参与了以子宫内膜为靶抗原的一系列免疫反应。正常情况下人体内不会产生EMAb,而这种特异性的抗体也是一种糖蛋白,与孕激素密切相关,这种特异性抗体与子宫内膜细胞抗原相结合,激活了补体系统,产生了局部免疫病理变化,如干扰早期的受精卵的输送和着床[9],影响了胚胎的早期发育和子宫内膜腺体的局部功能,从而导致了受精卵着床失败或不育,最后孕妇以不显性的早期流产而告终,有报道称怀孕阶段的妇女容易得慢性炎症,经血在身体内回流刺激了淋巴细胞产生了抗子宫内膜抗体,并且与子宫内膜碎片的巨噬细胞特异性结合,有过生育经验的妇女第二次进行分娩时宫颈局部容易发生撕裂,导致膜碎片流入子宫内部,抗原抗体相结合从而吸收抗内膜抗体[10]。本研究中,不孕组EMAb的水平及阳性率显著高于对照组,表明抗体在不孕不育的发生过程中起到了一定的作用。
AMH因其可以促进雄性胎儿苗勒管的退化而得名[11]。在卵泡发育的早期阶段,AMH由卵泡颗粒细胞产生,在转化生长因子-β(TGF-β)家族中占据着重要成分,在体内发挥着生长和分化的作用,同时其作用也相当于激活素和抑制素,临床上用于POF和PCOS的疾病辅助治疗和诊断[12]。另外AMH不仅可以预测绝经期的时间[13],同时也可以鉴别诊断继发性闭经[14]。AMH浓度最高时期是在成年人的早期阶段,其浓度随着年龄增加反而逐年下降。以往的动物实验表明,AMH能够抑制卵泡对其卵泡刺激素(FSH)的敏感程度,阻止卵巢始基中卵泡的起始收集功能,抑制卵泡的生长发育,并且能精确地反映精子和卵子的融合状态[15-16]。本研究结果显示,不孕组外周血AMH水平及阳性率显著高于对照组。提示不孕患者卵泡的生长发育和卵巢功能异常是由于患者外周血AMH水平高低不同所致,AMH可能作为一个独立的影响因素来影响不孕不育的发生。影响不孕不育患者外周血AMH的因素有很多,目前其正常值范围尚无权威机构报道,但文献中已确定与年龄因素密切相关[17]。
本研究中,ROC分析可知,外周血EMAb、AsAb、AMH在不孕症患者中诊断灵敏性及特异性分别为81.4%和86.5%、82.3%和87.4%、82.2%和81.5%,表明外周血EMAb、AsAb和AMH检测对不孕症的诊断有一定的价值。
综上所述,外周血AsAb、EMAb、AMH在不孕的过程中发挥了一定的作用,在临床上对不孕患者进行多种抗体检测,可为不孕的诊断提供可靠的病因学依据,而采用联合检测对寻找不孕的原因及相应治疗对策具有重要的指导意义。
[参考文献]
[1] 王梦玖. 临床生殖免疫学[M]. 上海:上海科学技术出版社,2000
[2] 白雪,黄河欣,石博,等. 女性不孕不育患者血清及宫颈黏液中相关抗体检测的实验研究[J]. 中国妇幼保健,2013,28(33):5530-5531
[3] 徐淑琴,黄吉. 免疫性抗体对女性不孕不育检测的临床意义[J]. 实用预防医学,2010,17(9):1866-1868
[4] Weenen C,Laven JS,Von Bergh AR,et al. Anti-Müllerian hormone expression pattern in the human ovary: potential implications for initial and cyclic follicle recruitment[J]. Molecular Human Reproduction,2004,10(2):77-83
[5] 黄存敏,李艳艳,姚林伶,等. 免疫性抗体在女性不孕不育检测中的临床应用观察[J/CD]. 临床医药文献:电子杂志,2015(6):1032-1033
[6] 黄国香,刘鸿春,王铮,等. 不孕不育患者免疫抗体分析[J]. 中国优生与遗传杂志,2009,17(7):109-110
[7] 张利,王东文,王王景琦,等. 抗精子抗体检测的临床意义[J]. 临床医药实践,2008,17(2):98-99
[8] 陈家坚,姜邦蓉. 抗精子抗体检测对不孕不育诊断的临床价值[J]. 中国实验诊断学,2008,30(4):545-546
[9] 许晓清,吴方贵,邱耀芳. 不孕不育患者与抗精子抗体和抗子宫内膜抗体的相关性分析[J]. 中国热带医学,2006,6(8):1371-1372
[10] 张磊,赵晓岚,刘瑾. 抗子宫内膜抗体、抗精子抗体与子宫内膜异位症关系的研究[J]. 中国妇幼保健,2010,25(28):4029-4030
[11] Di CN,Belville C. Anti-Müllerian hormone receptor defect[J]. Best Practice & Research Clinical Endocrinology & Metabolism,2006,20(4):599-610
[12] Rohr J,Allen EG,Charen K,et al. Anti-Mullerian hormone indicates early ovarian decline in fragile X mental retardation (FMR1) premutation carriers: a preliminary study[J]. Human Reproduction,2008,23(5):1220
[13] 王燕. 联合检测ASAb、EMAb和AMH对不孕不育症的临床研究[J]. 河北医药,2012,34(21):3238-3239
[14] 杨小岗,王芳,武佳敏,等. 血清抗苗勒管激素诊断卵巢早衰的临床意义[J]. 检验医学与临床,2010,7(1):51-52
[15] 任妞,刘彦. 生育期女性血清抗苗勒管激素水平的研究[J]. 中国妇产科临床杂志,2011,12(4):281-283
[16] 许丽华,车小群,庞小艳,等. 辅助生殖技术超促排卵中血清促黄体生成素对胚胎移植中妊娠结局的影响[J]. 中国当代医药,2014,21(12):184-186
[17] 王金锋,王巧莲. 免疫性抗体在不孕不育妇女诊治中的作用[J]. 中国优生与遗传杂志,2009,17(1):96
