MSCT对胰腺癌TNM分期预测和可切除性评估的临床运用进展
2018-06-28边云方旭王莉
边云 方旭 王莉
胰腺癌(pancreatic carcinoma,PC)是一种起病隐匿,恶性度高,预后差,生存率低的消化系统恶性肿瘤,由于其临床缺乏特异性,故早期诊断和治疗均较困难[1]。近年来胰腺肿瘤外科迅速发展,手术治疗成为PC唯一有效的治疗手段[2],但是术后复发率仍高达80%,可获得根治性切除患者不足15%,术后5年生存率约5%,预后并无突破性改善[3-4]。术后肿瘤复发的主要原因是术前常规影像学对阳性淋巴结和胰周神经浸润(perineural invasion,PNI)的诊断不足,导致手术切除不彻底[5]。PC术后淋巴结转移率和PNI分别高达56%~78.6%和50.0%~100%,即便在肿块直径≤2 cm的小胰癌,两者的发生率也高达约50%[6-7]。由此可见,降低PC术后复发率的关键在于早期诊断、术前准确的临床分期以及多学科联合诊治。CT诊断PC的敏感性、特异性分别为91%、90%,成为PC诊断、分期以及判断肿瘤可切除性的首选检查方法[8-9]。现就多层螺旋CT(multislice CT,MSCT)对PC的临床分期、可切除性评估现状做一综述。
一、胰腺癌的MSCT扫描技术
自20世纪90年代初螺旋CT(spiral CT,SCT)扫描方式问世以来,螺旋扫描方式在医学影像的CT检查中占据重要位置,弥补了以往单层CT扫描范围小、图像分辨率低等多种不足,MSCT从最初的4层、8层直到现在的320层,CT图像的质量有了飞速的提高,从而也使MSCT成为PC诊断的重要检查手段。
1.MSCT扫描技术:胰腺CT扫描分为平扫期、动脉期、胰腺实质期、延迟期。动脉期胰腺实质强化不明显,主要评估肿块周围的重要动脉,如腹腔干(celiac axis,CA)、肠系膜上动脉(superior mesenteric artery,SMA)、脾动脉(splenic artery,SA)、肝动脉(hepatic artery,HA)。胰腺实质期可以获得正常胰腺组织和肿块间的最佳对比度,是诊断PC的最佳期相。延迟期主要用来评估肿块周围重要静脉,如肠系膜上静脉(superior mesenteric vein,SMV)、门静脉(portal vein,PV)和肝脏转移情况,此期正常胰腺实质内造影剂基本退出,若此时仍可见局灶性强化,多为纤维组织的延迟强化,对可疑或确诊的PC患者均需进行胰腺MSCT增强扫描,扫描范围从胸腔到盆腔[9],对比剂通常选用非离子型碘胺。
对比剂注射速率、各期扫描延迟时间、扫描的层厚等诸多CT扫描参数均影响胰腺图像质量。Tublin等[10]研究表明对比剂注射速率5 ml/s的图像质量优于2.5 ml/s。目前大多数研究认为对比剂注射速率4~5 ml/s可获得肿瘤与胰腺实质的最佳对比度[11]。Schueller等[12]认为将对比剂注射速率提高到8 ml/s可以提高胰腺实质和病灶的对比度。各期扫描时间对图形的质量也至关重要,通常采用小剂量测试(test bolous)和对比剂自动追踪技术(阈值为180 HU)两种方法来决定。Schueller等[12]研究表明若对比剂注射速率为4 ml/s时,动脉延迟期为28 s可获得最佳胰腺图像。为了得到良好的三维后处理图像,胰腺MSCT的扫描层厚应该尽量薄,通常为0.5 mm。长海医院采用的胰腺扫描参数为管电压120 kVp,管电流140 mAs,采集准直2.5 mm,旋转时间0.5 s,螺距因子1.2 mm,重建间隔3.0 mm,螺距层厚1.5 mm,扫描视野348 mm×348 mm,启动扫描阈值140 HU,对比剂注射速率4.0 ml/s,分别在20~25 s、60~70 s、110~130 s行动脉期、胰腺期和延迟期三期扫描。
2.MSCT三维后处理技术:2015年美国国立综合癌症网络(NCCN)PC实践指南中强调了MSCT后处理技术对PC诊断和可切除性评估的价值,尤其是肿块与血管的关系至关重要[9,13-14]。MSCT主要的后处理技术有:多平面重组(multiplanar reconstruction,MPR),最大密度投影(maximum intensity projection,MIP)、曲面重建(curved planar reconstruction,CPR)、容积再现(volume rendering,VR)。每项技术都有自身的优点,可以从不同角度显示肿瘤的特征。MPR技术与薄层MIP技术类似,可以在多个平面上显示肿瘤与附近重要血管的关系以及淋巴结转移的情况;厚层MIP技术可以进一步显示血管受侵的程度。CPR技术采用曲面截取三维容积数据,可以将弯曲的主胰管或血管全程在一个平面完整清晰地显示,从而观察到PC继发的胰管改变,明确血管受侵和狭窄的程度。VR技术可以非常直观、立体地呈现出受侵犯血管的狭窄和迂曲(图1)。总之,多种CT三维后处理技术可以给PC的诊断提供更多的有价值的诊断信息,提高了术前分期的准确性。
二、胰腺癌的MSCT表现
PC最主要病理类型是导管上皮癌(ductal adenocar-cinoma of pancreas,DACP),它是一种少血供、无包膜的实性肿瘤,间质中有大量纤维组织。直径≤2 cm的肿瘤局限于胰腺轮廓内,直径>2 cm的肿瘤常常突出于胰腺,使其轮廓变形。由于PC肿瘤细胞和纤维组织均为乏血供,所以CT平扫通常表现为与周围正常胰腺组织分界较清楚的低密度肿块影,动态增强几乎无强化,而正常胰腺组织在胰腺实质期明显强化,此期便于识别肿瘤的大小和范围,是检出PC最佳期相。部分少见类型的肿块内可因液化坏死而致内部密度更低,增强后无强化。PC继发的胰管改变非常有特征,表现为继发扩张的胰管多呈平滑状,并于肿块处突然截断,此征象几乎见于所有PC;如果是胰头癌常同时合并肝内外胆管软藤状扩张,出现特征性的“双管征”。由于肿瘤阻塞胰腺导管,近端的胰腺组织常继发胰管阻塞后的慢性胰腺炎(CP),体积可以萎缩变小,“胰管穿通征”是鉴别PC与CP的主要征象。肿块破坏胰管而致胰液外溢,在肿瘤远侧的胰腺组织内形成潴留性囊肿,表现为与主胰管相通的类圆形液体密度影。由于PC侵袭性生长,当肿瘤向胰周浸润时,表现为胰周血管的脂肪间隙模糊,甚至消失,晚期可出现肝脏、网膜、肺等的转移。
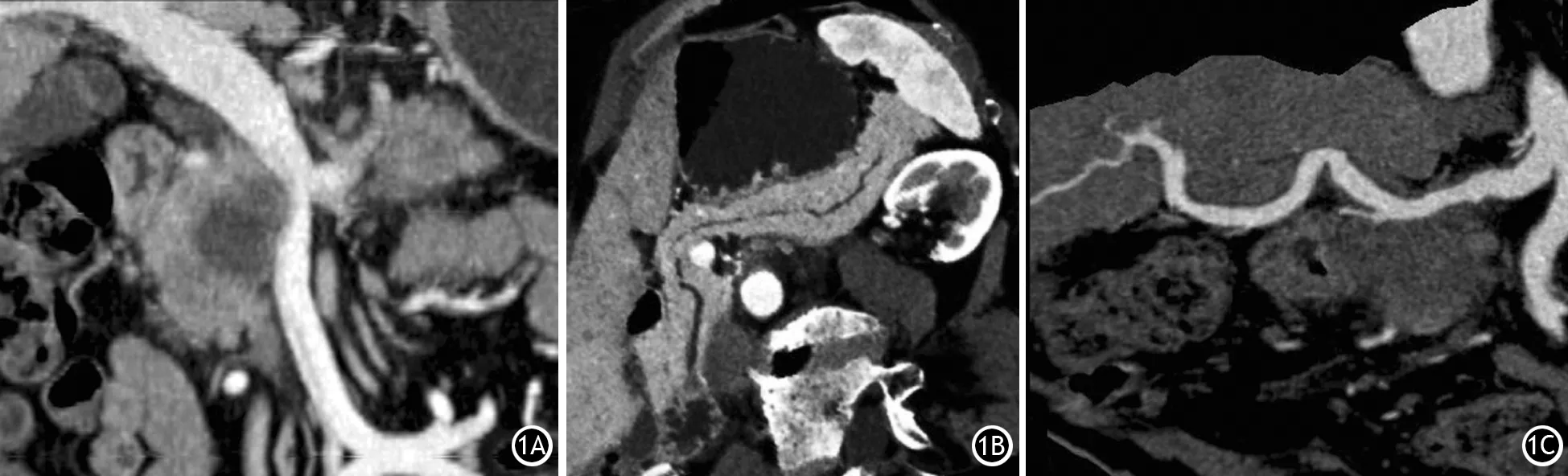
图1 多层螺旋CT多种三维后处理技术 厚层多平面重组图像图(1A)可见胰头部肿块与PV接触,接触面积<180°;沿主胰管重建的曲面重建图(1B)可见胰头部肿块与SMV接触,接触面积<180°,胰体尾部主胰管扩张;薄层多平面重组图(1C)可见SMV近段狭窄
三、MSCT对胰腺癌的TNM分期预测和切除性评估现状
目前被国际上普遍认可和采用的PC的TNM分期方法有两种,日本胰腺病学会(JPS)的分期法及国际抗癌联盟和美国癌症研究联合会(UICC/JACC)的分期法[15]。两者在T和M分期上基本一致,区别主要体现在对N分期的不同。MSCT对肿块大小、位置、有无突破胰腺包膜以及与肿瘤周围血管的关系均可以非常清楚地显示,从而可以对T进行准确分期。当明确PC未发生远处转移,下一步应对其可切除性进行评估。
MSCT主要依据肿块与周围重要血管的关系来对肿块进行可切除性评估。较多学者对肿块侵犯胰周血管都提出了CT量化标准。Lu等[16]按照肿块与血管的接触面分为4个等级,以肿瘤包绕血管1/2作为不可切除的标准,此标准判断肿瘤可切除性的敏感性为84%,特异性98%。Loyer等[17]根据肿瘤和血管接触分为6型,A型、B型分别为肿瘤与血管之间存在正常的脂肪间隙和正常的胰腺组织,C型为低密度肿瘤与血管为凸面点状接触,D型为低密度肿瘤与血管为凹面接触或部分包绕血管,E型为低密度肿瘤包绕血管,两者之间脂肪间隙模糊或消失,F型为肿瘤使血管闭塞。E型和F型为不可切除,C型和D型为可能切除,要视术中情况定。以上两个评价标准均未将胰周动脉、静脉分别评价,部分肿瘤对血管压迫诊断为血管受侵犯,忽略了肿瘤与血管接触的程度。Nakayama等[18]将血管与肿瘤之间的接触程度分为0、<50%、50%~75%、>75%共4级,按此标准对动、静脉分别评价其可切除性的敏感性、特异性分别为71%、86%和78%、79%。Li等[19]将血管与肿块间的关系分为5个等级,1级、2级肿块与血管之间存在正常的脂肪间隙和正常的胰腺组织,3级、4级肿块包绕血管分别为<50%或≥50%,5级为肿块包埋血管。按此标准对动、静脉分别评价其可切除性的敏感性、特异性分别为49%、100%和97%、91%。袁敏等[20]应用长海医院的标准判断肿块可切除性的敏感性、特异性分别为95.4%、84.3%。以上评价标准虽将胰周重要的动、静脉血管分开评价,但未将胰头和胰体尾部肿瘤区分开,对于其他重要血管如CHA、胃十二指肠动脉、SMA第一空肠分支、变异的肝右动脉均未作为主要评价内容,导致部分可能切除患者漏评或假阳性率增高。2015年NCCN胰腺癌实践指南关于肿瘤对胰腺周围的重要血管侵犯程度以及其与肿瘤的可切除性关系均明确给予界定,并且对2014年指南给予更新和补充[21-23]。该标准将胰周动脉、静脉和胰头、体尾癌均分别评价,并对肿块与血管接触以180°划分,最后结合肿瘤的部位、接触的血管类型和接触角度提出切除、可能切除和不可切除的诊断。由此可见,肿块的可切除性概念并非一成不变,随着外科手术技术提高、麻醉技术和人工材料的发展,原本认为累及门静脉的肿块不可切除,现在通过血管原位移植技术和重建技术可以成功切除[6]。血管与肿块间关系影响到手术决策,术前MSCT对血管的详细评估在手术方案的制定中起到至关重要的作用。据统计常规CT对肿块不可切除性判断的准确率几乎达到100%,而在对可切除性的判断中约有1/3患者手术证实不可切[6,24],20%~40%的根治性切除的患者术后病理证实为姑息性切除[5]。
UICC/JACC的N分期中将淋巴结分为12组,用N0和N1来表示淋巴结转移的有无;而JPS分期方法中以淋巴引流为基础,按阳性淋巴结所在区域分为18组,并将18组淋巴结分为3站,N0~N3分别表示无淋巴结转移和转移至1、2、3站,虽较为复杂,但可准确反映PC浸润、扩散和淋巴结转移的实际情况,对预后评估更佳[25]。由于淋巴结转移与淋巴结本身大小、肿瘤T分期均无相关性,且与炎性增生的淋巴结难以鉴别,因此,术前影像学对阳性淋巴结辨识和鉴别困难,导致影像学无法对N进行分期预测[26]。MSCT对于淋巴结转移的判断标准包括淋巴结大小、密度、数目、轮廓特征和强化特征等指标,而运用最广泛的是淋巴结大小,多数文献以淋巴结最短径或者长短径比作为判断标准[27-28]。薛华丹等[27]研究表明,阳性淋巴结判断标准为直径>10 mm,特异性为88%,漏诊率为81.2%,有许多较小转移淋巴结漏诊,但其误诊率为12%,虽然可能增加单纯探查手术的概率,但不会对有手术机会的患者放弃手术;若淋巴结直径>3 mm或长短径之比<2为阳性标准,则误诊率可达100%,但敏感性也可达到100%,几乎无漏诊。此外还可根据淋巴结数目的增多、内部密度不均匀、有坏死和融合、不均匀强化、边界模糊等表现来诊断转移淋巴结[27,29]。有34%~50%的PC在确诊时已发生肝转移,MSCT表现为单发或多发类圆形低密度灶,增强后呈环形强化。但仍然有40%术前经CT评价为可切除的PC,在术中发现肝脏和腹膜表面的微小转移灶,MSCT对这些微小转移灶的可视化程度低,易遗漏,从而导致部分M1分期误为M0分期。
综上所述,MSCT成像速度快,空间分辨率和密度分辨率高,可以为临床获得高质量的影像图像,从而提高肿块及其附近血管、淋巴结、微小转移灶的可视化程度。通过多种三维后处理技术,可以进一步明确血管受侵的程度、增加阳性淋巴结和微小转移灶的检出率,准确地对PC进行TNM分期预测和可切除性评估,为临床在制定合理的治疗方案、避免过度手术、减低术后复发提供非常有价值的参考信息。
参 考 文 献
[1] Beger HG, Nakao A, Neoptolemos JP, et al. Pancreatic cancer, cystic neoplasms and endocrine tumors: diagnosis and management[J]. John Wiley & Sons, 2015: 3-147.
[2] 国家标准化委员会. 胰腺癌诊断[M]. 北京: 中国质监出版社, 2011: 1.
[3] 汪炳瑞, 邱伟华. 胰腺癌嗜神经侵袭的解剖和分子生物学研究进展[J]. 中华肝胆外科杂志, 2014, 20(4): 314-317. DOI: 10.3760/cma.j.issn.1007-8118.2014.04.021.
[4] Ugur Selek SSL, Eric L. Chang decision making in radiation oncology[M]. New York: Springer, 2011: 389-420. DOI: 10.1007/978-3-642-13832-4.
[5] 赵平. 胰腺癌[M]. 北京: 北京大学医学出版社, 2006: 59-83.
[6] 焦新元, 任建林, 陈汝福. 胰腺癌-新理论 新技术 新观点. 北京: 人民军医出版社, 2010: 95-139.
[7] Dai H, Li R, Wheeler T, et al. Enhanced survival in perineural invasion of pancreatic cancer: an in vitro approach[J]. Hum Pathol, 2007, 38(2): 299-307. DOI: 10.1016/j.humpath.2006.08.002.
[8] Compton CC, Byrd DR, Garcia-Aguilar J, et al. AJCC CANCER STAGING ATLAS: A Companion to the Seventh Editions of the AJCC Cancer Staging Manual and Handbook.In: 2 ed. New York Springer, 2012. DOI: 10.1007/978-1-4614-2080-4.
[9] 李晓青, 钱家鸣. 《2015年美国国立综合癌症网络胰腺癌临床实践指南(V2版)》更新要点及临床路径[J]. 临床肝胆病杂志, 2015(5): 649-653. DOI: 10.3969/j.issn.1001-5256.2015.05.002.
[10] Tublin ME, Tessler FN, Cheng SL, et al. Effect of injection rate of contrast medium on pancreatic and hepatic helical CT[J]. Radiology, 1999, 210(1): 97-101.DOI: 10.1148/radiology.210.1.r99ja2197.
[11] Reiser MF, Becker CR, Nikolaou K, et al. Multislice CT. New York: Springer, 2009: 407-413. DOI: 10.1007/978-3-540-33125-4.
[12] Schueller G, Schima W, Schueller-Weidekamm C, et al. Multidetector CT of pancreas: effects of contrast material flow rate and individualized scan delay on enhancement of pancreas and tumor contrast[J]. Radiology, 2006, 241(2): 441-448.DOI: 10.1148/radiol.2412051107.
[13] Tempero MA, Malafa MP, Behrman SW, et al. Pancreatic adenocarcinoma, version 2.2014: featured updates to the NCCN guidelines[J]. J Natl Compr Cancer Netw, 2014, 12(8): 1083-1093.
[14] Tempero MA, Arnoletti JP, Behrman SW, et al. Pancreatic Adenocarcinoma, version 2.2012: featured updates to the NCCN Guidelines[J]. J Natl Compr Cancer Netw, 2012, 10(6): 703-713.
[15] Isaji S, Kawarada Y, Uemoto S. Classification of pancreatic cancer: comparison of Japanese and UICC classifications[J]. Pancreas, 2004, 28(3): 231-234.
[16] Lu DS, Reber HA, Krasny RM, et al. Local staging of pancreatic cancer: criteria for unresectability of major vessels as revealed by pancreatic-phase, thin-section helical CT[J]. Am J Roentgenol, 1997, 168(6): 1439-1443.DOI: 10.2214/ajr.168.6.9168704.
[17] Loyer EM, David CL, Dubrow RA, et al. Vascular involvement in pancreatic adenocarcinoma: reassessment by thin-section CT[J]. Abdom Imaging, 1996, 21(3): 202-206.
[18] Nakayama Y, Yamashita Y, Kadota M, et al. Vascular encasement by pancreatic cancer: correlation of CT findings with surgical and pathologic results[J]. J Comput Assist Tomogr, 2001, 25(3): 337-342.
[19] Li H, Zeng MS, Zhou KR, et al. Pancreatic adenocarcinoma: the different CT criteria for peripancreatic major arterial and venous invasion[J]. J Comput Assist Tomogr, 2005, 29(2): 170-175.
[20] 袁敏, 江旭, 吕桃珍, 等. 多层螺旋CT对胰腺癌血管侵犯的可切除性评价标准探讨[J]. 中华胰腺病杂志, 2008, 8(5): 285-290.DOI:10.3760/cma.j.issn.1674-1935.2008,05.001.
[21] 张太平, 曹喆, 赵玉沛. 《2015年美国国立综合癌症网络胰腺癌临床实践指南(V2版)》外科相关部分解读[J]. 临床肝胆病杂志, 2015(5): 654-656. DOI: 10.3969/j.issn.1001-5256.2015.05.003.
[22] 张太平, 肖剑春, 赵玉沛. NCCN胰腺癌外科治疗指南解读[J]. 临床肝胆病杂志, 2010, 26(5): 454-458.
[23] 周振宇, 王捷. 2015年NCCN胰腺癌指南诊疗更新解读[J]. 岭南现代临床外科, 2015, 15(4): 377-381. DOI: 10.3969/j.issn.l009-976X. 2015.04.001.
[24] Baert AL. New Concepts in Diagnosis and Therapy of Pancreatic Adenocarcinoma. New York: Springer, 2011. DOI: 10.1007/978-3-540-85381-7.
[25] 王建承, 陈希, 费健, 等. 胰腺癌不同分期方法的比较研究[J]. 外科理论与实践, 2009, 14(5): 519-525.
[26] Silverman PM. Oncologic Imaging: A Multidisciplinary Approach. Philadelphia: Saunders, 2012.
[27] 薛华丹, 刘炜, 王沄,等. 多层螺旋CT对胰腺癌转移淋巴结的诊断能力初步分析[J]. 医学影像学杂志, 2008, 18(12): 1399-1403. DOI: 10. 3969/j. issn. 1006-9011. 2003.12.015.
[28] Roche CJ, Hughes ML, Garvey CJ, et al. CT and pathologic assessment of prospective nodal staging in patients with ductal adenocarcinoma of the head of the pancreas[J].Am J Roentgenol, 2003, 180(2): 475-480.DOI: 10.2214/ajr.180.2.1800475.
[29] 陈哲,郭君斌,冯广森,等. 螺旋CT对胰腺癌腹主动脉旁淋巴结转移的评价[J]. 医学研究杂志, 2009, 38(3): 100-103. DOI: 10. 3969/j. issn. 1673-54SX. 2009. 03. 040.
