PAK6基因对人乳腺癌放疗敏感性及细胞凋亡影响及机制
2018-06-25袁金金陈晓娟刘宗文
宋 锐 袁金金 侯 歌 杨 军 陈晓娟 刘宗文
(郑州大学第二附属医院肿瘤放疗科,河南 郑州 450014)
乳腺癌发病率在全部恶性肿瘤中占10%左右,在女性恶性肿瘤中位居第二位,仅次于子宫癌〔1〕。乳腺癌诱发原因较多,遗传、生活环境等均与乳腺癌的发生有关,其发病机制复杂,是多种基因共同作用的结果。目前常见的治疗乳腺癌的方法有手术治疗、放化疗。由于大多数患者在确诊时已经是乳腺癌的中晚期,放疗成为治疗乳腺癌的重要辅助手段〔2〕。提高乳腺癌放疗敏感性成为目前研究的热点。P21激活的蛋白激酶(PAK)6在肺癌、前列腺癌、舌鳞癌、胰腺癌等癌组织中过度表达,能够促进肿瘤发生〔3~5〕。研究表明,抑制PAK6表达后,能够促进癌细胞凋亡,抑制癌症发展〔6〕。Wnt信号通路参与肿瘤发展,在肿瘤组织中过度激活,其关键基因β-连环蛋白(catenin)和下游靶基因c-myc均表达升高,并且参与癌基因和抑癌基因对癌症的调控过程〔7〕。本研究旨在探讨PAK6对乳腺癌细胞放疗敏感性和凋亡的影响。
1 材料与方法
1.1细胞 乳腺癌细胞MDA-MB-468购自中国科学院细胞库。
1.2主要仪器及试剂 反转录试剂盒、RT-PCR试剂盒、组织蛋白提取试剂盒均购自北京百泰克生物技术有限公司;PAK6小干扰RNA(siRNA)和阴性对照序列(siRNA对照)购自上海吉玛生物科技有限公司;二喹啉甲酸(BCA)蛋白浓度检测试剂盒购自上海碧云天生物技术研究所;β-catenin单克隆抗体、c-myc单克隆抗体、活化的含半胱氨酸的天冬氨酸蛋白水解酶(酶切Caspase)-3单克隆抗体均购自美国Cell Signaling Technology ;流式细胞仪购自美国BD。
1.3细胞培养及细胞转染 乳腺癌细胞用含有10%胎牛血清的RPMI1640培养液培养,观察细胞密度生长至90%时,用0.25%的胰蛋白酶消化传代。取培养至对数生长期的乳腺癌细胞,消化后,种植到6孔细胞培养板中(每孔106个细胞)培养,观察细胞密度达到60%时,将细胞培养液换成不含胎牛血清的不完全培养液,放在37℃孵育60 min。用Lipofectamine 2000将PAK6 siRNA组和siRNA对照组转染至乳腺癌细胞中,以未转染组的细胞为对照,放在37℃培养48 h后,Western印迹和qRT-PCR检测细胞中PAK6水平。
1.4qRT-PCR检测PAK6表达 取1.3中转染后48 h的细胞,加入Trizol裂解液混合充分裂解后,加入Trizol裂解液1/5体积的三氯甲烷,剧烈震荡15 s,放在室温环境下静置15 min,12 000 r/min,4℃离心20 min,吸取水相层至EP管中,加入Trizol裂解液1/2体积的异丙醇,混合后,静置10 min,12 000 r/min,4℃离心20 min,加入乙醇洗涤两次,晾干后,用紫外分光光度计检测提取的RNA浓度及纯度。按照反转录试剂盒说明书反转录合成PAK6 cDNA,qRT-PCR试剂盒检测PAK6 mRNA水平。内参基因为甘油醛-3-磷酸脱氢酶(GAPDH)。根据2-△△Ct法计算PAK6水平。△Ct=PAK6 Ct值-GAPDH Ct值。反应程序为:95℃ 3 min,95℃ 15 s,58℃ 1 min重复40个循环,72℃ 7 min。PAK6上游引物为5′-CCGAATTCATGTTTGGGAAGAAAAAGAA-3′,下游引物5′-ATCTCGAGTCGAGAGGCTGCTCTCTGATACTCC-3′。GAPDH上游引物为5′-CGGAGTCAACGGATTTGGTCGTAT-3′,下游引物5′-AGCCTTCTCCATGGTGGTGAAGAC-3′。
1.5Western印迹检测PAK6表达 取1.3中转染后48 h的细胞,提取细胞中的总蛋白,BCA定量检测试剂盒检测蛋白浓度。取蛋白样品,加入等体积的2×加样缓冲液混合后,放在100℃中煮沸5 min使蛋白变性。将变性蛋白样品加入到上样孔中,每孔加入50 μl的蛋白样品,电泳初始电压为80 V,电泳30 min后,120 V至电泳结束。将蛋白凝胶取出后,放在缓冲液中浸泡10 min。将蛋白转印至硝酸纤维素膜上,转膜条件为:100 mA。用5%脱脂奶粉封闭液室温封闭30 min后,加入一抗(800倍稀释,4℃孵育过夜)、二抗(1 000倍稀释,室温下孵育60 min)依次反应后,曝光,以GAPDH为内参,分析蛋白表达水平。
1.6流式细胞术检测细胞凋亡 取转染48 h后的乳腺癌细胞,吸除细胞培养液,胰蛋白酶消化后,收集3×106个细胞,冰预冷的磷酸盐缓冲液(PBS)重悬细胞两次,加入结合缓冲液200 μl重悬细胞,各加入5 μl碘化丙啶(PI)和膜联蛋白(V-FITC),充分混匀后放在避光环境中,室温静置15 min,加入300 μl的缓冲液,用流式细胞仪观察细胞凋亡情况。
1.7细胞克隆实验 取处于对数生长期且转染48 h后的乳腺癌细胞,胰蛋白酶消化后,离心,弃酶消化液,接种至12孔细胞培养板中,每孔加入105个细胞,放在37℃,5% CO2培养箱中培养过夜,待细胞贴壁后,分别用0、2、4、6、8 Gy剂量照射细胞(照射条件为:200 kV,10 mA,剂量率为0.287 Gy/min),培养12 d。肉眼观察细胞克隆形成后,弃上清液,加入PBS洗涤细胞3次,甲醇固定30 min,结晶紫染色20 min,用自来水小心冲洗染液,在室温下干燥。显微镜下观察细胞形成的克隆数,拟合剂量存活曲线。
1.8Western印迹检测细胞中β-catenin、c-myc、酶切Caspase-3蛋白表达 取对数生长期转染后的乳腺癌
细胞,培养48 h后,Western印迹检测细胞中β-catenin、c-myc、酶切Caspase-3蛋白表达。
1.9统计学处理 采用SPSS22.0软件进行方差分析。
2 结 果
2.13组PAK6表达 PAK6 siRNA组细胞中的PAK6 mRNA和蛋白水平均明显低于未转染组(P<0.01)。siRNA对照组PAK6 mRNA和蛋白水平与未转染组相比差异无统计学意义(P>0.05)。PAK6 siRNA能够干扰乳腺癌细胞中PAK6的表达。见图1,表1。
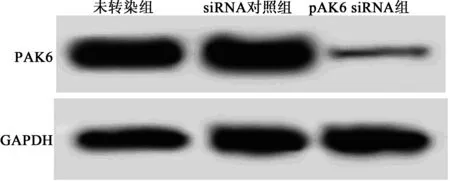
图1 Western印迹检测转染后乳腺癌细胞中PAK6表达
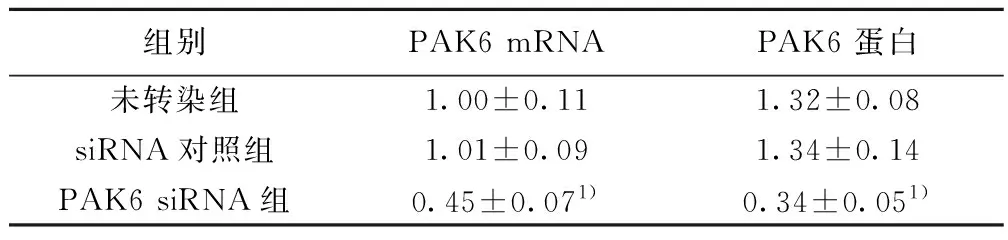
组别PAK6 mRNAPAK6 蛋白未转染组1.00±0.111.32±0.08siRNA对照组1.01±0.091.34±0.14PAK6 siRNA组0.45±0.071)0.34±0.051)
与未转染组相比:1)P<0.01
2.2各组细胞凋亡影响比较 PAK6 siRNA组细胞凋亡率〔(36.41±4.75)%〕与未转染组〔(11.66±1.67)%〕相比明显升高(P<0.01)。siRNA对照组细胞凋亡率〔(11.36±1.85)%〕与未转染组相比差异无统计学意义(P>0.05)。见图2。干扰PAK6 表达能够促进乳腺癌细胞凋亡。
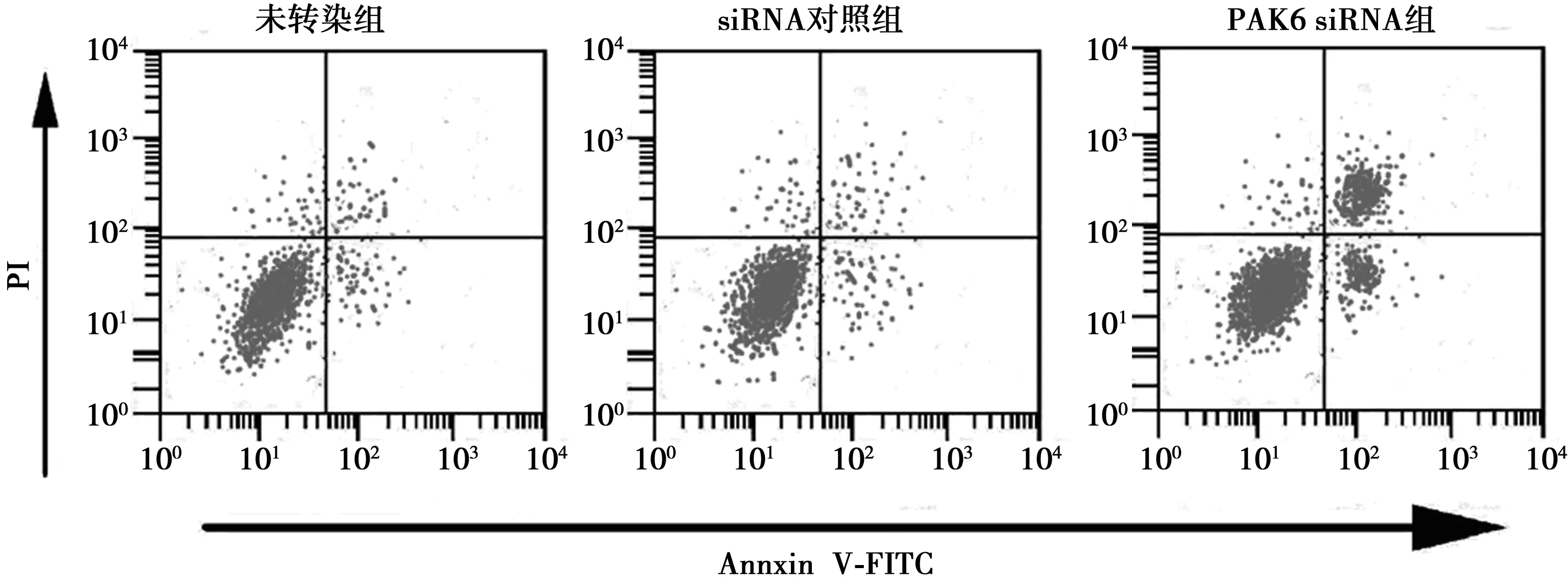
图2 干扰PAK6对乳腺癌细胞凋亡影响
2.3各组细胞放疗敏感性比较 PAK6 siRNA组细胞存活分数(SF2)降低,放疗增敏比为:1.896。干扰PAK6能够增加乳腺癌细胞放疗敏感性。见表2。
2.4各组β-catenin、c-myc、酶切Caspase-3表达 PAK6 siRNA组与未转染组比较,β-catenin、c-myc表达显著降低,酶切Caspase-3表达显著升高(均P<0.01)。见表3,图3。
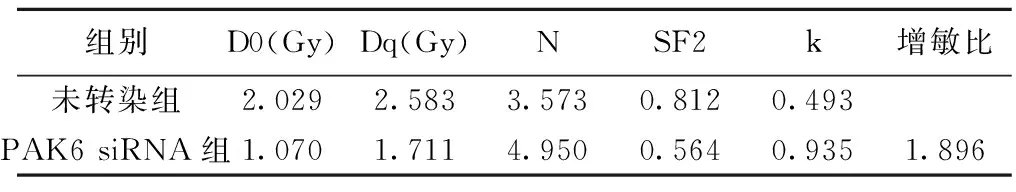
表2 单击多靶模型参数值
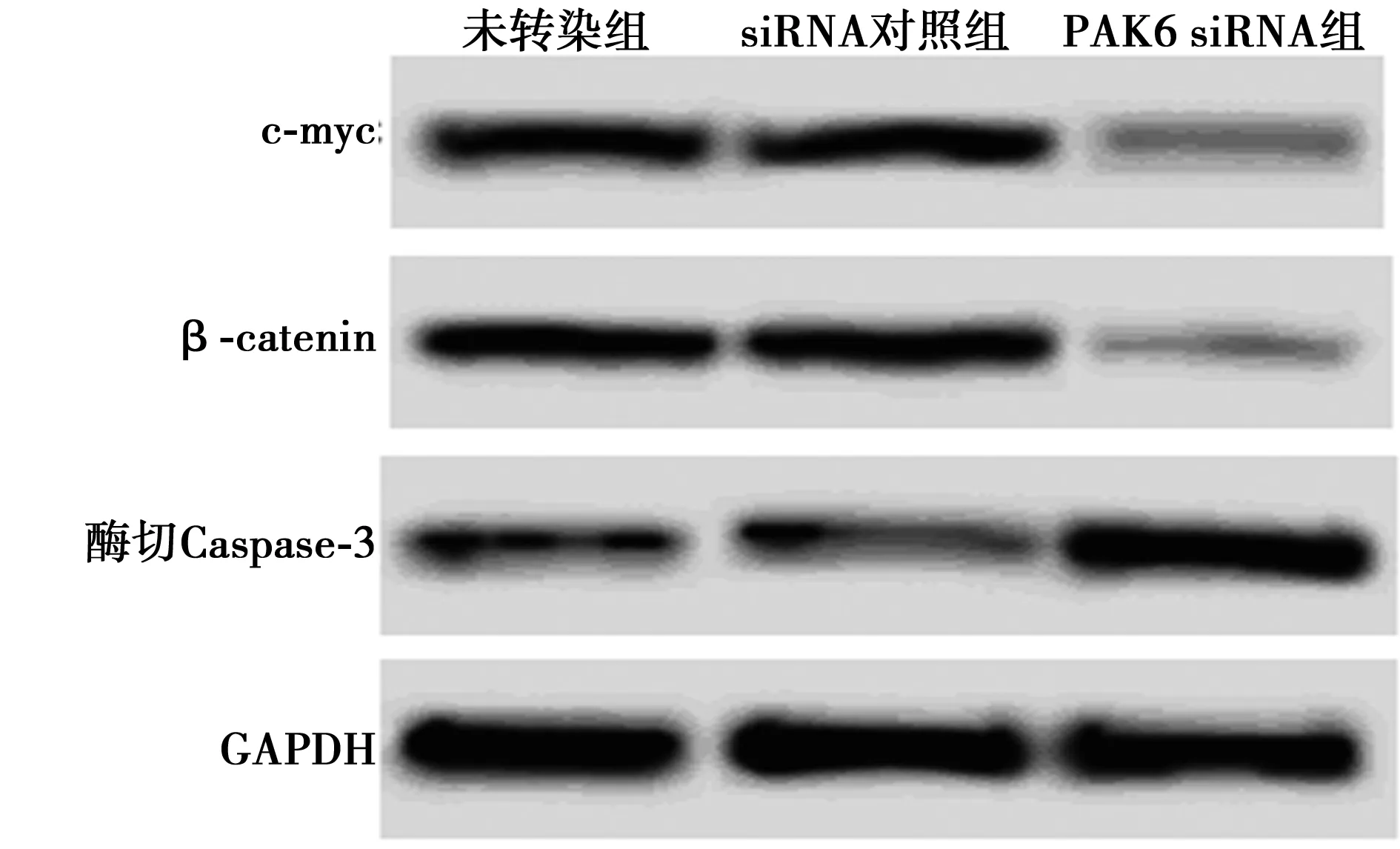
图3 Western印迹检测干扰PAK6后乳腺癌细胞中 β-catenin、c-myc、酶切Caspase-3蛋白表达
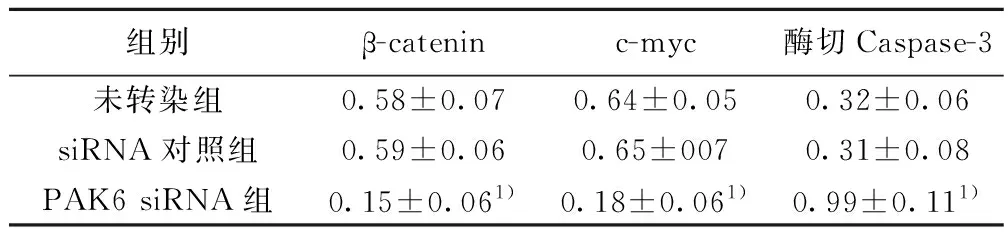
组别β-cateninc-myc酶切Caspase-3未转染组0.58±0.070.64±0.050.32±0.06siRNA对照组0.59±0.060.65±0070.31±0.08PAK6 siRNA组0.15±0.061)0.18±0.061)0.99±0.111)
与未转染组相比:1)P<0.01
3 讨 论
PAK是一种丝氨酸/苏氨酸激酶,哺乳动物含有6个亚型,在细胞形态维持、骨架支撑等方面具有调控作用〔8〕。研究表明,PAK6参与癌症的发展,在癌症组织中表达上调,能够调控细胞的增殖、凋亡等过程〔9〕。Gao等〔10〕在皮肤鳞状细胞癌组织中发现,PAK6 mRNA的表达水平是正常组织的2倍。Chen等〔11〕通过免疫组化发现,PAK6在子宫内膜癌组织和正常内膜组织中的阳性表达率分别为46.88%和22.5%。Mitsudomi等〔12〕通过转染PAK6 siRNA发现,干扰PAK6表达后能够抑制非小细胞肺癌侵袭,细胞侵袭能力约为原来细胞的一半。随着研究的不断深入,在结肠癌、胃癌、原发性肝癌等癌组织中均发现有PAK6表达异常升高〔13〕。本研究在体外以乳腺癌细胞为研究对象,通过转染PAK6小干扰RNA进一步发现,干扰PAK6表达后能够抑制乳腺癌细胞的凋亡,并且能够增加乳腺癌细胞放疗敏感性。温星桥等〔14〕发现,干扰前列腺癌细胞株LNCaP中PAK6表达后能够促进前列腺癌细胞的凋亡。Zhang等〔15〕研究表明,干扰PAK6后能够增加前列腺癌细胞的放疗敏感性,促进前列腺癌细胞凋亡。这些研究结果均说明,干扰PAK6能够促进癌细胞的凋亡,增加癌细胞的放疗敏感性。
细胞凋亡是一个复杂的过程,受到多种基因的严格调控,是一系列反应共同作用的结果。Caspase-3是Caspase蛋白家族的成员之一,是细胞凋亡的执行因子,Caspase-3活化后,酶切Caspase-3表达升高,细胞凋亡进入不可逆阶段〔16〕。研究表明,多种抑癌基因和癌基因能够通过调控Caspase-3的活化而干扰癌细胞凋亡过程〔17〕。本研究结果说明,干扰PAK6能够通过作用于酶切Caspase-3而影响乳腺癌细胞的凋亡过程。
Wnt基因是从乳腺癌小鼠中克隆出来的一种癌基因,能够促进肿瘤的发生,目前发现的有19个亚型,Wnt信号通路是一个较为复杂的信号转导通路,由多个作用位点和多个环节共同组成〔18〕。经典的Wnt信号通路与β-catenin有关,β-catenin能够与其他蛋白分子结合形成复合物,在外界因素的作用下,β-catenin能够调控相关蛋白的表达〔19,20〕。c-myc是Wnt信号通路的下游靶基因,Wnt信号通路激活后能够促进c-myc的表达〔21〕。Cleary等〔22〕在乳腺癌中有Wnt信号通路的异常激活。冬凌草甲素能够调控Wnt信号通路影响乳腺癌MCF-7细胞的生物学特性〔23〕。 本研究结果提示,干扰PAK6能够抑制乳腺癌细胞中Wnt信号通路的激活。
综上所述,干扰PAK6表达能够促进乳腺癌细胞凋亡,增加乳腺癌细胞放疗敏感性,作用机制可能与抑制Wnt信号通路的激活有关。本研究只用了一种乳腺癌细胞,且只在体外进行了相关研究,后续会继续在体内和体外继续研究PAK6对其他几种乳腺癌细胞凋亡及放疗敏感性的影响。
4 参考文献
1Memmi EM,Sanarico AG,Giacobbe A,etal.p63 Sustains self-renewal of mammary cancer stem cells through regulation of sonic hedgehog signaling〔J〕.Proc Nat Acad Sci U S A,2015;112(11):3499-504.
2Owens P,Pickup MW,Novitskiy SV,etal.Inhibition of BMP signaling suppresses metastasis in mammary cancer〔J〕.Oncogene,2015;34(19):2437-49.
3Raja R,Sahasrabuddhe NA,Radhakrishnan A,etal.Chronic exposure to cigarette smoke leads to activation of p21(RAC1)-activated kinase 6(PAK6)in non-small cell lung cancer cells〔J〕.Oncotarget,2016;7(38):61229-45.
4Tian X,Wei Z,Wang J,etal.MicroRNA-429 inhibits the migration and invasion of colon cancer cells by targeting PAK6/cofilin signaling〔J〕.Oncol Rep,2015;34(2):707-14.
5Morse EM,Sun X,Olberding JR,etal.PAK6 targets to cell-cell adhesions through its N-terminus in a Cdc42-dependent manner to drive epithelial colony escape〔J〕.J Cell Sci,2016;129(2):380-93.
6Zapatero A,Morente M,de Vidales CM,etal.The prognostic value of expression of HIF1α.PAK-6.and PSMB4 in intermediate-and high-risk localized prostate cancer patients treated with androgen deprivation and dose escalation radiation therapy〔J〕.Int J Radiat Oncol Biol Phys,2013;87(2):S662-3.
7Holland JD,Klaus A,Garratt AN,etal.Wnt signaling in stem and cancer stem cells〔J〕.Current opinion in cell biology,2013;25(2):254-64.
8Liu W,Liu Y,Liu H,etal.Tumor suppressive function of p21-activated kinase 6 in hepatocellular carcinoma〔J〕.J Biol Chem,2015;290(47):28489-501.
9Liu C,Zhang L,Huang Y,etal.MicroRNA 328 directly targets p21 activated protein kinase 6 inhibiting prostate cancer proliferation and enhancing docetaxel sensitivity〔J〕.Mol Med Rep,2015;12(5):7389-95.
10Gao Y,Wang W,Cao J,etal.Upregulation of AUF1 is involved in the proliferation of esophageal squamous cell carcinoma through GCH1〔J〕.Int J Oncol,2016;49(5):2001-10.
11Chen H,Miao J,Li H,etal.Expression and prognostic significance of p21-activated kinase 6 in hepatocellular carcinoma〔J〕.J Surg Res,2014;189(1):81-8.
12Mitsudomi T,Kosaka T,Endoh H,etal.Mutations of the epidermal growth factor receptor gene predict prolonged survival after gefitinib treatment in patients with non-small-cell lung cancer with postoperative recurrence〔J〕.J Clin Oncol,2005;23(11):2513-20.
13陈宏伟,王春华,李军良,等.肝细胞癌中 p21 活化蛋白激酶 6 的表达及意义〔J〕.临床与实验病理学杂志,2014;30(3):313-7.
14温星桥,李小娟,欧阳斌,等.沉默 PAK6 基因可抑制前列腺癌生长并增强多烯紫杉醇的作用〔J〕.中华实验外科杂志,2008;25(12):1549-51.
15Zhang M,Siedow M,Saia G,etal.Inhibition of p21-activated kinase 6(PAK6)increases radiosensitivity of prostate cancer cells〔J〕.Prostate,2010;70(8):807-16.
16Sam S,Sam MR,Esmaeillou M,etal.Effective targeting survivin.caspase-3 and MicroRNA-16-1 expression by methyl-3-pentyl-6-methoxyprodigiosene triggers apoptosis in colorectal cancer stem-like cells〔J〕.Pathol Oncol Res,2016;22(4):715-23.
17Lin MT,Lin CL,Lin TY,etal.Synergistic effect of fisetin combined with sorafenib in human cervical cancer HeLa cells through activation of death receptor-5 mediated caspase-8/caspase-3 and the mitochondria-dependent apoptotic pathway〔J〕.Tumor Biol,2016;37(5):6987-96.
18Taipaleenmäki H,Farina NH,van Wijnen AJ,etal.Antagonizing miR-218-5p attenuates Wnt signaling and reduces metastatic bone disease of triple negative breast cancer cells〔J〕.Oncotarget,2016;7(48):79032-46.
19李春辉,潘理会,佟晓波,等.Wnt 信号通路的组件蛋白 DKK-1.β-链接素及周期素 D1 蛋白表达与胃癌的相关性〔J〕.中国老年学杂志,2015;35(5):1171-3.
20Wang Y,He L,Du Y,etal.The long noncoding RNA lncTCF7 promotes self-renewal of human liver cancer stem cells through activation of Wnt signaling〔J〕.Cell stem cell,2015;16(4):413-25.
21Zeilstra J,Joosten SPJ,Van Andel H,etal.Stem cell CD44v isoforms promote intestinal cancer formation in Apc(min)mice downstream of Wnt signaling〔J〕.Oncogene,2014;33(5):665-70.
22Cleary AS,Leonard TL,Gestl SA,etal.Tumour cell heterogeneity maintained by cooperating subclones in Wnt-driven mammary cancers〔J〕.Nature,2014;508(7494):113-7.
23Ren CM,Li Y,Chen QZ,etal.Oridonin inhibits the proliferation of human colon cancer cells by upregulating BMP7 to activate p38 MAPK〔J〕.Oncol Rep,2016;35(5):2691-8.
