植物乳杆菌胞外多糖的分离纯化及其抗氧化性研究
2018-06-20杨晨璐马林周蕊饶晴邱朝坤凌洁玉
杨晨璐,马林,周蕊,饶晴,邱朝坤,凌洁玉
(1.武汉设计工程学院,食品与生物科技学院,武汉430205;2.武汉科技大学医学院,武汉430065;3.蒙牛乳制品武汉有限责任公司,武汉430040)
0 引言
乳酸菌胞外多糖(Exopo lysaccharides,EPS)是乳酸菌在生长代谢中分泌到细胞壁外的黏液多糖和荚膜多糖的总称[1]。乳酸菌是公认的益生菌,与其他菌相比安全性更高。乳酸菌的EPS已作为增稠剂、稳定剂等应用到一些食品中[2],可以显著改善或增强乳制品的口感和流变学特性[3],且大量研究证明其具有抗氧化、抑制肿瘤、增强人体免疫力等多种生理功能[3],被公认为安全而有效的食品添加剂。本研究前期从湖北特色发酵食品鲊辣椒中分离出一株植物乳杆菌,并证实其能够有效发酵乳制品与泡菜。本研究对其胞外多糖进行提取纯化,并研究各胞外多糖组分的抗氧化活性,为将该菌开发为乳制品及其他发酵食品的益生菌种提供理论依据。
1 材料与方法
1.1 材料与试剂
植物乳杆菌(Lactobacillus plantarum),由本研究室前期从湖北宜昌某农家自制鲊辣椒中分离。
DEAE Cellulose DE-52,分析纯,东京化成工业株式会社;胃蛋白酶、胰蛋白酶,分析纯,Biosharp;SephadexG-200,分析纯,上海伊卡生物技术有限公司;葡聚糖2 000、葡聚糖T 10、T 20、T 40、T 70、DPPH,分析纯,上海金穗生物科技有限公司;铁氰化钾、浓硫酸、苯酚、无水乙醇、邻二氮菲,分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
722型可见分光光度计,天津市普瑞斯仪器有限公司;754PC型紫外可见分光光度计,上海光谱仪器有限公司;RE-52A旋转蒸发仪器,上海亚荣生化仪器厂;冷冻干燥机,北京博医康实验仪器有限公司。
1.3 方法
1.3.1 植物乳杆菌胞外多糖的提取
采用前期优化的提取方法。取植物乳杆菌菌种接种到MRS液体培养基,厌氧培养24 h,活化3代。取发酵液离心,将上清液50℃减压浓缩至10~20 m L,调节pH值为6.0,加入1/3体积的Sevag试剂(氯仿:正丁醇=4∶1),震荡30 m in后,4 000 r/m in离心15 m in,收集上层水相溶液,重复以上操作至两相之间无蛋白质层为止。随后按体积比1∶3加入90%的乙醇,4℃沉淀14 h,5 000 r/m in离心30 m in,沉淀用丙酮洗涤脱水两次,冷冻干燥得白色粉末即为胞外粗多糖。
1.3.2 胞外多糖含量测定
采用苯酚-硫酸法绘制葡萄糖标准曲线,以标准葡萄糖含量(μg)为横坐标,吸光度值(A490)为纵坐标作图,得回归方程为y=0.007x-0.0156,R2=0.9994。吸取定容后的样品液0.1 m L,同标曲的操作,将测得的吸光度值代入标准曲线,计算样品中的多糖含量。
1.3.3 胞外多糖的纯化
将胞外粗多糖先采用DEAE Cellu lose DE-52分离纯化,分离条件为:上样浓度2 m g/m L,上样体积10m L,先用双蒸馏水洗脱,再用0.5 m ol/L N aC l溶液洗脱,流速为1 m L/m in,每4 m in收集一管,各收集16管。在波长490 nm处以苯酚-浓硫酸法跟踪检测,以号管为横坐标,吸光值为纵坐标做洗脱曲线。分别收集双蒸馏水与N aC l洗脱液下的洗脱峰组分,采用SephadexG-200进一步纯化。用0.1 m ol/LN aC l溶液洗脱,流速为1 m L/m in,每4 m in收集一管,各收集20管。在波长490 nm处以苯酚-浓硫酸法跟踪检测,分别收集洗脱峰组分,PBS透析过夜,冷冻干燥得白色粉末即为纯化后的胞外多糖。
取纯化的中性多糖和酸性多糖分别配成1 m g/m L的溶液,将紫外分光光度计的波长设定在200~400 nm处进行扫描,观察吸收峰的位置。
1.3.4 胞外多糖分子量测定
釆用葡聚糖凝胶过滤法,将蓝色葡聚糖2 000配制的3 m g/m L溶液,上样SephadexG-200凝胶柱,0.1 m oL/L N aC l洗脱,控制流速为1 m L/m in,每5 m in收集一管,共收集20管,在波长490 nm处以苯酚-浓硫酸法跟踪检测,准确测定洗脱体积V0;将葡聚糖标准品T 10、T 20、T 40、T 70配制成3 m g/m L浓度的溶液,分别上样,准确测定其洗脱体积V e。并以V e/V0和相对分子量的对数lgMW作图,获得标准曲线。将未知分子量的多糖样品在相同条件下层析,根据洗脱体积在标准曲线上求得其相对分子质量。
1.3.5 胞外多糖体外抗氧化性研究
1.3.5.1 羟自由基(·OH)清除能力测定
取0.75 mm ol/L邻二氮菲1 m L于试管中,加入2 m L pH 7.4的PBS,1 m L蒸馏水,充分混匀,加入0.75 mm ol/L的 FeSO41 m L,再加 20 mm o l/LH2O21 m L,37℃水浴90 m in,536 nm处测其吸光度,记为Ap;用1 m L蒸馏水代替1 m LH2O2进行上述反应和测定,记为Ab;用样品代替1m L蒸馏水,为As。羟自由基的清除率按式(1)计算:
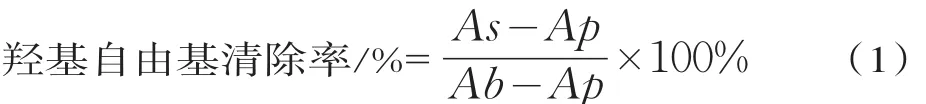
1.3.5.2 超氧阴离子自由基(O2-·)清除能力测定
试管中加入4.5 m LT ris-HC l缓冲溶液(50 mm ol/L)与4.5 m L蒸馏水,混匀后在37℃水浴中保温20 m in,随后立即加入37℃预热过的邻苯三酚(3 mm ol/L)0.5 m L,迅速混匀后导入比色皿中,在波长325 nm处每隔30 s测定一次吸光度,以10 mm o l/LHC l溶液配制空白对照组。计算线性范围内每分钟吸光度的增加。样品管在加入邻苯三酚前,先加入0.5 m L样品液,蒸馏水相应减少0.5 m L,其余同前。超氧阴离子自由基清除率按式(2)计算。
超氧阴离子自由基清除率/%

其中,ΔA 1/ΔA t为邻苯三酚自氧化时的反应速率;ΔA 2/ΔA t为加入样品后邻苯三酚自氧化时的反应速率。
1.3.5.3 DPPH自由基(DPPH·)清除能力测定
取2 m L样品溶液与2 m L 0.2 mm o l/L的DPPH甲醇溶液混合,室温下避光反应30 m in,517 nm处测定吸光值Ai;空白组以等体积甲醇代替DPPH溶液,为A j;对照组以等体积蒸馏水代替样品溶液;为A0。DPPH自由基的清除率按式(3)计算。

1.3.5.4 还原能力测定
采用铁氰化钾法。取1 m L样品于试管中,加入0.2 m o l/L pH 6.6的PBS及1%的铁氰化钾溶液各1 m L,混匀。50℃水浴反应20 m in,骤冷。再加入1 m L5%三氯乙酸,4 000 r/m in离心5 m in,取上清液2.5 m L,加入蒸馏水2.5 m L,0.1%三氯化铁0.5 m L,摇匀,静置反应10m in后,于700 nm处测吸光值。A700nm值越大,代表还原能力越强。
1.3.6 模拟胃肠道环境对胞外多糖抗氧化活性的影响
5.0 g/L的N aC l溶液1 000 m L,加入10 g胃蛋白酶,采用浓HC l调节pH至1.3,即为人工模拟胃液[4]。5.0 g/L的N aC l溶液1 000 m L,加入10 g胰蛋白酶、1.5 g胆盐及1.5 gα-淀粉酶,用0.1 m o l/L的N aOH溶液调节pH至7.0,即为人工模拟肠液[4]。
取1.3.5中抗氧化性最好的胞外多糖组分,配制成0.04mg/m L的溶液,分别与上述模拟胃肠液在37℃作用一定时间,每隔1 h取样一次,测定其抗氧化性指标。
2 结果与分析
2.1 胞外多糖的提取纯化
采用上述优化方法提取植物乳杆菌的胞外多糖,多糖得率为0.279 m g/m L。对提取的粗多糖采用DEAE Cellulose DE-52和Sephadex G-200色谱柱进行分离,结果见图1-图4。
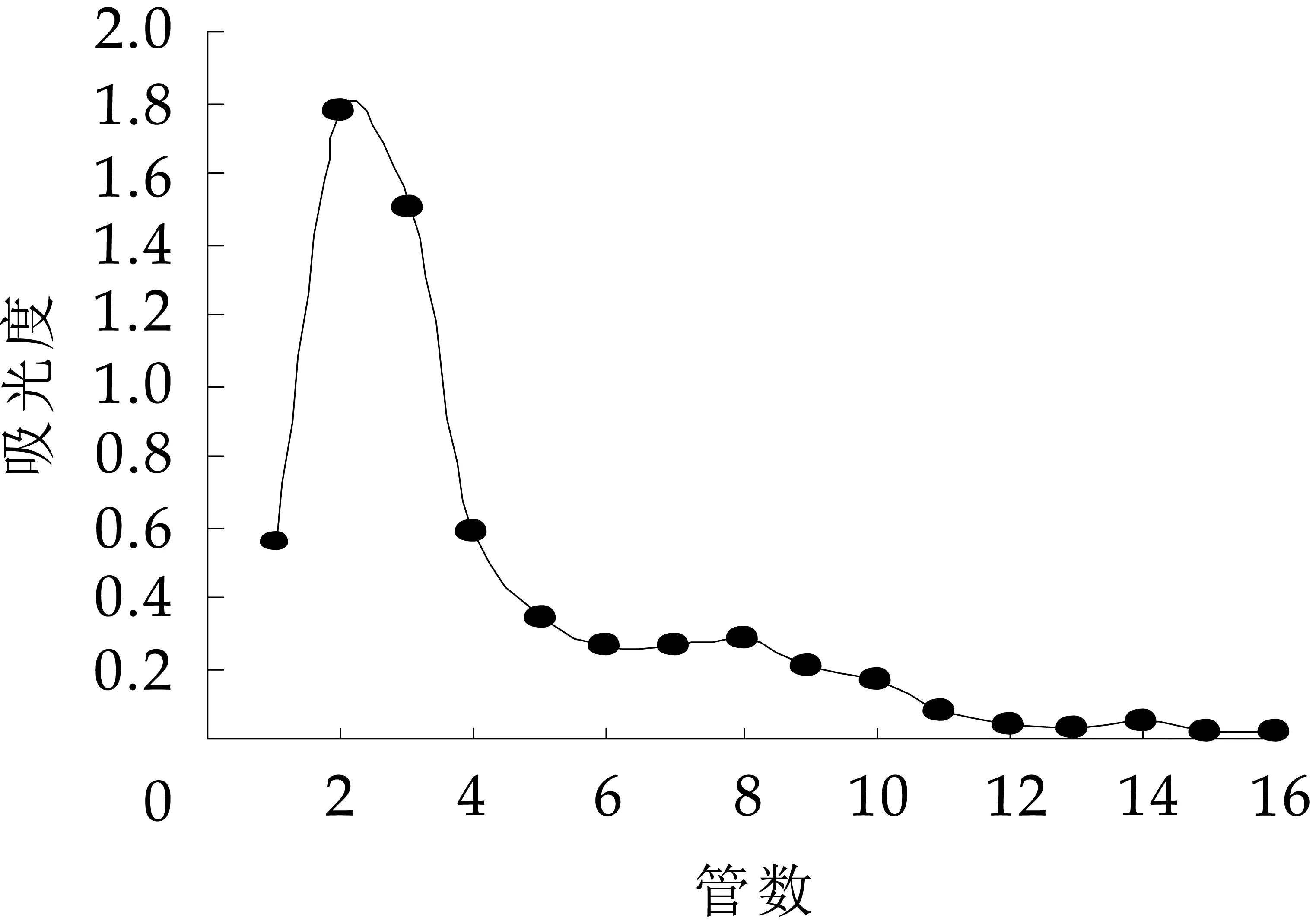
图1 DEAECellulose DE-52柱纯化双蒸水洗脱曲线

图2 DEAECellulose DE-52柱纯化NaCl洗脱曲线

图3 中性多糖Sephadex G-200色谱柱洗脱曲线

图4 酸性多糖ephadex G-200色谱柱洗脱曲线
由图1可知,在DEAE-52分离柱中,利用双蒸水洗脱得到一种中性多糖组分,出现在第1-6管,得率为14.62%。将此中性多糖采用SephadexG-200继续分离,如图3所示,依然得到一个组分,但峰型对称性并不好,有拖尾现象,提示可能并非是单一组分的糖。收集G-200分离后7-10管洗脱液,透析过夜,冷冻干燥即为纯化的中性多糖,命名为EPS-1。
对DEAE Cellulose DE-52色谱柱利用0.1m oL/L的N aC l溶液洗脱,如图2所示,得到两种酸性多糖组分,分别出现在1-4管及8-10管。收集含量较高的酸性多糖组分(1-4管),得率为4.18%,采用SephadexG-200继续分离,如图4所示,得到一个峰值,且峰型对称性良好,说明得到的酸性多糖纯度较高。收集G-200分离后9-11管洗脱液,透析过夜,冷冻干燥即为纯化的酸性多糖,命名为EPS-2。
将纯化所得EPS-1与EPS-2在200~400 nm处进行紫外扫描,如图5、图6所示。在260 nm、280 nm、320 nm波长处均未见吸收峰,表明纯化后的胞外多糖中不含蛋白质、核酸和色素等杂质。
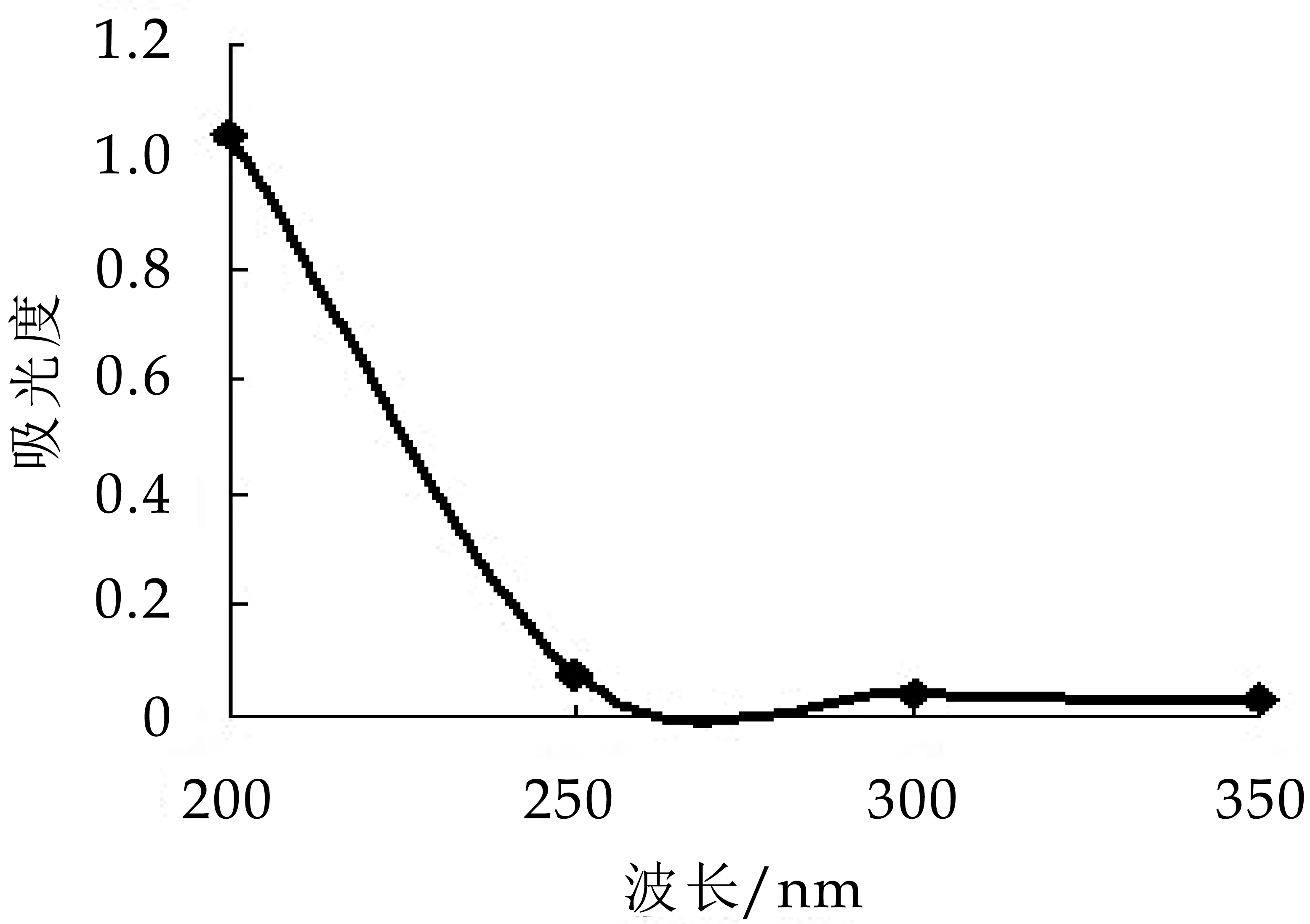
图5 中性多糖紫外扫描

图6 酸性多糖紫外扫描
2.2 胞外多糖的相对分子质量测定
以Ve/V0对相对分子量的对数lgMW作图,可获得标准曲线见图7。根据曲线计算回归方程为:y=-0.54x+5.64,R2=0.9918。将中性多糖EPS-1与酸性多糖EPS-2以同样条件上样和洗脱,测得EPS-1洗脱体积为30 m L,EPS-2洗脱体积为25m L,根据上式计算可得EPS-1相对分子质量为1.26×105,EPS-2相对分子质量为6.76×104。
2.3 各组分胞外多糖体外抗氧化性研究
对纯化的中性多糖EPS-1、酸性多糖EPS-2及未纯化的胞外粗多糖进行自由基清除能力及还原能力测定,结果如图8~图11所示。分析可知,第一,随着浓度增高,三种多糖对各自由基的清除能力及还原能力均呈上升趋势,在0.02~0.1 m g/m L范围内,浓度与抗氧化性正相关,其中浓度对·OH的清除能力影响最明显。研究表明,胞外多糖清除·OH是通过多糖提供氢原子,与·OH结合生成水而实现[4],故清除能力强弱与多糖浓度相关性大。

图7 多糖相对分子质量标准曲线

图8 多糖组分对羟自由基清除能力测定

图9 多糖组分对超氧阴离子自由基清除能力测定

图10 多糖组分对DPPH自由基清除能力测定

图11 多糖组分还原能力测定
第二,对于三种自由基的清除能力以及还原能力,酸性多糖EPS-2均表现出最强,而粗多糖均表现出最弱。已有多项研究表明,乳酸菌的胞外多糖,其酸性多糖较中性多糖具有更高抗氧化活性[5],本研究得到结果与之一致。分析其原因可能与多糖所含糖醛酸数量相关,酸性多糖含有更多的糖醛酸组分,使得分子带有更多的负电荷,使分子形态伸展,降低了自由基攻击分子时的空间位阻,进而加快自由基的猝灭[4],后续需进一步对该酸性多糖进行结构鉴定以确证。粗多糖因为未经纯化,含有较多杂质,阻碍了其抗氧化活性的发挥。故选择酸性多糖EPS-2进行后续模拟胃肠道的研究。
第三,对于体外抗氧化指标的选择性,三种多糖表现出一致性,即对O2-·及DPPH·清除能力最强,最低值即达到94%以上,最高可达98.94%;对·OH的清除能力属于中等,与多糖浓度关系较大;而还原能力表现最弱。已有研究表明,DPPH·是一类较为稳定的自由基,若能将其清除,则表明受试物质具有较强的自由基清除能力,可清除其它自由基如过氧化氢、烷自由基等[4]。本研究中,三种多糖对DPPH·的清除率都可达到90%以上,较目前报道的一些乳酸菌菌株的胞外多糖[6-7],自由基清除能力更强。还原能力是评价抗氧化性的另一个重要指标,本研究表明,该植物乳杆菌的胞外多糖抗氧化活性主要通过清除自由基而实现。故在后续模拟胃肠道研究中,只测定自由基清除的三项指标。
2.4 模拟胃肠道对胞外多糖抗氧化活性的影响
发酵食品中乳酸菌分泌的胞外多糖,随食品一起进入人体胃肠道,要使其能在人体内发挥抗氧化作用,首先其必须对胃液和肠液有较强耐受性。本研究制备人工胃液及肠液,测定模拟胃肠道环境对酸性多糖EPS-2抗氧化性的影响。
2.4.1 人工胃液对EPS-2抗氧化性的影响
由图12可知,酸性多糖EPS-2在人工胃液中作用4 h内,其对DPPH·的清除能力保持稳定,对·OH及O2-·的清除能力随着时间延长而有一定的增加,其中对O2-清除活性增加更为显著。这说明模拟胃液对多糖清除自由基能力具有一定的促进作用。分析其原因,胃液中不含有水解糖类的酶,但是胃液中的酸性环境会导致多糖分子一定程度的水解,水解后的小分子糖空间位阻小,更容易与自由基反应而使之猝灭。有研究表明,多糖经水解或辐射后得到的小分子多糖,其抗氧化活性明显提高[8]。
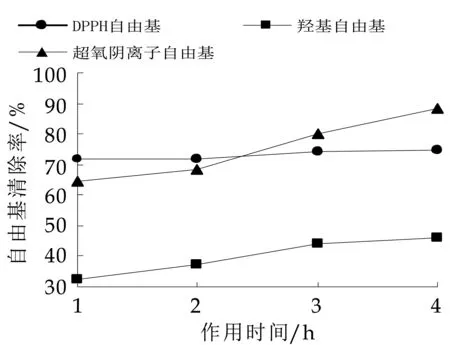
图12 人工胃液对EPS-2抗氧化性的影响
2.4.2 人工肠液对EPS-2抗氧化性的影响
由图13可知,酸性多糖EPS-2在与人工肠液作用5 h内,其DPPH·的清除能力保持稳定,而对·OH及O2-·的清除能力随作用时间延长有一定量增加,其中对·OH清除活性增加更为显著。肠道中含有α-淀粉酶,推测该酶能对该酸性多糖EPS-2产生部分水解,生成一些小分子的多糖,更容易与自由基发生反应,特别是能提供更多的氢原子,与·OH结合而实现对其的清除。肠道是受氧化损伤较严重的部位,由研究可以推测,该酸性多糖可以停留于肠道中,并且在肠道中进行一定分解,从而较好发挥其抗氧化作用,保护肠道黏膜。
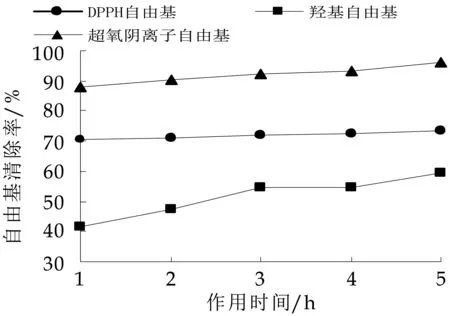
图13 人工肠液对EPS-2抗氧化性的影响
3 结论
本研究对一株分离自鲊辣椒的植物乳杆菌进行胞外多糖的提取纯化,得到一种中性多糖EPS-1和一种酸性多糖EPS-2,测得其相对分子质量分别为1.26×105、6.76×104。
体外抗氧化实验表明:无论对于·OH、O2-·及DPPH·自由基的清除能力,还是还原能力,酸性多糖EPS-2均表现出最高活性,而粗多糖均表现出最低活性;三种多糖对O2-·及DPPH·清除能力相对较强,对·OH的清除能力中等,而还原能力均较低;随着三种胞外多糖浓度的增大,其抗氧化性也随之增加,浓度对·OH的清除活性影响最大。
采用酸性多糖EPS-2进行人工模拟胃肠道实验,结果表明,EPS-2对DPPH·的清除能力在人工胃液及人工肠液中均保持稳定;对·OH及O2-·的清除能力随着人工胃液及肠液作用时间延长,均有一定增强。
总体而言,相比已经报道的大多数乳酸菌胞外多糖,该株植物乳杆菌的胞外多糖具有更高的自由基清除能力,且其酸性多糖不被人体消化道所消化,而只在胃肠道有一定降解,形成更多具有较好抗氧化活性的小分子多糖,发挥其抗氧化作用而保护胃肠道黏膜,具有良好生物学活性。本研究为将此株植物乳杆菌开发为乳制品及其他发酵食品的益生菌种奠定了基础。
[1]王英,周剑忠,黄开红,等.益生菌干酪乳杆菌FM 10-3产胞外多糖培养条件的优化[J].中国乳品工业,2014,42(2):9-17.
[2]邓凯波.乳酸菌胞外多糖的功能及在食品工业中的应用[J].食品安全导刊,2009(7):49-50.
[3]邸维,张兰威,易华西,等.乳酸菌胞外多糖结构及其功能多样性的研究进展[J].中国乳品工业,2017,45(5):32-37.
[4]李景艳.乳酸菌胞外多糖的抗氧化活性及其结构[D].无锡:江南大学,2013.
[5]LIU JUN,LUO JIANGUANG,YEHONG,et al.Production,characterization and antioxidant activities in vitro of exopolysaccharides from endophytic bacterium Paenibacillus polymyxa EJS-3[J].Carbohydrate Polymers,2009,78(2):275-281.
[6]KE CHUNLIN,QIAO DELIANG,GAN DAN,et al.Antioxidant acitivity in vitro and in vivo of the capsule polysaccharides from Streptococcusequi subsp.zooepidemicus[J].Carbohydrate Polymers,2009,75(4):677-682.
[7]PAN YINGM ING,WANG KAI,HUANG HENGSHAN,et al.Antioxidantactivity ofmicrowave-assisted extractof longan(Dimocarpus Longan Lour.)peel[J].Food Chem istry,2008,106(3):1264-1270.
[8]MONDALS,CHAKRABORTY I,PRAMANIK M,etal.Structural studiesofwater-soluble polysaccharidesof an ediblemushroom,Term itomyces eurhizus.A reinvestigation[J].Carbohydrate Research,2004,339(6):135-1140.
