沉默Bcl2、Bak1基因表达对成骨肉瘤MG-63细胞增殖及成骨能力的影响
2018-06-15黄宏兴柴爽黄红万雷王吉利广州中医药大学附属骨伤科医院广州5040广州中医药大学
黄宏兴,柴爽,黄红,万雷,王吉利(广州中医药大学附属骨伤科医院,广州5040;广州中医药大学)
骨质疏松症是一种以骨量减少、骨微结构损坏,导致骨脆性增加,易于发生骨折为特征的全身性骨骼疾病。近年来越来越多的研究认为,成骨细胞凋亡及其功能异常在骨质疏松症的发病中具有重要作用[1~5]。细胞凋亡途径主要包括外源性途径和内源性途径,内源性途径主要通过Bcl2家族蛋白调节线粒体外膜通透性实现细胞凋亡,其中Bcl2属于抗凋亡蛋白、Bak1属于促凋亡蛋白[6]。本课题组前期研究发现,骨质疏松症患者椎板旁骨骼肌线粒体通透转换孔活性增强、股骨粗隆间部松质骨Bak1表达明显升高,Bcl2表达则明显降低[7]。成骨细胞具有活跃的分泌功能,能合成和分泌骨基质中的多种有机成分,对骨生长有重要作用。研究表明,绝经后骨质疏松患者以及脊髓损伤后骨质疏松动物模型来源的成骨细胞活力均下降[8]。2017年3~6月,本研究采用腺病毒介导Bcl2、Bak1 shRNA单独或共转染成骨肉瘤MG-63细胞,并观察其对细胞增殖及成骨功能的影响,以期为进一步研究成骨细胞凋亡在骨质疏松症中的作用提供依据。
1 材料与方法
1.1 材料 细胞:MG-63细胞由中国科学院上海细胞所细胞库提供。重组腺病毒载体:参照本课题组前期研究设计并筛选出沉默效率最高的Bcl2、Bak1 shRNA,并分别构建重组腺病毒载体。主要试剂:DMEM培养基、胎牛血清、Pen/Strep购自美国Gibco公司,噻唑蓝(MTT)检测试剂盒购自美国Sigma公司,碱性磷酸酶(ALP)活性检测试剂盒购自上海碧云天生物技术有限公司,抗骨形态发生蛋白4(BMP4)抗体、抗骨桥蛋白(OPN)抗体、抗Runt相关转录因子2(Runx2)抗体、抗TNF-α抗体均购自美国Abcam公司,羊抗兔二抗购自美国Jackson公司。主要仪器:细胞培养箱购自法国NaPCO公司,酶标仪购自美国Thermo公司,Aria Ⅱ流式细胞仪购自美国BD公司,Mini-PROTEAN Tetra电泳仪、Mini-Trans Blot蛋白转印仪、ChemiDoc MP凝胶成像系统购自美国Bio-Rad公司。
1.2 细胞分组处理 收集对数生长期MG-63细胞,制成密度为1×104/mL的细胞悬液。将细胞悬液接种于96孔板,每孔200 μL,置于37 ℃、5% CO2及饱和湿度条件下培养24 h。将细胞随机分为shBcl2组、shBak1组、共转染组和空白对照组,每组设置3个复孔。shBcl2组、shBak1组、空白对照组分别单独转染shBcl2、shBak1重组腺病毒和空载腺病毒,感染复数(MOI)=50,共转染组采用同样的方法共转染shBcl2、shBak1重组腺病毒。
1.3 相关指标观察
1.3.1 细胞增殖能力 采用MTT法。取1.2中转染48 h的各组细胞,弃旧培养基补充新鲜培养基,同时每孔分别加入5 mg/mL MTT溶液10 μL,于细胞培养箱内培养4 h后终止培养。小心吸去孔内培养基,每孔加入200 μL DMSO,室温摇床低速振荡10 min,使结晶物充分溶解。于酶标仪上测定490 nm波长处的吸光度(A)值,计算细胞增殖率。细胞增殖率=A实验孔/A正常对照孔×100%。
1.3.2 ALP活性 采用对硝基苯磷酸盐法。收集对数生长期的MG-63细胞,制成密度为1×105/mL的细胞悬液。将细胞悬液接种于6孔板中,每孔2 mL。常规培养24 h后,参照1.2的方法进行分组处理。各组转染48 h后弃旧培养基,消化收集细胞,提取细胞总蛋白,考马斯亮蓝蛋白定量。按照ALP活性检测试剂盒说明书进行操作,于酶标仪上测定405 nm或400~415 nm波长处的A值。由标准曲线计算的A值×稀释倍数(2.5)/蛋白浓度(μg/μL)计算ALP活性。
1.3.3 成骨相关蛋白表达 采用Western blotting法。各组转染48 h后,弃旧培养基,消化收集细胞,1 000 r/min离心5 min,弃上清。预冷PBS洗涤细胞沉淀2次,向细胞沉淀中加入20 μL RIPA(含有0.2 μL PMSF)裂解液,置于冰上并用枪头吹打,使细胞充分裂解30 min。4 ℃条件下12 000 r/min离心30 min,小心转移上清到新的预冷EP管中,- 20 ℃保存备用。BSA法测定总蛋白含量,计算含40 μg蛋白的溶液体积即为上样量,在蛋白标本中加入适当体积的蛋白上样缓冲液,沸水浴5 min。10% SDS-PAGE凝胶电泳及转膜,分别加入BMP4、OPN、Runx2、TNF-α一抗,4 ℃孵育过夜。TBST室温下脱色摇床上洗3次(每次5 min),加入二抗(1∶3 000),室温下孵育30 min。ECL法显色,图像处理软件分析各条带的灰度值。以β-actin为内参,以目的蛋白与内参蛋白灰度值的比值计算蛋白相对表达量。
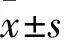
2 结果
2.1 各组细胞增殖率、ALP活性比较 shBcl2组细胞增殖率、ALP活性均低于空白对照组,shBak1组细胞增殖率、ALP活性均高于空白对照组(P均<0.01)。空白对照组与共转染组细胞增殖率、ALP活性比较均无统计学差异(P均>0.05)。见表1。
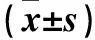
表1 各组细胞增殖率、ALP活性比较
注:与空白对照组比较,*P<0.01;与shBcl2组比较,#P<0.05,▲P<0.01;与shBak1组比较,△P<0.01。
2.2 各组成骨相关蛋白相对表达量比较 shBcl2组细胞BMP4、OPN、Runx2相对表达量均低于空白对照组,TNF-α相对表达量高于空白对照组(P均<0.05)。shBak1组细胞BMP4、OPN、Runx2相对表达量均高于空白对照组,TNF-α相对表达量低于空白对照组(P均<0.01)。空白对照组与共转染组细胞BMP4、OPN、Runx2、TNF-α相对表达量比较均无统计学差异(P均>0.05)。见表2。
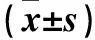
表2 各组成骨相关蛋白相对表达量比较
注:与空白对照组比较,*P<0.01,#P<0.05;与shBcl2组比较,▲P<0.01;与shBak1组比较,△P<0.01。
3 讨论
Bcl2家族蛋白根据所含功能域的不同可分为三大类:抗凋亡亚家族(Bcl2、Bcl-XL、Mcl-1等),促凋亡亚家族(Bax、Bak)和仅含BH3结构域的BH3-only亚家族(Bid、Bad、Bim等),家族成员之间可形成同源二聚体和异源二聚体,其中抗凋亡与促凋亡成员之间形成的异源二聚体可抑制促凋亡蛋白的生物活性[9],它们之间的平衡决定了细胞对凋亡刺激的敏感性[10]。早期研究多认为,Bax对抗凋亡蛋白Bcl-2和Bcl-XL具有较强亲和力,而Bak1对抗凋亡蛋白Mcl-1和Bcl-XL具有较强的亲和力[11,12]。随着研究的深入,发现Bak1蛋白与Bcl2的结合比其与Bcl-XL的结合更紧密,而且Bcl2下调能诱导Bak依赖性细胞凋亡[13]。在凋亡刺激诱导下,BH3-only亚家族蛋白被激活并转移到线粒体上,与抗凋亡蛋白(Bcl2、Bcl-XL)结合,释放促凋亡蛋白(Bax、Bak),或直接激活促凋亡蛋白(Bax、Bak),在线粒体上形成蛋白孔道,导致细胞色素C从线粒体中释放而诱导细胞凋亡[14]。
为进一步研究细胞凋亡对骨形成的影响,本课题组设计并筛选出具备最佳沉默效率的Bcl2、Bak1 shRNA,构建重组腺病毒载体。本研究采用shBcl2、shBak1重组腺病毒载体单独或共转染MG-63细胞,发现shBcl2组细胞增殖率、成骨细胞的早期分化标志ALP活性均低于空白对照组;shBak1组细胞增殖率、ALP活性均高于空白对照组;这可能与RNA干扰使Bcl2表达减少,Bak1更多地形成同源二聚体,从而诱导成骨细胞内源性凋亡有关。本研究中空白对照组与共转染组细胞增殖率、ALP活性比较均无统计学差异,在一定程度上说明在成骨细胞中干扰Bak1可以抵消干扰Bcl2的作用,与其在淋巴细胞[12]中的相关研究结果一致。
成骨细胞的主要功能包括产生胶原纤维和无定形基质形成类骨质,分泌骨钙蛋白、骨黏连蛋白和骨唾液酸蛋白等非胶原蛋白,促进骨组织的矿化。成骨细胞表面存在多种骨吸收刺激因子的受体,能分泌一些细胞因子,调节骨组织形成和吸收。BMP4对于骨骼的发育和重塑至关重要[16]。OPN作为成骨细胞成熟阶段的特异性标志物之一[16],在骨改建中维持骨基质矿化和骨吸收平衡,介导骨组织细胞与骨基质间的桥接,可以促进骨矿化[17]。Runx2在成骨分化过程中具有关键性作用,能够通过调控成骨细胞特异性细胞外基质蛋白基因表达和成骨细胞周期,参与成骨细胞的分化过程[18]。以上四种蛋白均与成骨细胞成熟分化及骨形成密切相关。TNF-α是一种炎性细胞因子,能直接作用于破骨前体细胞,并促进其分化;还可通过诱导成骨细胞表达RANKL间接促进破骨细胞分化,增强骨吸收,对成骨细胞功能也有直接影响。本研究结果显示,shBcl2重组腺病毒载体转染可降低细胞BMP4、OPN、Runx2蛋白相对表达量,提高TNF-α相对表达量,shBak1重组腺病毒载体转染则产生相反作用;说明沉默Bcl2不仅可促进成骨细胞凋亡,还可影响成骨细胞成熟及分化。本研究中共转染组各成骨相关蛋白表达与空白对照组比较均无统计学差异,进一步说明在成骨细胞中下调Bak1可以抵消下调Bcl2的作用,消除下调Bcl2诱导细胞凋亡对成骨相关蛋白的影响。
综上所述,沉默Bcl2基因表达可抑制MG-63细胞增殖及成骨能力,沉默Bak1基因则具有相反的作用;Bcl2与Bak1共同参与细胞凋亡及成骨过程。本研究为从成骨细胞凋亡角度干预骨代谢、防治骨质疏松症提供了新的实验方法和思路。
参考文献:
[1] Harada S, Rodan GA. Control of osteoblast function and regulation of bone mass[J]. Nature, 2003,423(6937):349-355.
[2] Chang MK, Raggatt LJ, Alexander KA, et al. Osteal tissue macrophages are intercalated throughout human and mouse bone lining tissues and regulate osteoblast function in vitro and in vivo[J]. J Immunol, 2008,181(2):1232-1244.
[3] Teti A. Bone development: overview of bone cells and signaling[J]. Curr Osteoporos Rep, 2011,9(4):264-273.
[4] Jiang SD, Yan J, Jiang LS, et al. Down-regulation of the Wnt, estrogen receptor, insulin-like growth factor-I, and bone morphogenetic protein pathways in osteoblasts from rats with chronic spinal cord injury[J]. Joint Bone Spine, 2011,78(5):488-492.
[5] Gunaratnam K, Vidal C, Boadle R, et al. Mechanisms of palmitate-induced cell death in human osteoblasts[J]. Biol Open, 2013,2(12):1382-1389.
[6] Youle RJ, Strasser A. The BCL-2 protein family: opposing activities that mediate cell death[J]. Nat Rev Mol Cell Biol, 2008,9(1):47-59.
[7] 李颖,白波,吴伙燕,等.骨骼肌线粒体通透转换孔在骨质疏松症中的变化[J].中华实验外科杂志,2011,28(7):1071-1073.
[8] Jiang SD, Yang YH, Chen JW, et al. Isolated osteoblasts from spinal cord-injured rats respond less to mechanical loading as compared with those from hindlimb-immobilized rats[J]. J Spinal Cord Med, 2013,36(3):220-224.
[9] Wang K, Gross A, Waksman G, et al. Mutagenesis of the BH3 domain of BAX identifies residues critical for dimerization and killing[J]. Mol Cell Biol, 1998,18(10):6083-6089.
[10] Siddiqui WA, Ahad A, Ahsan H. The mystery of BCL2 family: Bcl-2 proteins and apoptosis: an update[J]. Arch Toxicol, 2015,89(3):289-317.
[11] Cheng EH, Sheiko TV, Fisher JK, et al. VDAC2 inhibits BAK activation and mitochondrial apoptosis[J]. Science, 2003,301(5632):513-517.
[12] Willis SN, Chen L, Dewson G, et al. Proapoptotic Bak is sequestered by Mcl-1 and Bcl-xL, but not Bcl-2, until displaced by BH3-only proteins[J]. Genes Dev, 2005,19(11):1294-1305.
[13] Dai H, Meng XW, Lee SH, et al. Context-dependent Bcl-2/Bak interactions regulate lymphoid cell apoptosis[J]. J Biol Chem, 2009,284(27):18311-18322.
[14] Wei MC, Zong WX, Cheng EH, et al. Proapoptotic BAX and BAK: a requisite gateway to mitochondrial dysfunction and death[J]. Science, 2001,292(5517):727-730.
[15] Kondo A, Otsuka T, Kuroyanagi G, et al. Resveratrol inhibits BMP-4-stimulated VEGF synthesis in osteoblasts: suppression of S6 kinase[J]. Int J Mol Med, 2014,33(4):1013-1018.
[16] 符策广,刘洁,夏海斌.骨桥蛋白的生物学特性及在骨改建中的作用[J].临床口腔医学杂志,2012,28(8):506-508.
[17] Chen HT, Tsou HK, Chang CH, et al. Hepatocyte growth factor increases osteopontin expression in human osteoblasts through PI3K, Akt, c-Src, and AP-1 signaling pathway[J]. PLoS One, 2012,7(6):e38378.
[18] 唐欢,许海甲,侯煜东,等.Runx2基因对骨代谢调控的研究进展[J].中国骨质疏松杂志,2014,23(12):1501-1505.
