异源染色体附加对普通小麦氮磷吸收能力和利用效率的影响
2018-06-13刘彩云李慧娟杜莹莹张书良胡银岗
刘彩云,李慧娟,杜莹莹,张书良,刘 鹏,胡银岗,3
(1.德州市农业科学研究院,山东德州 253011; 2.西北农林科技大学农学院/旱区作物逆境生物学国家重点实验室,陕西杨凌 712100; 3.中国旱区节水农业研究院,陕西杨凌 712100)
化肥的使用极大地提高了小麦产量,但是片面追求高产而过量施用肥料,不但造成了资源的巨大浪费,还引起了一系列环境问题。在农业生态系统中,施用的氮肥只有小部分被作物吸收,超过50%的氮被淋洗到土壤中[1]。磷肥的当季利用率只有15%~30%,大部分的磷被碱性土壤中的钙盐及酸性土壤中的铁、铝等的氢氧化物固定或被土壤胶体吸附,难以被作物再次吸收利用[2]。相对于单纯地依赖于肥料的施用,培育氮、磷高效的作物品种是提高养分吸收和利用效率的根本途径,而氮、磷高效小麦种质资源的发掘是小麦养分高效育种的基础。
尽管普通小麦中存在着丰富的氮、磷效率的基因型变异,但是长期在人工环境下的选择育种,使得小麦的基因库日趋狭窄,一些养分高效利用的相关基因可能已经丢失[3]。小麦的野生近缘种属和原始祖先种有着丰富的遗传多样性,常比小麦更能适应贫瘠恶劣的环境[4]。Gorny等[5]研究了小麦的野生近缘种和原始祖先种苗期的氮、磷效率,发现与普通小麦相比,T.monococcum、Ae.tauschii、Ae.speltoides和Ae.sharonensis等种质具有更发达的根系,耐养分胁迫的能力更强。柳 鹏等[6]根据磷效率和地上部干物质积累量筛选出3份人工合成小麦种质,表明山羊草属含有与磷高效有关的基因。
通过远缘杂交和染色体工程创造的携带有外源染色体或者遗传物质的种质资源,如附加系等,也继承了小麦近缘种属耐瘠薄的特点。通过对成套的小麦异附加系的研究发现,黑麦的1R、2R和7R染色体,Ag.elongatum的4E和6E染色体携带有耐低磷胁迫的基因[7-8]。Wang等[9]通过对部分小麦异附加系的磷效率进行鉴定,筛选出9个高磷效率的种质。赵化田等[10]通过进行耐低氮基因型的苗期水培筛选试验,发现携带冰草、黑麦、偃麦草等外源血统的材料氮利用效率较高。由此可见,小麦近缘种属异源染色体种质含有丰富的氮、磷高效基因及优良性状,可应用于小麦氮、磷高效的遗传改良,因此对氮、磷高效异源染色体种质的筛选尤为重要。
本研究通过苗期水培试验,以中国春为对照,对43份小麦异源染色体附加系的氮、磷吸收能力和利用效率进行了评价,以期筛选出氮、磷高效种质,为小麦养分高效的遗传研究和育种应用奠定基础。
1 材料与方法
1.1 供试材料
供试材料为43个中国春背景的普通小麦异附加系(经鉴定,其染色体组成均为2n=44)及其共同受体亲本中国春,附加的染色体来自赖草属(Leymus)、冰草属(Agropyron)、山羊草属(Aegilops)、大麦属(Hordeum)、黑麦属(Secale)共5个小麦近缘属。
1.2 试验方法
1.2.1 温室水培试验
水培试验在温室中进行,培养所用溶液为改良的Hoagland营养液。氮素设置高氮(HN)、中氮(MN)和低氮(LN)3个水平;磷素设置中磷(MP)和低磷(LP)2个水平[11]。试验共6个处理,即HNMP,MNMP,LNMP,HNLP,MNLP及LNLP。氮以NH4+和NO3-的形式提供,磷以H2PO4-的形式提供,不同处理NH4++NO3-及H2PO4-的供给浓度见表1。试验采用随机区组设计,每个处理设置3次重复。
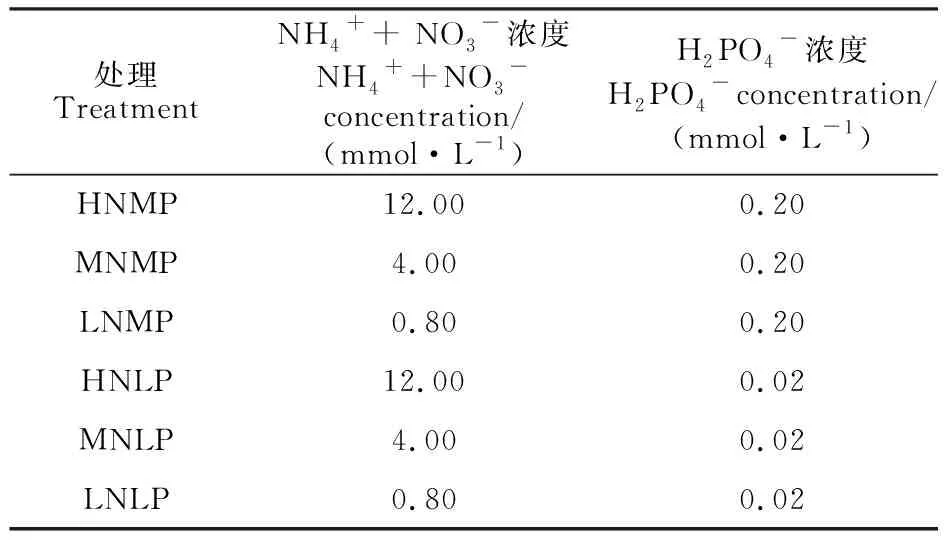
表1 不同处理的氮、磷浓度设置Table 1 The concentration of N and Pused in different treatments
选取大小一致的种子,75%酒精消毒1 min,放入铺有湿润滤纸的培养皿中催芽。待萌发幼苗的胚芽鞘长到3~4 cm时,每份种质选取长势一致的3株幼苗,将其固定到泡沫塑料板(50×40 cm)上的播种孔中。然后将栽满幼苗的泡沫塑料板放入盛有60 L营养液的黑色塑料根箱中(50×40×30 cm)。用空气泵向营养液中通气,以形成健康的根系。培养期间,温度设置为白天25 ℃,夜晚15 ℃,培养时间为4周。
1.2.2 性状测量
收获前,用叶绿素仪SPAD-502活体测定幼苗主茎最顶端已完全展开叶片的相对叶绿素含量SPAD(Soil and Plant Analyzer Development)值。培养4周后,分别收获茎叶和根系部分。测量苗高、最大根长,统计叶片数。收获的根系用无菌ddH2O冲洗3~4遍,彻底冲掉附着在根系上的离子。然后将样品放入烘箱,105 ℃杀青15 min,80 ℃烘干至恒重。称量获得茎叶干重和根干重,计算总干重和根冠比。
将供试材料干样磨成粉,过0.25 cm筛子,测定氮、磷含量。测定时称取一定量的样品,经H2SO4与H2O2消解,用凯氏定氮法测定全氮含量[12],用钒钼黄比色法测定全磷含量[13]。
1.2.3 数据分析
氮(磷)吸收能力用植株吸氮(磷)总量(uptake amount,UpA)来表示,其计算公式如下[14]:
UpA=SDW×CS+RDW×CR
式中,SDW为茎叶干重;RDW为根干重;CS为茎叶中的氮(磷)浓度;CR为根系中的氮(磷)浓度。
氮/磷利用效率(utilization efficiency,UtE)的计算公式如下[9,14]:
UtE=SDW/UpA
式中,SDW为茎干重;UpA为植株氮(磷)吸收总量。
各测量性状不同处理间的比较和分析采用Microsoft Excel 2010以及SAS 8.1软件进行。
2 结果与分析
2.1 不同氮、磷处理下的植株表型变异
同中氮中磷处理相比,各处理下大多数小麦异附加系出现苗高降低、根长缩短以及次生根数目减少等症状。低磷胁迫下(高氮低磷、中氮低磷、低氮低磷),附加系老叶开始变黄,并且从叶尖处逐渐萎蔫;根系呈现深褐色,形成大量根毛。
不同供氮处理下,各测量性状之间差异显著(表2)。除根冠比外,所有测量性状的最低值均出现在高氮处理,表明过量氮会抑制小麦整个植株的生长。低氮处理的苗高、茎干重和总干重显著低于中氮处理;根长、叶数、SPAD值及根冠比显著高于中氮处理。不同磷水平下,各测量性状之间的差异也达到显著水平(表2)。茎叶干重、根冠比在低磷水平下较中磷水平显著增加,其余所测性状在低磷水平下均显著降低。氮、磷互作下,除根冠比外,各性状的最低值均出现在高氮低磷处理。小麦异附加系对低磷和低氮胁迫的表现不同:除根冠比外,其余性状值在中氮低磷处理下均显著低于低氮中磷处理,根冠比的增加也主要源于茎叶干重的显著降低;同中氮低磷相比,低氮低磷只显著增加了根长,表明缺磷比缺氮对小麦异附加系的生长影响更大。
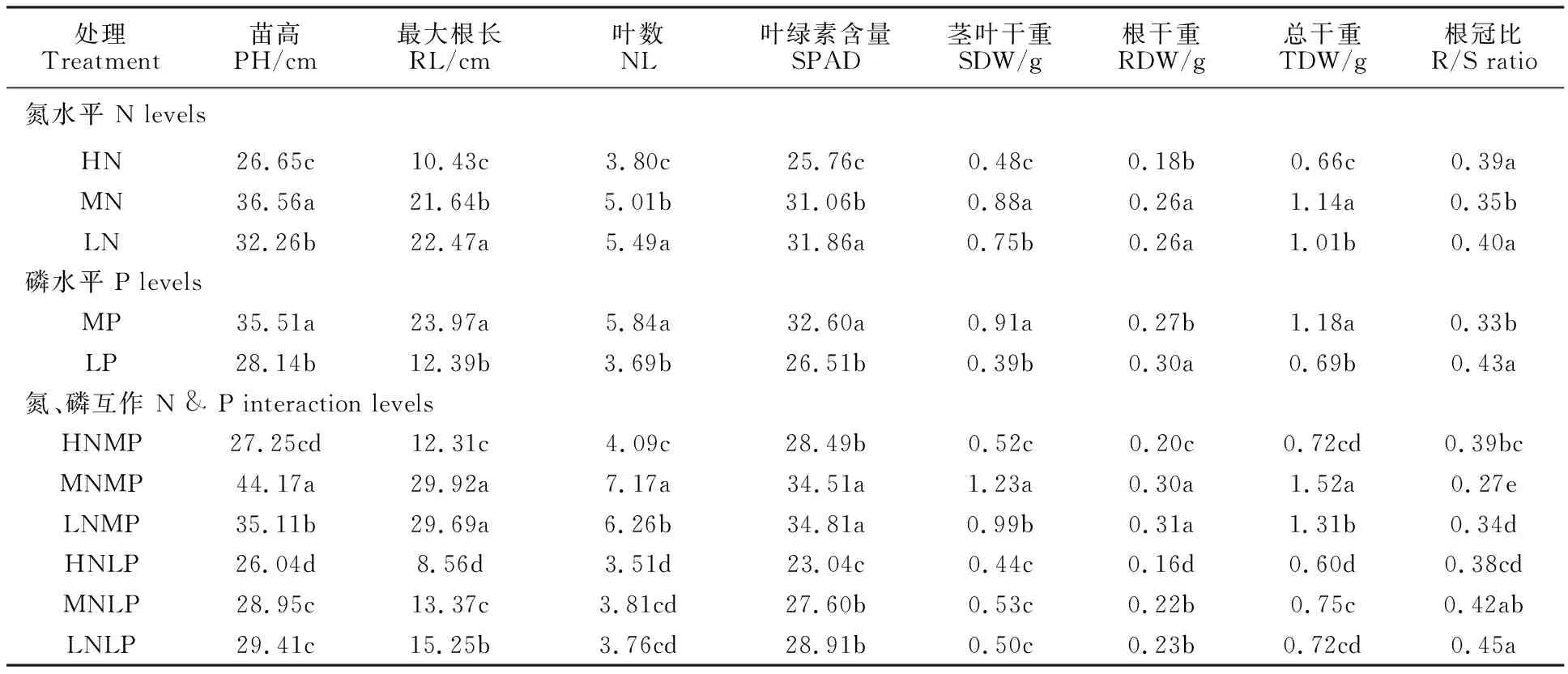
表2 不同氮、磷处理对小麦异附加系表型性状的影响Table 2 Effect of different N and P levels on the phenotypic traits of wheat addition lines
表中数据为每一性状的平均值;同列数据后的不同字母表示在0.05水平上差异显著。
Each value represents mean value.Different letters in same column indicated significant difference at 0.05 level by Duncan test.
PH:Plant hight;RL:Max of root lenghth;NL:Leaf number;SDW:Shoot dry weight;RDW:Root dry weight;TDW:Total dry weight;R/S:Root/Shoot.
2.2 中氮及低氮处理下的植株总干重
植株干重是植物营养吸收能力和利用效率的综合反映。中氮中磷处理下,小麦异附加系植株总干重在0.34~2.71 g之间;低氮中磷处理下,植株总干重变异范围为0.32~2.54 g(表3)。低氮水平下,能够生产较多干物质的种质为氮高效种质;中氮水平下,能够生产较多干物质的种质为高生产潜力种质[5]。以中国春在中氮中磷和低氮中磷处理下的总干重为参照,可以将供试的小麦异附加系分为4类(图1)。其中,第Ⅰ类包含13个小麦异附加系,其特点是氮高效且具有高产潜力,能够稳定高效利用氮肥。第Ⅱ类包括10个小麦异附加系,其特点是氮高效但生产潜力低,更适应低氮环境。第Ⅲ类包含3个小麦异附加系,其特点是对氮缺乏十分敏感,更适应氮充足环境。归为第Ⅳ类的15个小麦异附加系,对氮素极不敏感,为典型的“氮低效、低生产潜力”种质。
2.3 小麦异附加系的氮吸收能力和利用效率
不同供氮条件下,各小麦异附加系的氮吸收能力各不相同。中氮中磷处理下,小麦异附加系的植株吸氮总量在32.36~164.26 mg之间(表4);与对照中国春(105.76 mg)相比,氮吸收能力显著增加的附加系有10个,占供试材料的23.26%;其中携带Ps.huashanicaE染色体的附加系的吸氮总量最高,较中国春增幅达55.31%;其次为携带Ag.intermediumB染色体的附加系,增幅为54.14%。低氮中磷处理下,同一附加系的氮吸收能力较中氮中磷处理明显降低,范围在20.24~86.29 mg之间;与中国春相比,9个小麦异附加系(20.93%)的植株吸氮总量显著提高。携带H.chilense7Hch染色体的种质吸氮总量最高,其次为携带Ae.searsii1SS和Ae.longissima2S染色体的附加系。综合来看,Ps.HuashanicaE、Ag.intermediumB、Ae.longissima2S、Ae.searsii1SS及Ae.searsii4SS异附加系在氮充足及胁迫条件下,显著提高了氮吸收总量,表明这些异源染色体上可能携带与氮吸收能力相关的基因。
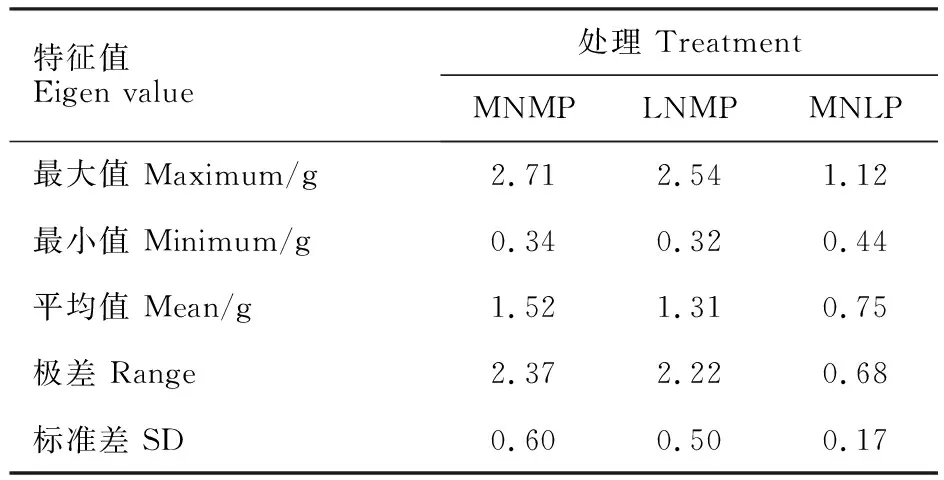
表3 中氮中磷、低氮中磷及中氮低磷处理下小麦异附加系总干重的变异Table 3 Variation of total dry weight in MNMP,LNMP and MNLP treatments

图1 小麦异附加系在低氮中磷及中氮中磷处理下总干重的分布Fig.1 Biplots and classified groups of wheat additionlines based on total dry weight(TDW) underLNMP and MNMP treatments
中氮中磷处理下,小麦异附加系的氮利用效率范围在10.50~17.93 g TDW·g-1N之间(表4);与中国春(16.04 g TDW·g-1N)相比,只有2个小麦异附加系的氮利用效率显著降低,其余附加系无明显差异。低氮中磷处理下,Ps.huashanicaC、Ps.huashanicaE、Ae.searsii1SS及Ag.elongatum6E等4个小麦异附加系的氮利用效率显著高于中国春;携带Ps.huashanicaC异源染色体的附加系氮利用能力最强。
2.4 中磷及低磷处理下的植株总干重
中氮低磷处理下,小麦异附加系的总干重较中氮中磷处理显著降低,其变异范围为0.44~1.12 g(表3)。以中国春在中氮中磷和中氮低磷处理下的总干重为参照,可以将供试材料分成4类(图2)。中氮中磷处理下,16个小麦异附加系的植株总干重高于中国春,其中5个小麦异附加系在中氮低磷下也能维持高于中国春的总干重(第Ⅰ类)。10个小麦异附加系在中氮中磷处理下的植株总干重低于中国春,但在中氮低磷处理下高于中国春,划入第Ⅱ类。划为第Ⅰ、Ⅱ类的小麦异附加系均具有“磷高效”的特点,其中携带有异源染色体Ag.intermediumB和Ae.searsii4SS的小麦异附加系表现最突出。对低磷胁迫最敏感的10个小麦异附加系划入第Ⅲ类,该类种质适合磷充足环境;在中氮中磷和中氮低磷处理下表现均低于中国春的15个小麦异附加系归于第Ⅳ类,为磷低效和低产潜力种质。
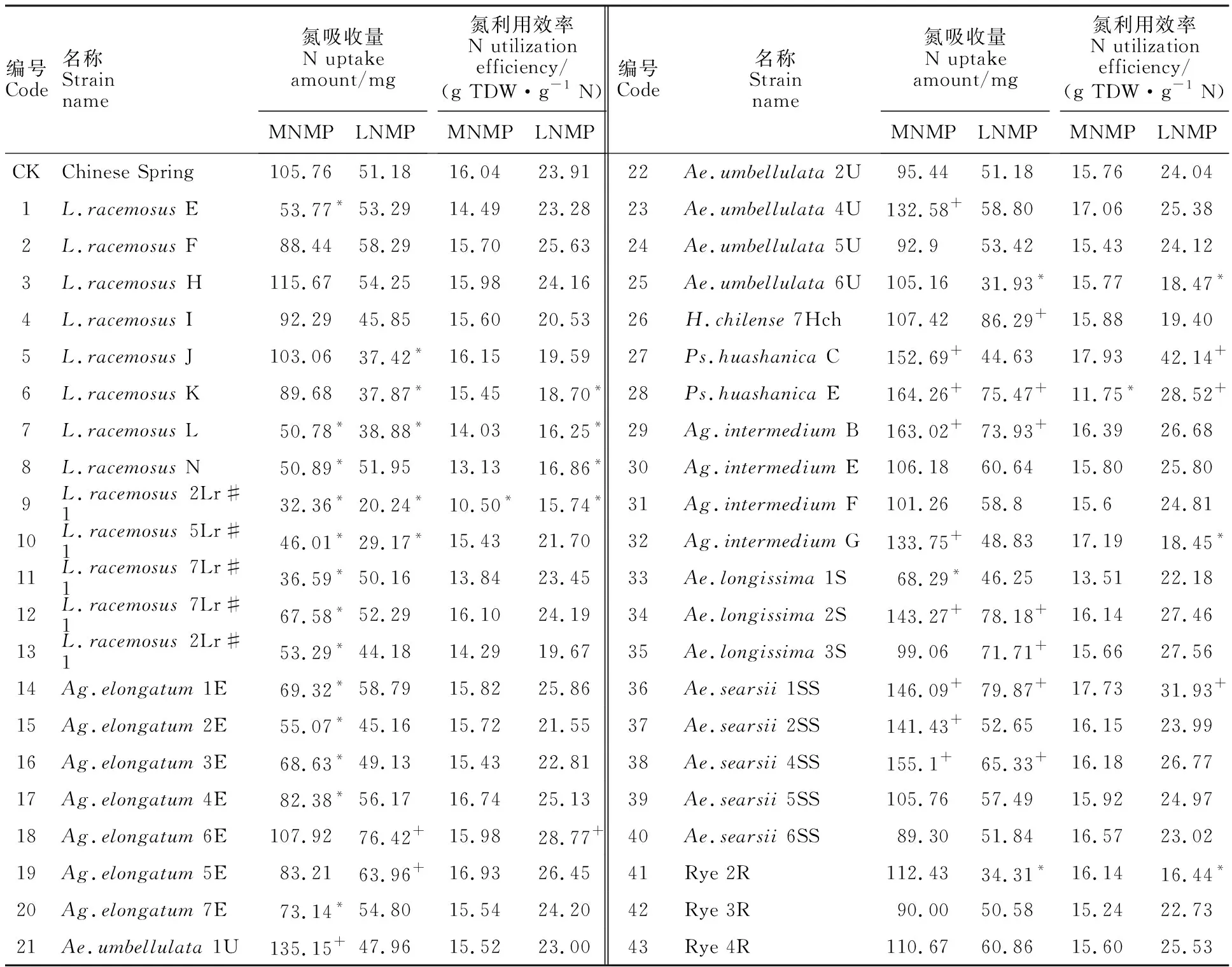
表4 不同处理下小麦异附加系的氮吸收和利用效率Table 4 Nitrogen uptake amount and utilization efficiency of wheat addition lines under different treatments
+表示显著高于中国春,*表示显著低于中国春,P<0.05。表5同。
Values with * and + in the same column indicate significantly lower and higher than CS at 0.05 level,respectively.The same in table 5.
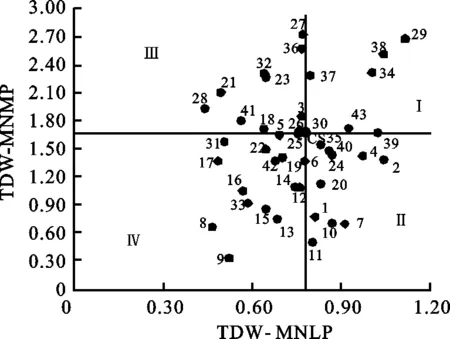
图2 小麦异附加系在中氮低磷及中氮中磷处理下总干重分布图Fig.2 Biplots and classified groups of wheat additionlines based on total dry weight(TDW) underMNLP and MNMP treatments
2.5 小麦异附加系的磷吸收能力和利用效率
中氮中磷处理下,小麦异附加系的植株吸磷总量在5.24~30.31 mg之间(表5),磷吸收能力显著高于中国春的小麦异附加系有9个。中氮低磷胁迫下,小麦异附加系的吸磷总量较正常供磷处理明显降低,其范围在0.94~3.06 mg之间;Ag.intermediumB、Ae.longissima2S、Ae.searsii5SS及Ae.umbellulata5U等4个小麦异附加系的吸磷总量显著高于中国春。Ag.intermediumB和Ae.longissima2S附加系在中氮中磷处理下吸磷能力强,在磷胁迫时(中氮低磷处理)也能维持较高的吸磷量,表明该染色体上可能携带有调控磷吸收能力的相关基因。
中氮中磷处理下,小麦异附加系的磷利用效率为64.85~104.20 g TDW·g-1P(表5);与中国春(91.71 g TDW·g-1P)相比,只有L.racemosusH异附加系磷利用效率显著提高。中氮低磷处理下,同一小麦异附加系的磷利用效率为其在中氮中磷处理下的4倍左右;与中国春(568.38 g TDW·g-1P)相比,L.racemosusl附加系、Ag.elongatum6E附加系的磷利用效率显著提高;Ag.intermediumF等11个小麦异附加系的磷利用效率显著降低。
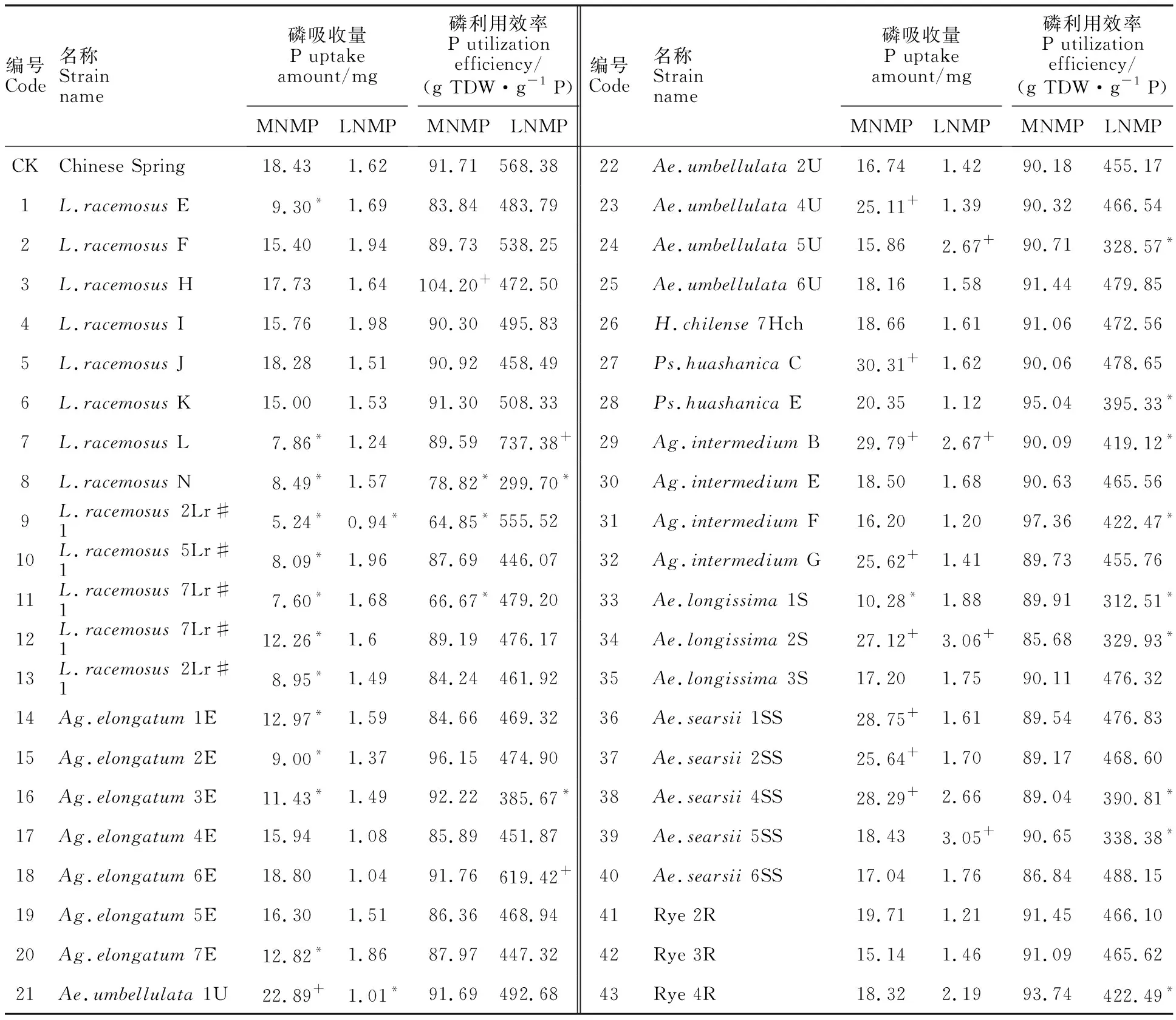
表5 不同处理下小麦异附加系的磷吸收和利用效率Table 5 Prosperous uptake amount and utilization efficiency of wheat addition lines under different treatments
3 讨 论
为明确不同氮磷浓度水平对小麦异附加系生长的影响,本研究先对培养4周的小麦植株的苗高、根长、叶数、SPAD值、茎干重、根干重、根茎比等基本形态指标进行了调查,发现低氮胁迫降低了苗期植株的株高、茎干重和总干重,提高了根长、叶数、SPAD值以及根茎比;而磷缺乏提高了根干重和根茎比,抑制了其余性状的生长;表明氮、磷胁迫均会抑制小麦地上部分的生长,促进地下部分的生长。大量研究表明,SPAD值可以估计叶片单位面积含氮量,且SPAD值大小与氮素水平呈显著正相关[15-17]。但在本研究中,低氮处理下SPAD值高于正常供氮处理,究其原因,可能是测定时选择的叶片为幼苗主茎最顶端完全展开叶片,而氮属于可移动元素,植株缺氮时会从老叶转移到新叶,优先满足新叶的生长需求[18];同时,叶色是许多因素综合影响的结果,当植株缺磷、缺钾或缺乏微量元素时,叶色会发生变化,此时叶片光谱也会发生改变,影响测定结果;此外,本研究中低氮水平包含了低氮中磷和低氮低磷两个处理,正常供氮水平包含了中氮中磷和中氮低磷,氮磷互作效应可能也对结果产生了影响。由此可见,在采用SPAD值作为测定氮含量的次级指标时,已完全展开且进入功能盛期的下部叶片可能较上部叶片更适合作为氮素营养的指示叶,且多叶片测定要比单张叶片更可靠[19]。
小麦的近缘种属作为重要的遗传资源库,常被用来向小麦导入新的性状或者基因,以提高品质,抵御各种生物及非生物胁迫等[4]。由于小麦近缘种属长期生长在贫瘠的自然环境中,其对肥料的吸收利用能力可能较栽培品种强[5]。要使来源于近缘种属的有益性状或者基因能够在育种中得以应用,首先要保证的是其在普通小麦背景中能够正常表达和发挥作用。而小麦异附加系,作为携带异源染色体的材料,可以用来研究独立的异源染色体在普通小麦背景中的效应。本研究采用生物量总干重、氮吸收总量、氮利用效率、磷吸收总量、磷利用效率等指标对小麦异附加系的氮、磷效率进行评价,发现供试的小麦异附加系存在丰富的遗传变异:附加到普通小麦背景中的外源染色体对各测定指标都有一定影响,部分外源染色体的附加可以显著提高小麦的氮、磷效率,筛选出的部分氮/磷效率较高的种质,可以利用常规杂交或者染色体工程技术,将其氮、磷高效基因导入小麦,从而培育出磷高效且优质高产的品种。
就氮效率而言,赵化田等[10]通过进行耐低氮基因型的苗期水培筛选试验,发现携带冰草、黑麦、偃麦草等外源血统的材料氮利用效率较高;本研究也发现来源于冰草属的Ag.elongatum6E附加系在低氮环境下表现出较高的氮利用效率,同时还发现来源于华山新麦草属Ps.huashanica(两对)和山羊草属Ae.searsii(1对)的异源染色体也能提高普通小麦在氮胁迫下的氮利用效率,而来源于赖草属L.racemosus的异源染色体种质相对于其他种质对氮效率有更多不利影响。就磷效率而言,研究发现,黑麦的1R、2R和7R染色体,Ag.elongatum的4E和6E染色体携带有耐低磷胁迫的基因[7-8];Ae.peregrina2U、Ae.peregrina3U、Ae.peregrina6U、Ae.searsii4S、Ae.geniculata4M、Ps.huashanicaC、El.trachycaulus5S、Ha.villosa1V和El.trachycaulus7HtS等异源染色体能显著提高普通小麦的磷效率[9]。本研究同样发现来自山羊草属的Ae.umbellulata5U、Ae.longissima2S、Ae.searsii5SS染色体在磷胁迫处理下能显著提高中国春的磷吸收能力,同时还发现分别来源于赖草属和冰草属的L.racemosusL和Ag.elongatum6E染色体能显著提高中国春的磷利用效率;而不论在磷充足还是磷胁迫处理下,携带Ag.intermediumB(No.29)、Ae.longissima2S(No.34)、Ae.searsii2SS(No.37)、Ae.searsii4SS(No.38)和Rye 4R(No.43)染色体的小麦异附加系的总干重总是高于中国春,表现出稳定的磷高效。由于研究材料有限,进一步分析氮、磷高效的小麦异附加系携带的异源染色体,没有观察到染色体部分同源群聚集的现象。
参考文献:
[1] KAN T S,BI Y M,ROTHSTEIN S J.Understanding plant response to nitrogen limitation for the improvement of crop nitrogen use efficiency[J].JournalofExperimentalBotany,2010,62(4):1499.
[2] HOLFORD I C R.Soil phosphorus:Its measurement,and its uptake by plants [J].SoilResearch,1997,35(2):228.
[3] 樊龙江,王卫娣,王 斌,等.作物育种相关数据及大数据技术育种利用[J].浙江大学学报(农业与生命科学版),2016,42(1):31.
FAN L J,WANG W D,WANG B,etal.Crop breeding-related data and application of big data technologies in crop breeding[J].JournalofZhejiangUniversity(Agric&LifeSci.),2016,42(1):31.
[4] 张志明,汤才国,杨三维,等.小麦(TriticumaestivumL.) 野生资源的发掘,利用研究进展[J].生物技术进展,2016,6(5):306.
ZHANG Z M,TANG C G,YANG S W,etal.Advance on gene discovery and utilization of wild relatives ofTriticumaestivumL.[J].CurrentBiotechnology,2016,6(5):306.
[5] GORNYA G,GARCZYNSKI S.Nitrogen and phosphorus efficiency in wild and cultivated species of wheat [J].JournalofPlantNutrition,2008,31(2):273.
[6] 柳 鹏,王仕稳,殷俐娜,等.硬粒小麦-粗山羊草人工合成小麦的磷效率研究[J].麦类作物学报,2014,34(3):332.
LIU P,WANG S W,YIN L N,etal.Study on phosphorus efficiency and relative phosiological mechanism of wheat alien chromosome addition lines[J].JournalofTriticeaeCrops,2014,34(3):332.
[7] 李玉京,刘建中,李 滨,等.普通小麦基因组中耐低磷胁迫特性的染色体控制[J].遗传学报,1999,26(5):535.
LI Y J,LIU J Z,LI B,etal.Chromosomal control of the tolerance to soil phosphorus deficiency in genome of common wheat [J].JournalofGeneticsandGenomics,1999,26:535.
[8] LIU J Z,LI Y J,TONG Y P,etal.Chromosomal location of genes conferring the tolerance to Pi starvation stress and acid phosphatase(APase) secretion in the genome of rye(SecaleL.)[J].PlantandSoil,2001,237:267.
[9] WANG S W,YIN L N,TANAKA H,etal.Identification of wheat alien chromosome addition lines for breeding wheat with high phosphorus efficiency [J].BreedingScience,2010,60(4):371.
[10] 赵化田,王瑞芳,许云峰,等.小麦苗期耐低氮基因型的筛选与评价[J].中国生态农业学报,2011,19(5):1199.
ZHAO H T,WANG R F,XU Y F,etal.Screening and evaluating low nitrogen tolerant wheat genotypeat seedling stage[J].ChineseJournalofEco-Agriculture,2011,19(5):1199.
[11] ZHANG H C,CAO Z H,SHEN Q R,etal.Effect of phosphate fertilizer application on phosphorus(P) losses from paddy soils in Taihu Lake Region:I.Effect of phosphate fertilizer rate on P losses from paddy soil[J].Chemosphere,2003,50(6):697.
[12] KJELDAHL J.A new method for the determination of nitrogen in organic matter[J].AnalyticalandBioanalyticalChemistry,1883.22:12.
[13] TSANG S,PHU F,BAUMM M,etal.Determination of phosphate/arsenate by amodified molybdenum blue method and reduction ofarsenate by S2O42-[J].Talanta,2007,71:1562.
[14] 米国华,刘建安,张福锁.玉米杂交种的氮农学效率及其构成因素剖析[J].中国农业大学学报,1998,3:99.
MI G H,LIU J A,ZHANG F S.Analysis on agronomic nitrogen efficiency and its components of maize hybrids[J].JournalofChinaAgriculturalUniversity,1998,3:99.
[15] 徐福荣,汤翠凤,余藤琼,等.利用叶绿素仪SPAD 值筛选耐低氮水稻种质[J].分子植物育种,2005,3(5):696.
XU F R,TANG C F,YU T Q,etal.Screening of rice germplasm for tolerance to low-nitrogen using SPAD-value by chlorophyll meter[J].MolecularPlantBreeding,2005,3(5):696.
[16] 史力超,翟 勇,王雪艳,等.基于叶片 SPAD 值的滴灌春小麦氮肥分期施用推荐模型[J].干旱地区农业研究,2017,35(1):103.
SHI L C,ZHAI Y,WANG X Y,etal.Recommendation model of nitrogen fertilizer based on SPAD ofleaves for drip-irrigated spring wheat[J].AgriculturalResearchintheAridAreas,2017,35(1):103.
[17] 李 杰,冯跃华,王 旭,等.水稻叶片 SPAD 值分布特征及其与施氮量的关系[J].南方农业学报,2017,48(1):44.
LI J,FENG Y H,WANG X,etal.Distribution characteristics of SPAD value in rice leaf and itsrelationship with nitrogen application rate[J].JournalofSouthernAgriculture,2017,48(1):44.
[18] 朱新开,盛海君,顾 晶,等.应用 SPAD 值预测小麦叶片叶绿素和氮含量的初步研究[J].麦类作物学报,2005,25(2):47.
ZHU X K,SHENG H J,GU J,etal.Primary study on application of SPAD value to estimate chlorophylland nitrogen content in wheat leaves[J].JournalofTriticeaeCrops,2005,25(2):47.
[19] 王绍华,曹卫星,王强盛,等.水稻叶色分布特点与氮素营养诊断[J].中国农业科学,2002,35(12):1462.
WANG S H,CAO W X,WANG Q S,etal.Positional distribution of leaf color and diagnosisof nitrogen nutrition in rice plant [J].ScientiaAgriculturaSinica,2002,35(12):1462.
