小麦HMW-GS毛细管电泳高效分离体系研究
2018-06-13王卫东何庆梦姚晓露杨明明李建芳
王卫东,高 翔,2,何庆梦,姚晓露,刘 阳,杨明明,2,李建芳,2,杨 娜
(1.西北农林科技大学农学院,陕西杨陵 712100;2.陕西省小麦工程技术研究中心,陕西杨凌 712100;3.山西省农业科学院棉花研究所,山西运城 044000)
小麦(TriticumaestivumL.)贮藏蛋白主要包括醇溶蛋白和谷蛋白两大类,依据分子量大小可将谷蛋白进一步分为高分子量谷蛋白亚基(HMW-GS)和低分子量谷蛋白亚基(LMW-GS)[1]。其中,HMW-GS与面筋弹性和延展性密切相关,是参与形成谷蛋白多聚体的主要成分[2];HWM-GS的组合不同则产生的品质效应不同[3]。对小麦品种中HMW-GS的分离鉴定已成为品质研究的重要环节。
传统方法分离小麦HMW-GS多采用SDS-聚丙烯酰胺凝胶(SDS-PAGE)和高效液相色谱(HPLC)等[4-7]。SDS-PAGE分离所需时间较长,对样品需求量较大,分离效果容易受环境及人为因素影响,且在鉴定亚基类型时需要对照“Payne命名系统”,准确性低,一些迁移率接近的亚基难以被区分。虽然结合分子标记技术可以在一定程度上弥补这一缺点,但由于特异性引物种类有限、实验前需要对种子发苗、提取和纯化样品DNA等,工作效率较低。HPLC较 SDS-PAGE方法克服了很多不足,但其成本较高,适用范围窄。HPCE(毛细管电泳)技术以其进样少、运行成本低、快速、准确性高等特点,被越来越多地应用于小麦HMW-GS研究[8-11]。
HPCE中,分离介质缓冲液的选择至关重要。目前,应用于小麦贮藏蛋白分离的常规HPCE缓冲系统主要包括磷酸盐缓冲液系统、硼酸盐缓冲液系统、乳酸铝缓冲液系统及Prosot SDS。Bietz[12]最早将酸性磷酸盐缓冲液与碱性硼酸盐缓冲液引入到HWM-GS的HPCE中,并获得了较好的分离效果。Werner等[13]首次使用乳酸铝缓冲液分离小麦HMW-GS,并成功鉴定了多个品种的亚基组成,之后又以Prosort SDS为缓冲剂对HMW-GS相关特性进行了研究[14]。Sutton等[15]在Prosot SDS中加入5%甲醇,对HMW-GS的HPCE鉴定图谱进行了研究。Bean等[16]使用Phos-gly(磷酸-甘氨酸)缓冲液对HMW-GS进行HPCE电泳分离,相比前人获得了更好的分辨率及分离效果。
上述应用于小麦HMW-GS分离的HPCE缓冲液系统,虽然具有较好的分离效率,但重现性较差,对亚基的定性分析尚显不足,不利于亚基标准鉴定图谱的构建。本试验以普通小麦中国春为标准样,引入亚氨基二乙酸(IDA)缓冲液系统[17],拟通过研究毛细管电泳中不同缓冲液组分浓度、缓冲液pH、分离电压、进样时间、运行温度、毛细管内径等对亚基分离的影响,确立小麦HMW-GS的HPCE高效分离体系,并通过连续重复试验、混合进样分析对体系的分离效率及重现性进行验证,以期为HPCE定性分析及标准鉴定图谱的构建提供基础。
1 材料与方法
1.1 试验材料
小麦品种中国春、石4185、陕182,由国家小麦改良中心杨凌分中心品质实验室提供。
1.2 方法
1.2.1 小麦HMW-GS的提取
参照文献[7]的方法并作改进:将单粒种子研磨成粉后加1 mL 70%乙醇振荡30 min,20 ℃ 13 000 r·min-1离心10 min,弃上清液;向沉淀中加入1 mL提取液A(50%异丙醇),混匀,60 ℃水浴30 min;室温下13 000 r·min-1离心10 min,弃上清,重复此步骤2次。向沉淀中加入150 μL提取液B[50%异丙醇+3 mol·L-1Tris-HCl(pH=8.8)+25 g·L-1二硫苏糖醇],混匀后60 ℃水浴30 min。加入150 μL提取液C[50%异丙醇+3 mol·L-1Tris-HCl(pH=8.8)+10 g·L-14-乙烯基吡啶],65 ℃继续水浴1 h。将水浴后产物于20 ℃ 13 000 r·min-1离心15 min,取120 μL上清液,加入80 μL预冷(-20 ℃)的丙酮溶液,使丙酮占总体积的40%。将混合液于-20 ℃冰箱中沉淀过夜,20 ℃ 13 000 r·min-1离心10 min,弃上清液,所得沉淀即为HMW-GS。
1.2.2 毛细管电泳系统运行前后处理
将1.2.1所得的蛋白沉淀烘干,加入200 μL蛋白溶解液(每50 mL含:15 mL丙三醇+18 g尿素+75 μL乙酸),于35 ℃水浴溶解1 h,-20 ℃保存备用,使用前超声脱气。与毛细管电泳相关的缓冲液及冲洗试剂均由超纯水配置,经0.45 μm滤膜过滤,20 ℃、50 W超声脱气15 min。
电泳分离前的冲洗程序为:N2反向吹干1 min,1 mol·L-1H3PO4冲洗2 min,0.1 mol·L-1NaOH冲洗2 min,去离子水冲洗1 min,缓冲液冲洗3 min。实验结束后用0.1 mol·L-1NaOH冲洗2 min,反向去离子水冲洗1 min。
1.2.3 毛细管电泳分离体系的优化
使用P/ACE MDQ plus毛细管电泳仪(Beckman,USA)对样品进行分析。毛细管配置为检测长度27 cm的石英非涂层毛细管(USA)。IDA缓冲液组分为:IDA(亚氨基二乙酸)+HPMC(羟丙基甲基纤维素)+ACN(乙腈)。利用控制变量法,对缓冲液系统及电泳分离参数进行逐一优化,确立HMW-GS毛细管分离最佳体系。缓冲液系统pH设置为2.2、2.5、2.8;缓冲液组分中IDA浓度设置为50、75、100 mmol·L-1;HPMC浓度设置为0、0.05%、0.5%;ACN浓度设置为10%、15%、20%。电泳参数中,分离电压设置为15、20、25 kV;运行温度设置为25、30、35 ℃;毛细管内径设置为25、50 μm;进样时间设置为5、8 s。
1.2.4 HMW-GS毛细管电泳分离体系重现性验证
利用构建好的HPCE高效分离体系,对小麦品种中国春的HMW-GS进行连续30次及连续多天电泳分离,检验毛细管电泳图峰形、基线稳定性。将中国春与石4185、陕182混合进样,比较该体系与常规Phos-gly/ACN体系(磷酸-甘氨酸+HPMC+ACN)的分离效率及图谱分辨率,计算各亚基出峰时间的RSD值,验证分离重现性。
2 结果与分析
2.1 缓冲液系统pH的选择
依据Salmanowicz等[18]、Yan等[19]的研究,毛细管电泳分离图谱中,中国春的HMW-GS具有四个特征峰,按迁移时间顺序分别为1Dy12→1By8→1Bx7→1Dx2。由图1可知,在缓冲液为100 mmol·L-1IDA+0.05% HPMC+20% ACN,采用25 μm内径毛细管,214 nm检测波长,分离电压15 kV,运行温度25 ℃,10.0 kV电进样5 s条件下,缓冲液pH对HMW-GS峰高、峰宽及基线均有显著影响。pH为2.8时,8.13 min出现1Dy12亚基主峰;1By8主峰出峰时间为9.97 min,峰高较低,主峰辨别度差,且峰后有基线的波动;1Bx7主峰出峰时间为11.54 min;1Dx2主峰出现在13.12 min;从1Dy12到1Dx2亚基峰时间跨度为4.99 min;整体上看基线有明显的上升趋势。pH为2.5时,四个主峰出峰时间分别为10.24、11.94、13.40和15.00 min;相比pH2.8时出峰时间较晚,时间跨度稍有减小(4.76 min),但整体峰形对称、分离度较高、基线相对平稳。pH为2.2时,四个主峰出峰时间为11.57、12.55、14.31和16.08 min,时间跨度为4.51 min;相比pH为2.5、2.8,峰宽度增大、分离度降低;而且在临近1Dy12亚基主峰时基线波动较大,1By8主峰与1Bx7主峰之间也出现了类似现象。说明pH为2.5时亚基分离效果较好。

A、B、C曲线所对应的pH分别为2.8、2.5、2.2。
The corresponding pH of A,B and C curves are 2.8,2.5 and 2.2,respectively.
图1不同pH缓冲液对HMW-GS电泳分离的影响
Fig.1EffectofdifferentpHofbufferonelectrophoresisseparationofHMW-GS
2.2 缓冲液系统组分浓度的选择
2.2.1 IDA浓度的选择
如图2所示,缓冲液为:0.05% HPMC+20% ACN,pH 2.5。电泳条件为:毛细管内径25 μm,检测波长214 nm,分离电压15 kV,运行温度25 ℃,10.0 kV进样5 s,中国春的HMW-GS亚基整体迁移速率随IDA浓度的增大而加快,浓度对亚基峰高、峰形及基线状况影响不大。比较相同IDA浓度下连续两针的电泳图谱发现,IDA浓度对电泳分离重现性的影响较大。IDA浓度为50 mmol·L-1时,亚基迁移速率最慢,电泳第一针与第二针之间的出峰时间差异最大。IDA浓度为100 mmol·L-1时,亚基迁移最快,连续两针间电泳出峰时间差值减小,但仍然较大,且在1Dy12主峰之前出现了基线的波动。IDA浓度为75 mmol·L-1时,亚基迁移速率介于50和100 mmol·L-1之间,两针间电泳出峰时间几乎重合,亚基峰形、基线均保持较高的一致性,电泳分离重现性较高。说明IDA浓度为75 mmol·L-1的亚基分离效果较好。

A和B、C和D、E和F曲线分别表示IDA浓度为100、75、50 mmol·L-1时电泳第一针、第二针。
A and B,C and D,and E and F represent the first and second electrophoresis when the concentration of IDA was 100 mmol·L-1,75 mmol·L-1and 50 mmol·L-1,respectively.
图2不同IDA浓度对HMW-GS电泳分离的影响
Fig.2EffectofdifferentconcentrationofIDAontheelectrophoresisseparationofHMW-GS
2.2.2 HPMC浓度的选择
如图3所示,缓冲液为75 mmol·L-1IDA+20% ACN,pH 2.5。电泳条件为:毛细管内径25 μm,检测波长214 nm,分离电压15 kV,运行温度25 ℃,10.0 kV进样5 s。HPMC浓度对HMW-GS分离度及基线状况有显著影响。不添加HPMC时,亚基迁移速度最快,但峰之间未完全分离,主峰界线不明显,且峰形不规则。HPMC浓度为0.5%时,峰宽明显变窄,亚基分离度最高,但基线噪音较大,影响了图谱的分辨率。HPMC浓度为0.05%时,1Dy12、1By8、1Bx7、1Dx2四个主峰出峰时间分别为12.40、14.07、15.54和17.16 min,亚基分离度介于0与0.5%浓度之间,虽然亚基迁移速率降低,但主峰峰形对称,且基线噪音很小,图谱分辨率高。说明HPMC浓度为0.05%时最佳。
2.2.3 ACN浓度的选择
缓冲液为75 mmol·L-1IDA+0.05 % HPMC,pH 2.5,毛细管内径25 μm,检测波长214 nm,分离电压15 kV,运行温度25 ℃,10.0 kV进样5 s。添加不同浓度ACN,对HMW-GS毛细管电泳分离的影响主要集中在主峰分离度上(图4)。ACN浓度为20%时,四个主峰分离度最低。ACN浓度为10%时,主峰分离度最大,但是峰宽增大、峰高明显降低,即亚基纵向扩散与峰展宽比例减小,影响图谱的分辨率。当ACN浓度为15%时,主峰分离度介于前两者之间,1Dy12、1By8、1Bx7、1Dx2主峰依次出现在12.68、14.32、16.80和18.94 min,亚基峰形清晰对称,基线噪音最低。因此,ACN浓度为15%最佳。

A、B、C曲线分别对应HPMC浓度0.5%、0.05%、0。
A,B and C curves correspond to 0.5%,0.05% and 0 of HPMC,respectively.
图3不同HPMC浓度对HMW-GS电泳分离的影响
Fig.3EffectofdifferentconcentrationofHPMConthe
electrophoresisseparationofHMW-GS

A:20% ACN; B:15% CAN; C:10% ACN.图4 不同ACN浓度对HMW-GS电泳分离的影响Fig.4 Effect of different concentration of ACN on theelectrophoresis separation of HMW-GS
2.3 毛细管电泳分离条件的选择
2.3.1 毛细管分离电压的选择
利用已经优化好的IDA缓冲液系统,对毛细管电泳运行参数进行逐步优化,进一步提高HMW-GS分离效果。
缓冲液为75 mmol·L-1IDA+0.05% HPMC+15% ACN,pH为2.5;毛细管内径25 μm,检测波长214 nm,运行温度25 ℃,10.0 kV进样5 s。如图5所示,当分离电压为15 kV时,基线水平、亚基分离度较高,但是峰高相对较低,且迁移速度最慢。当电压增大为20 kV时,主峰分离度未受明显影响,与15 kV差异不大,亚基峰高明显增大、整体迁移速率明显加快,图谱分辨率得到了提升。电压达到25 kV时,虽然获得了最大迁移速率及峰高,但是基线出现了整体下降的趋势。由此可见,分离电压的提高对迁移速率及峰高有促进作用,但会增加分离不稳定因素。综合来看,20 kV分离电压对HMW-GS的分离效果最佳。

A:15 kV; B:20 kV; C:25 kV.图5 分离电压对HMW-GS电泳分离的影响Fig.5 Effect of separation voltage on the electrophoresisseparation of HMW-GS
2.3.2 分离温度的选择
缓冲液为75 mmol·L-1IDA+0.05% HPMC+15% ACN,pH 2.5;毛细管内径25 μm,检测波长214 nm,分离电压20 kV,10.0 kV进样5 s。当分离温度为25 ℃时,图形清晰,亚基峰形对称,四个主峰出峰时间依次为10.93、12.81、15.98和18.13 min(图6)。温度为30 ℃时,亚基分离度与25 ℃时接近,但亚基出峰更早;四大主峰分别出现在9.31、11.69、13.18和14.77 min,时间跨度为52.4 min,整体迁移速度更快;亚基纵向扩散与峰展宽比例扩大,从而带来主峰辨识度的提高。温度为35 ℃时亚基分离度达到最大,出峰时间分别为8.22、10.38、13.14和15.56 min,但是亚基峰高明显变小,基线波动较大,噪音增强,导致图谱分辨率明显下降。由此可见,分离温度为30 ℃时分离效果最好。
2.3.3 PDA检测波长的选择
缓冲液为75 mmol·L-1IDA+0.05% HPMC+15% ACN,pH 2.5;毛细管内径25 μm,分离电压20 kV,运行温度30 ℃,10.0 kV进样5 s。结果(图7)表明,PDA检测波长与分离图谱中亚基峰宽和基线噪音密切相关,对峰高有轻微影响,对图谱亚基出峰时间的影响不大。PDA波长由214 nm转变为200 nm时,基线噪音更小,亚基峰宽减小,峰高略微增大,这使得亚基纵向扩散与峰展宽比例进一步增大,带来了主峰辨识度的提高。因此PDA检测波长为200 nm时最佳。

A、B、C曲线分别对应25、30和35 ℃。
A,B and C curves are 25,30 and 35 ℃,respectively.
图6毛细管内运行温度对HMW-GS电泳分离的影响
Fig.6Effectofthecapillarytemperatureonthe
electrophoresisseparationofHMW-GS

A:214 nm; B:200 nm.图7 PDA检测波长对HMW-GS电泳分离图谱的影响Fig.7 Effect of PDA wavelengths on theelectrophoresis separation of HMW-GS
2.3.4 进样时间的选择
缓冲液为75 mmol·L-1IDA+0.05% HPMC+15% ACN,pH 2.5;毛细管内径25 μm,检测波长200 nm,分离电压20 kV,运行温度30℃,10.0 kV进样。当进样时间为5 s时,峰形清晰,亚基分离度高,基线平稳。进样时间为8 s时,电泳迁移速率与进样5 s差异不大,但峰宽明显增大,1Bx7、1Dx2主峰峰高显著降低,四个主峰之间界线模糊,亚基分离度较差,图谱分辨率降低(图8)。因此,进样时间为5 s时分离效果好。

A:8 s; B:5 s.图8 不同进样时间对HMW-GS电泳分离图谱的影响Fig.8 Effect of different sampling time on theelectrophoresis separation of HMW-GS
2.3.5 毛细管内径的选择
缓冲液为75 mmol·L-1IDA+0.05% HPMC+15% ACN,pH 2.5;检测波长200 nm,分离电压20 kV,运行温度30 ℃,10.0 kV进样5 s。结果(图9)表明,毛细管内径同时影响亚基峰宽、分离度及基线稳定性。毛细管内径为25 μm时,亚基分离度高,亚基峰形对称,基线水平,背景噪音低。当毛细管内径为50 μm时,亚基分离度降低,峰宽增大,峰高降低;电泳迁移率降低,亚基出峰较晚,1Dy12、1By8、1Bx7、1Dx2四个主峰依次出现在第10.81、12.24、13.78和15.58 min处;1Dy12主峰出峰之前有明显的基线波动,电泳分离后期基线逐渐上升,且有倒峰及杂峰出现。由此可见,毛细管内径为25 μm时最佳。
2.4 HMW-GS毛细管电泳高效分离体系及验证
在优化后条件下,即缓冲液组分为15% ACN+75 mmol·L-1IDA+0.05% HPMC,pH为2.5;毛细管内径25 μm, PDA检测波长200 nm,分离电压20 kV,运行温度30 ℃,样品10.0 kV电进样5 s,对中国春的HMW-GS连续多次电泳分离。结果(图10)发现,第1~2 min为系统峰(溶剂峰),3~6 min为微量LMW-GS区域,HMW-GS在9 min后开始出峰,1Dy12、1By8、1Bx7、1Dx2亚基16 min内全部分离完成。连续30次、连续6 d重复试验(图10、11),均显示图谱亚基峰形一致、分离度高、基线水平。通过混合进样方式,与常规的Phos-gly/ACN体系进行对比。

A:25 μm; B:50 μm.图9 不同毛细管内径对HMW-GS电泳分离图谱的影响Fig.9 Effect of different inner diameters of the capillaryon the electrophoresis separation of HMW-GS

图中所示曲线从下往上依次为第1、5、10、15、20、25、30次电泳分离曲线。
The curves from bottom to top are first,fifth,tenth,fifteenth,twentieth,twenty-fifth and thirtieth electrophoresis separation curves,respectively.
图10中国春HMW-GS连续30次毛细管电泳分离图谱
Fig.10Imageofthirtyconsecutiveinjections
ofHMW-GSofChineseSpring
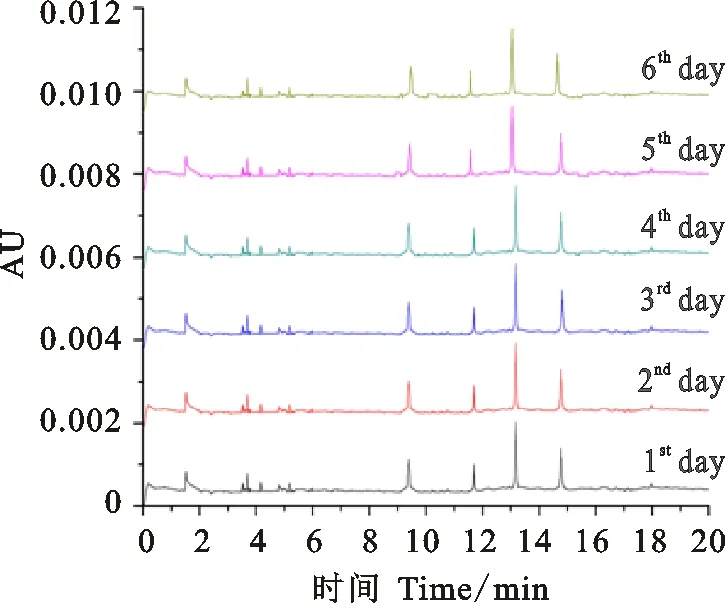
图中所示曲线从下往上依次为第1、2、3、4、5、6天电泳分离曲线。
The curves from bottom to top are the curves of the first day,the second day,the third day,the fourth day,the fifth day and the sixth day,respectively.
图11中国春HMW-GS连续6d电泳图谱
Fig.11ContinuousrepeatedexperimentofHMW-GSofChineseSpringforsixdays
结果(图12、表1)表明,该体系在亚基分离速度、图谱分辨率上更具有优势,对于迁移率比较接近的亚基(如1Dy12与1Dy10、1By9与1By8、1Dx5与1Dx2)更容易表征;亚基出峰时间RSD(<0.2%)值远小于后者,说明分离重现性更高。

A、B均为中国春(Null,7+8,2+12)与石4185(1,7+9,2+12)、陕182(1,7+8,5+10)混合样的分离图谱。图A电泳条件:25 μm毛细管,200 nm检测波长,缓冲液组分75 mmol·L-1IDA+0.05% HPMC+15% ACN,pH 2.5,分离电压20 kV,运行温度30 ℃,10.0 kV电进样5 s。图B电泳条件为:25 μm毛细管,214 nm检测波长,缓冲液组分100 mmol·L-1Phosphate-glycine+0.05% HPMC+20% ACN,pH 2.5,分离电压12.5 kV,运行温度40 ℃,10.0 kV电进样5 s。
A and B are both the separation curves obtained from the mixture of Chinese Spring(Null,7+8,2+12) ,Shi 4185(1,7+9,2+12) and Shaan 182(1,7+8,5+10).The electrophoresis conditions of Fig.A:Inner diameter of the capillary was 25 μm; Detection wavelength was 200 nm; Buffer composition was 75 mmol·L-1IDA + 0.05% HPMC + 15% ACN,with pH at 2.5; Separation voltage was 20 kV; Operating temperature was 30 ℃; Samples were injected for five seconds by electric method under under 10.0 kV.The electrophoresis conditions of Fig.B:Inner diameter of the capillary was 25 μm;Detection wavelength was 214 nm; Buffer composition was 100 mmol·L-1phosphate-glycine + 0.05% HPMC + 20% ACN,with pH at 2.5;Separation voltage was 12.5 kV;Operating temperature was 40 ℃;Samples were injected for five seconds by electric method under under 10.0 kV.

图12 不同分离体系效果比较
表中数据为连续30次电泳分离所得平均值。
The data is the average value obtained from 30 consecutive injections.
3 讨 论
小麦HMW-GS与小麦品质密切相关,其分离鉴定是品质研究的重要环节。与传统方法相比,HPCE具有快速、自动化、分辨率高等特点。依据电泳图谱可获得亚基的准确峰高、迁移时间等,有助于亚基定性及定量分析。本试验结果表明,HPCE分离体系中缓冲液pH、缓冲液组分、分离电压、运行温度、进样时间、检测波长及毛细管内径等条件的变化均会影响分离效果。
Bean等[20]最先将IDA/ACN缓冲系统应用到蛋白HPCE分析中,主要对醇溶蛋白的分离进行了探讨,本试验首次将其引入到HMW-GS的HPCE分析中,通过优化条件,同样获得了良好的分离效果。Righetti等[21]表明IDA/ACN缓冲液系统分离蛋白质的最佳pH为2.2~2.8。本研究发现,pH > 2.5会导致基线不稳定趋势增加。由于HMW-GS属于大分子蛋白[22],容易吸附在毛细管壁上,使电渗流改变,影响电泳分离重复性,极端pH可以抑制蛋白吸附,维持电渗流稳定,但当pH达到一定范围时,该作用将显著减弱。推测pH>2.5时抑制作用降低,电泳后期HMW-GS吸附作用增强,从而产生了较多的焦耳热,导致了基线的上升。IDA在毛细管电泳中主要影响分离的重现性,本研究结果表明,其浓度为75 mmol·L-1时,分离体系重现性较好。HPMC是一种亲水高分子聚合物[23],在缓冲液系统中具有充当筛分介质[24]和动态修饰的作用[25],影响亚基分离度及基线状况。HPMC浓度增大可能提高毛细管电泳灵敏度,但相应的图谱噪音也会增强。适当降低浓度可增大亚基分离度。由于缓冲液中HPMC浓度的改变亦可影响其粘性,缓冲介质粘性是影响电渗流的主要因素之一[26],因此控制HPMC浓度有助于稳定毛细管电泳电渗流。ACN在缓冲液系统中的作用是通过加快样品堆积,促进迁移速率[27],其浓度的变化往往影响电泳灵敏度,本试验发现,当ACN浓度提高时图谱噪音也会相应增高,再次验证了这一观点。由于HPCE是以高压电场为驱动力,温度影响着管内溶液的粘性[28],因此两者数值升高均会提高图谱迁移速率,但也为电泳系统带来不稳定因素。本试验中,PDA检测波长对分离效果的影响主要是在图谱分辨率上,由于不同物质的最大吸收波长不同[29],改变PDA检测波长则会引起图谱信噪比的变化。电压进样时间往往会影响进样塞的长度,进样塞长度过大时容易使峰展宽大于纵向扩散[30],与本试验结果一致。本试验还发现,增大毛细管内径,会使分离度降低、基线波动,这可能是因为毛细管作为分离通道,其内径对散热影响较大;减小其内径有利于电泳过程中热量的散出,减少焦耳热的产生;内径过大,容易在毛细管内部形成温度梯度(中心温度高),破坏塞流,进而导致亚基纵向扩散小于区带展宽[31],降低分离效率。
本研究通过分析HPCE中不同因素对HMW-GS分离效果的影响,结合连续重复实验及比对验证,成功构建了基于IDA缓冲液系统的HPCE高效分离体系,由于该体系下图谱亚基分离度高、重现性好,因此有利于HMW-GS的定性分析。结合SDS-PAGE及分子标记等,可对HPCE分离图谱中不同类型HMW-GS进行表征,确定标准迁移时间。依据标准迁移时间,即可完成小麦材料中相关HMW-GS的快速鉴别。同时,该指标亦可作为新型未知亚基的鉴定标准。
参考文献:
[1] SHEWRY P R,TATHAM A S,LAZZERI P.Biotechnology of wheat quality [J].JournaloftheScienceofFoodandAgriculture,1997,73(4):399.
[2] PAYNE P I,NIGHTINGALE M A,KRATTIGER A F,etal.The relationship between HMW glutenin subunit composition and the bread-making quality of British-grown wheat varieties [J].JournaloftheScienceofFoodandAgriculture,1987,40(1):64.
[3] WIESER H,ZIMMERMANN G.Importance of amounts and proportions of high molecular weight subunits of glutenin for wheat quality [J].EuropeanFoodResearch&Technology,2000,210(5):329.
[4] VISIOLI G,COMASTRI A,IMPERIALE D,etal.Gel-based and gel-free analytical methods for the detection of HMW-GS and LMW-GS in wheat flour [J].Foodanalyticalmethods,2016,9(2):474.
[5] HAJAS L,SCHERF K A,TRK K,etal.Variation in protein composition among wheat(TriticumaestivumL.) cultivars to identify cultivars suitable as reference material for wheat gluten analysis [J].FoodChemistry,2017,5:5.
[6] HOSSEIN M,REZA M.Characterization of wheat gluten subunits by liquid chromatography ? Mass spectrometry and their relationship to technological quality of wheat [J].JournalofCerealScience,2017,76:233.
[7] JANG Y R,BEOM H R,ALTENBACH S B,etal.Improved method for reliable HMW-GS identification by RP-HPLC and SDS-PAGE in common wheat cultivars [J].Molecules,2017,22(7):1055.
[8] JIANG P,GAO J,ZHENG X,etal.Clustered transcription initiators and expression of HMW-GS genes in wheat endosperm [J].CropScience,2017,57(1):384.
[9] LOOKHART G L,BEAN S R,JONES B L.Separation and characterization of barley(HordeumvulgareL.) hordeins by free zone capillary electrophoresis [J].Electrophoresis,1999,20(7):1611.
[10] LOOKHART G L,BEAN S R.Improvements in cereal protein separations by capillary electrophoresis:Resolution and reproducibility [J].CerealChemistry,1996,73(1):85.
[11] LOOKHART G,BEAN S.Separation and characterization of wheat protein fractions by high-performance capillary electrophoresis [J].CerealChemistry,1996,72(6):530.
[12] BIETZ J A.Fractionation of wheat gluten proteins by capillary electrophoresis [J].GlutenProteins,1993:406.
[13] WERNER W E,WIKTOROWICZ J E,KASARDA D D.Wheat varietal identification by capillary electrophoresis of gliadins and high molecular weight glutenin subunits [J].CerealChemistry,1994,71(5):400.
[14] WERNER W E.Ferguson plot analysis of high molecular weight glutenin subunits by capillary electrophoresis [J].CerealChemistry,1995,72:248.
[15] SUTTON K H,BIETZ J A.Variation among high molecular weight subunits of glutenin detected by capillary electrophoresis [J].JournalofCerealScience,1997,25(1):9.
[16] BEAN S R,LOOKHART G L.Faster capillary electrophoresis separation of wheat proteins through modifications to buffer composition and sample handling [J].Electrophoresis,1998,19(18):3191.
[17] LOOKHART G L,BEAN S R.Ultrafast CE analysis of cereal storage proteins and its applications to protein characterization and cultivar differentiation [J].JournalofAgriculturalandFoodChemistry,2000,48:353.
[18] SALMANOWICZ B P,LANGNER M,FRANASZEK S.Charge-based characterisation of high-molecular-weight glutenin subunits from common wheat by capillary isoelectric focusing [J].Talanta,2014,129:14.
[19] YAN Y,JIANG Y,SUN M,etal.Rapid identification of HMW glutenin subunits from different hexaploid wheat species by acidic capillary electrophoresis [J].CerealChemistry,2004,81(5):565.
[20] BEAN S R,LOOKHART G L.Ultrafast capillary electrophoretic analysis of cereal storage proteins and its applications to protein characterization and cultivar differentiation [J].JournalofAgriculturalandFoodChemistry,2000,48(2):350.
[21] RIGHETTI P G,OLIVIERI E,VIOTTI A.Identification of maize lines via capillary electrophoresis of zeins in isoelectric,acidic buffers [J].Electrophoresis,1998,19(10):1740.
[22] DENG Z,TIAN J,LIU X.Accumulation regularity of protein components in wheat cultivars with different HMW-GS [J].ActaAgronomicaSinica,2004,30(5):484.
[23] SARKAR N,WALKER L C.Hydration-dehydration properties of methylcellulose and hydroxypropyl methylcellulose [J].CarbohydratePolymers,1995,27(3):183.
[24] ORIARD M.Separation of proteins with capillary electrophoresis in coated capillaries with and without electroosmosis studies on zone broadening and analytical performances [J].ActaUniversitatisUpsaliensis,2006,19(1):50.
[25] MACHISTE E O,BUCKTON G.Dynamic surface tension studies of hydroxypropylmethylcellulose film-coating solutions [J].InternationalJournalofPharmaceutics,1996,145(1-2):197.
[26] YIN S,SU M,XIE G,etal.Factors affecting separation and detection of bile acids by liquid chromatography coupled with mass spectrometry in negative mode [J].AnalyticalandBioanalyticalChemistry,2017:6.
[27] STEFAN A R,DOCKERY C R,NIEUWLAND A A,etal.Forensic analysis of anthraquinone,azo,and metal complex acid dyes from nylon fibers by micro-extraction and capillary electrophoresis [J].Analytical&BioanalyticalChemistry,2009,394(8):2081.
[28] 陈 义.毛细管电泳技术及应用[M].北京:化学工业出版社,2000:15.
CHEN Y.Technology and application of capillary electrophoresis [M].Beijing:Chemical Industry Press,2000:15.
[29] POTIER I L,BOUTONNET A,ECOCHARD V,etal.Chemical and instrumental approaches for capillary electrophoresis(CE)-fluorescence analysis of proteins [M]//Nguyet Thay Tran,Myrian Tavema.Capillary Electrophoresis of Proteins and Peptides.Nwe York:Humana Press,2016:1-10.
[30] WATZIG H,DETTE C.Capillary electrophoresis(CE)-a review.Strategies for method development and applications related to pharmaceutical and biological sciences [J].DiePharmazie,1994,49(2-3):93.
[31] WESTON A,BROWN P R,JANDIK P,etal.Factors affecting the separation of inorganic metal cations by capillary electrophoresis [J].JournalofChromatographyA,1992,593(1):294.
