苏州活禽市场禽流感病毒(H7N9)季节变化及HA、NA、PB2基因系统进化分析
2018-06-12朱杰张琰张超唐盺莹张洪波王祥宋宇峰周东明王庆林
朱杰,张琰,张超,唐盺莹,张洪波,王祥,宋宇峰,周东明,王庆林
1. 湖南师范大学医学院,长沙 410013; 2. 中国科学院上海巴斯德研究所疫苗中心,上海 200031
随着新型禽流感病毒H7N9感染病例的相继报道,自2013年初至2017年6月,其已在中国经历了5个流行周期,造成 1 552 例人感染H7N9病例,病死率约40%[1]。2016年12月在广东省首次发现高致病性H7N9病毒,其母源病毒来自2015年的长江三角洲流行地区,但母源病毒呈低致病性[2]。2017年初在湖南省和广西壮族自治区等地区也发现高致病性H7N9病毒[3]。禽流感病毒H7N9由于致病性低,仅引起禽类的无症状感染,此前很少受到关注。但新型H7N9病毒能引起人类发生高热、肺炎和其他呼吸道症状及多器官功能衰竭等严重疾病被报道后,人们对其的关注度日益提高[4-6]。
中国人日常生活中活禽市场普遍存在。但活禽市场对家禽来源的监管力度不够,特别是个体农户自由放养的家禽很容易被野禽携带的禽流感病毒感染。有报道称,在大多数流行地区,人通过与活禽市场接触而被感染,意味着活禽市场与人类之间存在流行病学联系[7]。活禽市场中家禽来源的复杂性有利于不同亚型禽流感病毒在不同品种家禽之间相互传播[8-11]。新型H7N9病毒的HA基因与来自鸭的H7N3病毒有关,NA基因与来自野生候鸟的H2N9和H11N9病毒有关,其他基因可能来自H9N2病毒[12-14]。
苏州位于中国江苏省南部,是一个重要的经济交通中心。西面为中国五大淡水湖之一的太湖,且与浙江省和上海市毗邻,而后两地是2013年H7N9病毒流行的主要受影响地区。太湖的天然湿地是东亚-澳大利亚候鸟迁徙路线中的歇息地,有许多野生鸟类。这种新型H7N9病毒在太湖周围其他城市的活禽市场中也被发现并报道,如湖州[15]和嘉兴[16],但其在苏州的流行病学尚不清楚。本研究于2013年7—12月在H7N9病毒主要流行地区之一江苏省苏州市活禽市场采集2 655份鸡、鸭咽拭子样本,对样本中的流感病毒进行核酸检测,并进一步对H7N9阳性样本中的HA、NA和PB2基因进行测序,通过系统进化分析来追踪新型H7N9病毒的进化史。
1 材料与方法
1.1 咽拭子收集
2013年7—12月,于苏州活禽市场随机收集鸡、鸭咽拭子,共计 2 655 份样本。样本保存于 2~3 mL含100 U/mL青霉素和100 μg/mL链霉素的 Hank’s 液中,于-70 ℃冻存。
1.2 病毒扩增
选择发育良好的9~11日龄无特定病原体(specific pathogen free,SPF)鸡胚,常规无菌处理咽拭子样本。取适量样本溶液,用无菌环接种于鸡胚尿囊腔,放入37 ℃孵育箱培养。接种后24 h内将死亡的鸡胚舍弃;24 h后,每天照蛋2次,如发现鸡胚死亡,立即放入冰箱暂存;孵育36~48 h后,收取尿囊液。将完成病毒扩增的尿囊液冻存于-70 ℃。上述所有操作均在生物安全三级(biosafety level 3,BSL-3)实验室内完成。
1.3 RNA提取和反转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)
按RNA提取操作步骤, 用TRIzol试剂(Invitrogen公司)提取尿囊液中的病毒RNA[17]。取适量尿囊液置于RNase-free EP管中,加入TRIzol试剂剧烈振荡后,室温静置;加入氯仿(氯仿体积为TRIzol试剂的1/5),剧烈振荡后室温静置;将RNase-free EP管放入 4 ℃ 预冷的离心机中,12 000 r/min于4 ℃离心 20 min;用无菌枪头(Thermo Scientific公司)取上层液体置于另一新的RNase-free EP管中,加入异丙醇,上下颠倒混匀,室温静置或-80 ℃静置;将RNase-free EP管离心,弃上清液,每管加入适量75%乙醇洗涤RNA沉淀,然后离心;弃上清液,室温静置晾干;将纯化后的RNA溶解于10 μL DEPC水(中国大连TaKaRa公司)。使用通用引物Uni12将提取的RNA反转录为cDNA。反应参数:去DNA体系 42 ℃ 3 min,16 ℃暂存;反转录体系 42 ℃ 15 min,95 ℃ 3 min,16 ℃暂存。将得到的cDNA存于 -80 ℃。以cDNA为模板,使用3对特殊引物扩增H5、H7和H9亚型基因片段,以检测这些样本中禽流感病毒的混合感染。本研究所使用引物详见表1。
表1PCR和测序引物
Tab.1PCRandsequencingprimersusedinthisstudy

Primers Sequences (5'-3')H5-155f5'-ACACATGCYCARGACATACT-3'H5-699r5'-CTYTGRTTYAGTGTTGATGT-3'H9-151f5'-CTYCACACAGARCACAATGG-3'H9-638r5'-GTCACACTTGTTGTTGTRTC-3'NA9-975f5'-TGTAATGACCCTTATCCAGG-3'NA9-1382r5'-GTTCCATTGTCCAAGGAATTC-3'H7-12f5'-GGGATACAAAATGAAYACTC-3'H7-645r5'-CCATABARYYTRGTCTGYTC-3'Bm-PB2-15'-TATTGGTCTCAGGGAGCGAAAGCAG- GTC-3'PB2-1250R5'-TCYTCYTGTGARAAYACCAT-3'RV-M5'-GAGCGGATAACAATTTCACACAGG-3'M13-475'-CGCCAGGGTTTTCCCAGTCACGAC-3'Uni125'-AGCAAAAGCAGG-3'
1.4 测序和禽流感病毒的系统进化分析
将扩增的HA、NA和PB2基因片段克隆至pMD18-T载体(中国大连TaKaRa公司),采用RV-M和M13-47引物,ABI 3730XL遗传分析仪(ABI公司)的Sanger双脱氧测序法进行测序。将获得的HA、NA和PB2核酸序列提交至全球共享禽流感倡议组织(Global Initiative on Sharing All Influenza Data,GISAID)-EpiFlu数据库,基因序列号为EPI_ISL_205835~EPI_ISL_205849。对收集到的样本序列进行多线程扩增,用ClustalW软件将GenBank和GISAID数据库作为数据源分析收集到的序列数据。采用邻接法(neighbor-joining method)构建系统进化树,在Kimura 2核酸替代模型中重复抽样1 000次对进化树进行验证。成对的核苷酸同源性计算中包括所有3个密码子的位置和成对丢失的情况,所有计算采用Mega 6.06软件进行。
2 结果
2.1 样本阳性率检测
本研究共采集 2 655 份咽拭子样本(鸡 2 155 份,鸭 500份),采用RT-PCR检测H5、H7和H9亚型的病毒基因。结果显示,H5、H7和H9亚型的阳性率分别为 0.87%(23/2 655)、1.62%(43/2 655)和 2.82%(75/2 655)(表 2)。7—9月样本中各病毒阳性检出率较低,而10—12月样本中各病毒阳性检出率呈逐渐上升趋势。根据苏州的天气记录,2013年7—12月的月平均气温分别为 36.32 ℃、35.10 ℃、28.23 ℃、23.03 ℃、17.60 ℃ 和 10.42 ℃(http://www.accuweather.com/),月平均温度的变化与H5(r=-0.906,P=0.013)、H7(r=-0.837,P=0.038)和H9(r=-0.869,P=0.024)亚型阳性检出率呈负相关,且有统计学意义。上述结果提示,气温>25 ℃时,禽流感病毒在家禽中的暴发相对减少,大致推断家禽对流感病毒的易感温度范围为12~15 ℃[18-19]。此外,本研究还发现了禽流感病毒H5、H7和H9亚型之间的混合感染:H7和H9为 0.94%(25/2 655),H5和H7为 0.08%(2/2 655),H5和H9为 0.26%(7/2 655),H5、H7和H9为 0.30%(8/2 655)。H7和H9亚型之间重组概率最高。混合感染可能产生引起人类流感大流行的强毒株。
表2咽拭子中的禽流感病毒
Tab.2Theprevalenceofavianinfluenzavirusesinswabsamples
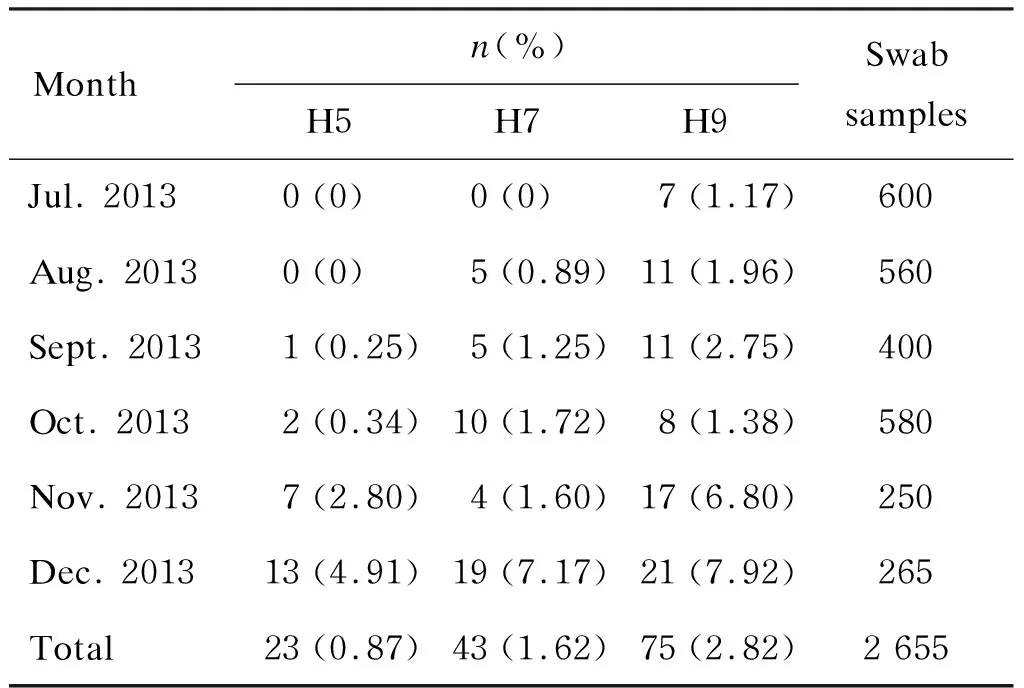
Monthn(%)H5H7H9Swab samplesJul. 20130(0)0(0)7(1.17)600Aug. 20130(0)5(0.89)11(1.96)560Sept. 20131(0.25)5(1.25)11(2.75)400Oct. 20132(0.34)10(1.72)8(1.38)580Nov. 20137(2.80)4(1.60)17(6.80)250Dec. 201313(4.91)19(7.17)21(7.92)265Total23(0.87)43(1.62)75(2.82)2 655
2.2 基因序列分析
针对得到的核酸序列,在基于HA和NA核酸序列基础上进行亚型和系统进化分析。
如图1所示,HA基因序列的系统进化分析主要基于H5、H7和H9亚型。结果显示,从苏州活禽市场中分离获得的病毒与从感染新型H7N9病毒的临床患者中分离获得的病毒(A/Anhui/1/2013株和A/Huzhou/3/2013株等)高度同源,这些毒株之间HA基因序列同源性最高为 98.7%,提示H7N9病毒存在人类与禽类之间传播的风险。

The dendrogram was constructed by using the neighbor-joining method based on the alignment of the partial sequences of the HA region of Suzhou influenza strains and other reference strains downloaded from GenBank or GISAID. Bootstrap values (%) for 1 000 replicates were calculated, and only values >80% are shown at the nodes. Red dots indicate Suzhou isolates in this study, and green triangles indicate the clinical isolates from patients.
图1流感病毒HA核苷酸序列进化树
Fig.1PhylogeneticdendrogrambasedonHAnucleotidesequencesoftheinfluenzaviruses
NA基因序列的系统进化分析主要基于N9和N2两个亚型(图2)。结果显示,从苏州活禽市场中分离获得的病毒与从长江三角洲区域患者和禽类中分离获得的新型H7N9病毒也高度同源,NA基因序列的相似率最高达 96.4%。禽类样本与临床患者样本之间的密切联系进一步明确了可能存在从家禽到人类的传播链。值得注意的是, 2013年从上海第1例感染H7N9病毒的患者中分离得到的病毒,在HA和NA进化树中同样位于新型H7N9病毒分支中的基底分支,提示2013年1月从上海患者体内分离到的禽流感病毒与苏州活禽市场样本中的禽流感病毒有同源性。
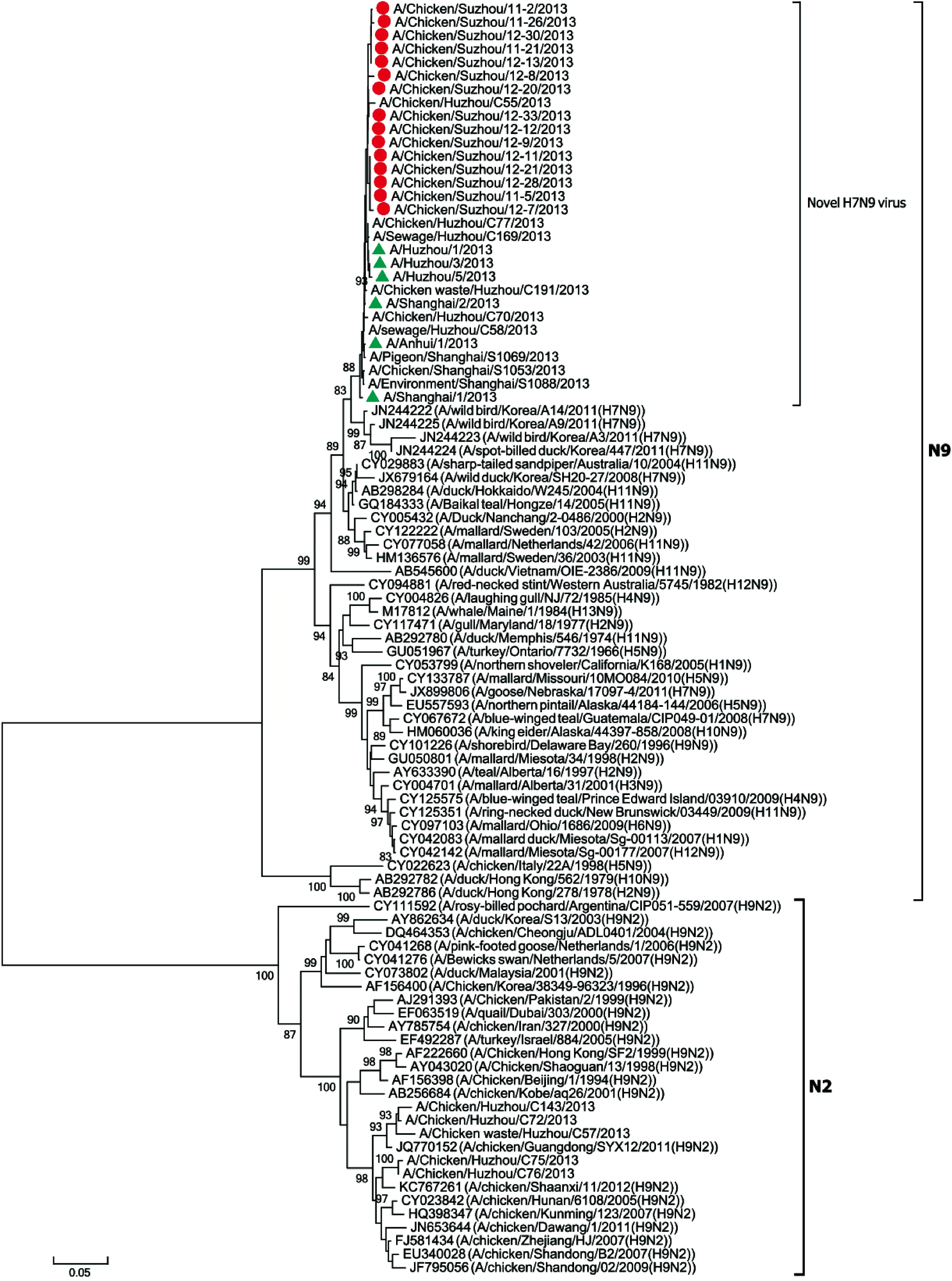
The dendrogram was constructed by using the neighbor-joining method based on the alignment of the partial sequences of the NA region of Suzhou influenza strains and other reference strains downloaded from GenBank or GISAID. Bootstrap values (%) for 1 000 replicates were calculated, and only values >80% are shown at the nodes. Red dots indicate Suzhou isolates in this study, and green triangles indicate the clinical isolates from patients.
图2流感病毒NA核苷酸序列进化树
Fig.2PhylogeneticdendrogrambasedonNAnucleotidesequencesoftheinfluenzaviruses
根据PB2基因的系统进化树可分为4个分支(图 3)。分支Ⅰ:主要为2013年分离到的H7N9病毒;分支Ⅱ:主要为2013年分离到的H9N2病毒;分支Ⅲ:主要包含2013年和2014年分离到的H9N2病毒和H7N9病毒;分支Ⅳ:主要为H5N1病毒。从苏州活禽市场样本中分离获得的病毒中,分支Ⅲ有8种,分支Ⅱ有3种。结果表明,苏州活禽市场样本中的病毒可能源于与H9N2亚型的基因重排。分支Ⅳ中,A/Chicken/Suzhou/12-8/2013株与H5N1毒株相似,表明禽类中也出现了与H5N1的基因重排。此外,H9N2两个参考株(EPI145385 和 EPI145390)作为分支Ⅲ的基础分支,其基因序列比同分支中其他H9N2株更接近A/Chicken/Suzhou/11-26/2013株。结果表明,H7N9和H9N2的PB2基因可能为相同来源,提示H7N9的PB2基因可能源于早期的H9N2毒株。
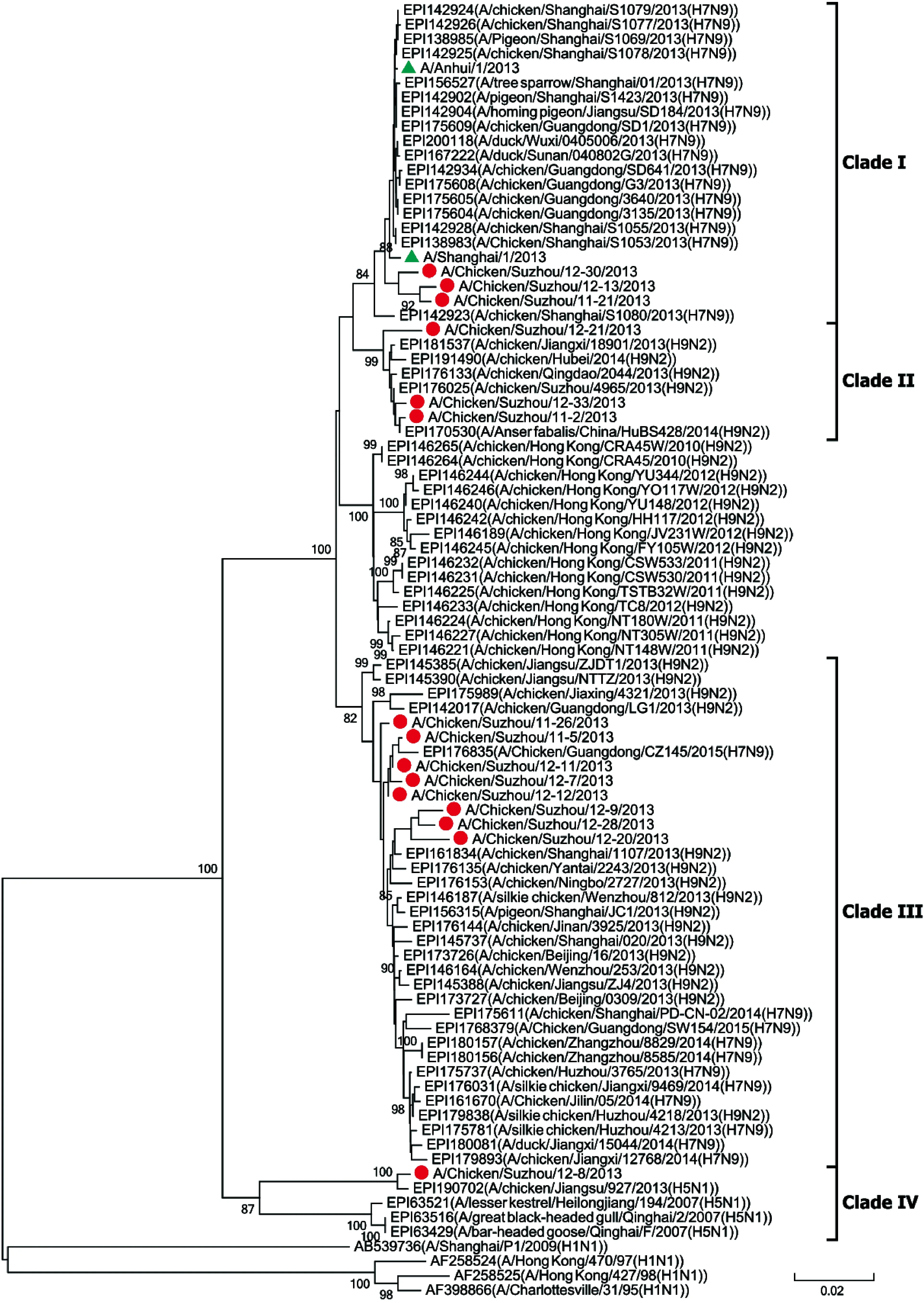
The dendrogram was constructed by using the neighbor-joining method based on the alignment of the partial sequences of the PB2 region of Suzhou influenza strains and other reference strains downloaded from GenBank or GISAID. Bootstrap values (%) for 1 000 replicates were calculated, and only values >80% are shown at the nodes. Red dots indicate Suzhou isolates in this study, and green triangles indicate the clinical isolates from patients.
图3流感病毒PB2核苷酸序列进化树
Fig.3PhylogeneticdendrogrambasedonPB2nucleotidesequencesoftheinfluenzaviruses
3 讨论
有研究表明,H9N2禽流感病毒在新型H7N9病毒的基因重排中起重要作用[20-22],而H5亚型与H9N2在进化方面密切相关[23]。通过PCR检测 2 655 份咽拭子样本中的H5、H7和H9亚型,确认苏州活禽市场中3种HA亚型的流行情况,同时探讨家禽在H7N9及相关病毒持续基因重排传代中的作用。结果显示,所有样本中H7(1.62%)和H9(2.82%)的阳性率高于H5(0.87%),表明H7与H9亚型之间更有机会发生重排。尽管HA的3种亚型存在混合感染,但H7N9与H9N2混合感染出现的频率最高。此外,所有混合感染仅存在于鸡样本中,意味着鸡体内更适合多种禽流感病毒的共存,新型病毒更容易在活禽市场产生[24]。样本阳性率随时间变化显现:从7月到9月逐渐降低,10月到12月逐渐增高。季节性温度变化影响家禽间禽流感病毒的传播,低温和相对高湿度有利于病毒传播[25-26],这可能是2013年至2014年冬季中国若干省份出现H7N9第二波暴发及迅速传播的原因。
HA和NA基因片段的进化树分析显示,从苏州活禽市场中分离获得的H7N9病毒与从周边城市上海、湖州分离获得的H7N9毒株非常接近,意味着长江三角洲区域传播的新型H7N9病毒可能有共同起源。此外,PB2基因片段的系统进化分析显示,新出现的H7N9病毒PB2基因在H9N2和H5N1中也存在,提示PB2基因片段可能是这3种病毒基因重排的结果。本研究获得的病毒中有3株接近临床患者A/Shanghai/1/2013株,A/chicken/Suzhou/12-8/2013株接近H5N1亚型,其他接近H9N2亚型。A/chicken/Suzhou/12-8/2013株接近H5N1毒株提示其他类型的基因多重重排有可能正在进行。新型H7N9病毒的PB2基因在哺乳动物感染流感病毒中起重要作用[27]。鉴于PB2基因的多重重排很可能产生能感染人类的新型禽流感病毒,苏州活禽市场需持续监控。
苏州位于中国江苏省南部,属于长江三角洲区域,拥有高密度的活禽市场和人口。在太湖,禽流感病毒在不同物种之间的共感染是病毒亚型多样化的重要条件,这也可能是与之毗邻的苏州更容易遭受禽流感病毒攻击的原因之一[28]。2013年4月苏州确诊的H7N9病毒感染事件有2例,2014年有4例,且被感染者均有近期接触家禽的经历。遗憾的是,本研究缺乏确诊案例中H7N9病毒的序列,无法阐明活禽市场所获病毒与2014年H7N9感染病例之间的关系。但值得注意的是,苏州可能是H7N9病毒的传播来源之一。2013年4月和2015年1月,苏州市政府关闭活禽市场以控制H7N9病毒的流行,同时还禁止一些小规模农贸市场中的个体农户出售活禽。这些措施是有效的,因为2015年仅零星出现了人感染病例。但长期关闭活禽市场不现实,考虑到之前提出的禽流感病毒的季节性变化,因此对活禽市场的监测应主要放在冬季。禽流感病毒在家禽中的高流行率、遗传多样性和广泛的宿主范围意味着其能持续通过重排形成新病毒,并可能引起再次流行。因此,受影响地区急需对家禽中所有禽流感病毒亚型进行持续监测,用整个8序列片段来检测基因重排病毒也值得考虑。在中国,改善家禽饲养方式及监控家禽供应链中的每一个环节均对流感防控至关重要。
[1] Tang J, Wang D. Research progress in human infection with avian influenza H7N9 virus [J]. Sci China Life Sci, 2017, 60(12): 1299-1306.
[2] Kang M, Lau EHY, Guan W, Yang Y, Song T, Cowling BJ, Wu J, Peiris M, He J, Mok CKP. Epidemiology of human infections with highly pathogenic avian influenza A(H7N9) virus in Guangdong, 2016 to 2017 [J]. Euro Surveill, 2017, 22(27). doi: 10.2807/1560-7917.ES.2017.22.27.30568.
[3] Artois J, Jiang H, Wang X, Qin Y, Pearcy M, Lai S, Shi Y, Zhang J, Peng Z, Zheng J, He Y, Dhingra MS, von Dobschuetz S, Guo F, Martin V, Kalpravidh W, Claes F, Robinson T, Hay SI, Xiao X, Feng L, Gilbert M, Yu H. Changing geographic patterns and risk factors for avian influenza A (H7N9) infections in humans, China [J]. Emerg Infect Dis, 2018, 24(1): 87-94.
[4] Yu H, Cowling BJ, Feng L, Lau EH, Liao Q, Tsang TK, Peng Z, Wu P, Liu F, Fang VJ, Zhang H, Li M, Zeng L, Xu Z, Li Z, Luo H, Li Q, Feng Z, Cao B, Yang W, Wu JT, Wang Y, Leung GM. Human infection with avian influenza A H7N9 virus: an assessment of clinical severity [J]. Lancet, 2013, 382(9887): 138-145.
[5] Gao HN, Lu HZ, Cao B, Du B, Shang H, Gan JH, Lu SH, Yang YD, Fang Q, Shen YZ, Xi XM, Gu Q, Zhou XM, Qu HP, Yan Z, Li FM, Zhao W, Gao ZC, Wang GF, Ruan LX, Wang WH, Ye J, Cao HF, Li XW, Zhang WH, Fang XC, He J, Liang WF, Xie J, Zeng M, Wu XZ, Li J, Xia Q, Jin ZC, Chen Q, Tang C, Zhang ZY, Hou BM, Feng ZX, Sheng JF, Zhong NS, Li LJ. Clinical findings in 111 cases of influenza A (H7N9) virus infection [J]. N Engl J Med, 2013, 368(24): 2277-2285.
[6] Li Q, Zhou L, Zhou M, Chen Z, Li F, Wu H, Xiang N, Chen E, Tang F, Wang D, Meng L, Hong Z, Tu W, Cao Y, Li L, Ding F, Liu B, Wang M, Xie R, Gao R, Li X, Bai T, Zou S, He J, Hu J, Xu Y, Chai C, Wang S, Gao Y, Jin L, Zhang Y, Luo H, Yu H, He J, Li Q, Wang X, Gao L, Pang X, Liu G, Yan Y, Yuan H, Shu Y, Yang W, Wang Y, Wu F, Uyeki TM, Feng Z. Epidemiology of human infections with avian influenza A(H7N9) virus in China [J]. N Engl J Med, 2014, 370(6): 520-532.
[7] Yu H, Wu JT, Cowling BJ, Liao Q, Fang VJ, Zhou S, Wu P, Zhou H, Lau EH, Guo D, Ni MY, Peng Z, Feng L, Jiang H, Luo H, Li Q, Feng Z, Wang Y, Yang W, Leung GM. Effect of closure of live poultry markets on poultry-to-person transmission of avian influenza A H7N9 virus: an ecological study [J]. Lancet, 2014, 383(9916): 541-548.
[8] Nguyen DC, Uyeki TM, Jadhao S, Maines T, Shaw M, Matsuoka Y, Smith C, Rowe T, Lu X, Hall H, Xu X, Balish A, Klimov A, Tumpey TM, Swayne DE, Huynh LP, Nghiem HK, Nguyen HHT, Hoang LT, Cox NJ, Katz JM. Isolation and characterization of avian influenza viruses, including highly pathogenic H5N1, from poultry in live bird markets in Hanoi, Vietnam, in 2001 [J]. J Virol, 2005, 79(7): 4201-4212.
[9] Wan XF, Dong L, Lan Y, Long LP, Xu C, Zou S, Li Z, Wen L, Cai Z, Wang W, Li X, Yuan F, Sui H, Zhang Y, Dong J, Sun S, Gao Y, Wang M, Bai T, Yang L, Li D, Yang W, Yu H, Wang S, Feng Z, Wang Y, Guo Y, Webby RJ, Shu Y. Indications that live poultry markets are a major source of human H5N1 influenza virus infection in China [J]. J Virol, 2011, 85(24): 13432-13438.
[10] Paul M, Baritaux V, Wongnarkpet S, Poolkhet C, Thanapongtharm W, Roger F, Bonnet P, Ducrot C. Practices associated with highly pathogenic avian influenza spread in traditional poultry marketing chains: Social and economic perspectives [J]. Acta Trop, 2013, 126(1): 43-53.
[11] Liu D, Shi W, Shi Y, Wang D, Xiao H, Li W, Bi Y, Wu Y, Li X, Yan J, Liu W, Zhao G, Yang W, Wang Y, Ma J, Shu Y, Lei F, Gao GF. Origin and diversity of novel avian influenza A H7N9 viruses causing human infection: phylogenetic, structural, and coalescent analyses [J]. Lancet, 2013, 381(9881): 1926-1932.
[12] Gao R, Cao B, Hu Y, Feng Z, Wang D, Hu W, Chen J, Jie Z, Qiu H, Xu K, Xu X, Lu H, Zhu W, Gao Z, Xiang N, Shen Y, He Z, Gu Y, Zhang Z, Yang Y, Zhao X, Zhou L, Li X, Zou S, Zhang Y, Li X, Yang L, Guo J, Dong J, Li Q, Dong L, Zhu Y, Bai T, Wang S, Hao P, Yang W, Zhang Y, Han J, Yu H, Li D, Gao GF, Wu G, Wang Y, Yuan Z, Shu Y. Human infection with a novel avian-origin influenza A (H7N9) virus [J]. N Engl J Med, 2013, 368(20): 1888-1897.
[13] Lam TT, Wang J, Shen Y, Zhou B, Duan L, Cheung CL, Ma C, Lycett SJ, Leung CY, Chen X, Li L, Hong W, Chai Y, Zhou L, Liang H, Ou Z, Liu Y, Farooqui A, Kelvin DJ, Poon LL, Smith DK, Pybus OG, Leung GM, Shu Y, Webster RG, Webby RJ, Peiris JS, Rambaut A, Zhu H, Guan Y. The genesis and source of the H7N9 influenza viruses causing human infections in China [J]. Nature, 2013, 502(7470): 241-244.
[14] Wu A, Su C, Wang D, Peng Y, Liu M, Hua S, Li T, Gao GF, Tang H, Chen J, Liu X, Shu Y, Peng D, Jiang T. Sequential reassortments underlie diverse influenza H7N9 genotypes in China [J]. Cell Host Microbe, 2013, 14(4): 446-452.
[15] Han J, Wang L, Liu J, Jin M, Hao F, Zhang P, Zhang Z, Wen D, Wu X, Liu G, Ji L, Xu D, Zhou D, Leng Q, Lan K, Zhang C. Cocirculation of three hemagglutinin and two neuraminidase subtypes of avian influenza viruses in Huzhou, China, April 2013: implication for the origin of the novel H7N9 virus [J]. J Virol, 2014, 88(11): 6506-6511.
[16] Sun Y, Wang H, Lou X, Mao H, Yan Y, Chen E, Wang X, Li Z, Gao J, Fu X, Chen Z, Feng Y, Chen Z, Zhang Y. Living poultry markets in rural area: Human infection with H7N9 virus re-emerges in Zhejiang Province, China, in winter 2014 [J]. J Clin Virol, 2015, 70: 16-22.
[17] Zhou D, Wu TL, Lasaro MO, Latimer BP, Parzych EM, Bian A, Li Y, Li H, Erikson J, Xiang Z, Ertl HC. A universal influenza A vaccine based on adenovirus expressing matrix-2 ectodomain and nucleoprotein protects mice from lethal challenge [J]. Mol Ther, 2010, 18(12): 2182-2189.
[18] Fang LQ, Li XL, Liu K, Li YJ, Yao HW, Liang S, Yang Y, Feng ZJ, Gray GC, Cao WC. Mapping spread and risk of avian influenza A (H7N9) in China [J]. Sci Rep, 2013, 3: 2722. doi: 10.1038/srep02722.
[19] Zhang Z, Chen D, Chen Y, Wang B, Hu Y, Gao J, Sun L, Li R, Xiong C. Evaluating the impact of environmental temperature on global highly pathogenic avian influenza (HPAI) H5N1 outbreaks in domestic poultry [J]. Int J Environ Res Public Health, 2014, 11(6): 6388-6399.
[20] Zhang L, Zhang Z, Weng Z. Rapid reassortment of internal genes in avian influenza A(H7N9) virus [J]. Clin Infect Dis, 2013, 57(7): 1059-1061.
[21] Yu X, Jin T, Cui Y, Pu X, Li J, Xu J, Liu G, Jia H, Liu D, Song S, Yu Y, Xie L, Huang R, Ding H, Kou Y, Zhou Y, Wang Y, Xu X, Yin Y, Wang J, Guo C, Yang X, Hu L, Wu X, Wang H, Liu J, Zhao G, Zhou J, Pan J, Gao GF, Yang R, Wang J. Influenza H7N9 and H9N2 viruses: coexistence in poultry linked to human H7N9 infection and genome characteristics [J]. J Virol, 2014, 88(6): 3423-3431.
[22] Liu W, Fan H, Raghwani J, Lam TT, Li J, Pybus OG, Yao HW, Wo Y, Liu K, An XP, Pei GQ, Li H, Wang HY, Zhao JJ, Jiang T, Ma MJ, Xia X, Dong YD, Zhao TY, Jiang JF, Yang YH, Guan Y, Tong Y, Cao WC. Occurrence and reassortment of avian influenza A (H7N9) viruses derived from coinfected birds in China [J]. J Virol, 2014, 88(22): 13344-13351.
[23] Iqbal M, Yaqub T, Reddy K, McCauley JW. Novel genotypes of H9N2 influenza A viruses isolated from poultry in Pakistan containing NS genes similar to highly pathogenic H7N3 and H5N1 viruses [J]. PLoS One, 2009, 4(6): e5788.
[24] Chen Y, Liang W, Yang S, Wu N, Gao H, Sheng J, Yao H, Wo J, Fang Q, Cui D, Li Y, Yao X, Zhang Y, Wu H, Zheng S, Diao H, Xia S, Zhang Y, Chan KH, Tsoi HW, Teng JL, Song W, Wang P, Lau SY, Zheng M, Chan JF, To KK, Chen H, Li L, Yuen KY. Human infections with the emerging avian influenza A H7N9 virus from wet market poultry: clinical analysis and characterisation of viral genome [J]. Lancet, 2013, 381(9881): 1916-1925.
[25] Lowen AC, Mubareka S, Steel J, Palese P. Influenza virus transmission is dependent on relative humidity and temperature [J]. PLoS Pathog, 2007, 3(10): 1470-1476.
[26] Soebiyanto RP, Adimi F, Kiang RK. Modeling and predicting seasonal influenza transmission in warm regions using climatological parameters [J]. PLoS One, 2010, 5(3): e9450.
[27] Yamayoshi S, Fukuyama S, Yamada S, Zhao D, Murakami S, Uraki R, Watanabe T, Tomita Y, Neumann G, Kawaoka Y. Amino acids substitutions in the PB2 protein of H7N9 influenza A viruses are important for virulence in mammalian hosts [J]. Sci Rep, 2015, 5: 8039. doi: 10.1038/srep08039.
[28] Sharp GB, Kawaoka Y, Jones DJ, Bean WJ, Pryor SP, Hinshaw V, Webster RG. Coinfection of wild ducks by influenza A viruses: distribution patterns and biological significance [J]. J Virol, 1997, 71(8): 6128-6135.
