不同血清量标本外泌体提取及微小RNA的检测结果比较
2018-06-12王倩倩卢川陈良黄玉仙
王倩倩,卢川,陈良,黄玉仙
1. 复旦大学附属公共卫生临床中心肝炎一科,上海 201508; 2. 复旦大学附属华山医院感染科,上海 200040
1985年Pan等[1]首次发现,外泌体是哺乳动物网织红细胞成熟过程中分泌的直径为40~100 nm的膜性小囊泡,电子显微镜下呈茶托形或一侧凹陷的半球形。外泌体由体内各种活细胞分泌,广泛分布于血液、尿液、乳汁等体液中[2]。外泌体含有丰富的蛋白质、脂质、微小RNA(microRNA, miRNA)等内容物[3],这些生物信息分子会随疾病进展、转归发生变化,是颇具临床诊断价值的循环标记[4-5]。因此,提取高纯度的外泌体用于后续临床诊断具有重要实用价值[6]。根据外泌体的大小、密度和表面标记等物理化学性质,目前获取外泌体的方法有经典的超速离心法、沉淀法、免疫亲和捕获法、分子排阻层析等[7-11]。近几年来,德国Qiagen公司研发的外泌体提取试剂盒exoRNeasy利用膜亲和吸附原理,可直接获取血清外泌体的总RNA[12],便于操作且效率高,适用于大规模提取血清标本进行后续miRNA测序和 定量聚合酶链反应(polymerase chain reaction,PCR)等实验[13]。但是,exoRNeasy操作手册规定提取血清外泌体所需标准血清量为1~4 mL ,而临床实践中患者血清标本珍贵且体积有限,能否用较少的血清量达到预期的实验效果值得探索。本研究以健康人和慢性乙型肝炎(chronic hepatitis B,CHB)患者血清为样本,利用exoRNeasy Serum/Plasma Midi试剂盒提取250、500、1 000 μL血清外泌体中RNA,并对miRNA相对表达量进行对比分析,选取能检测外泌体中miRNA的最小血清体积,为后续研究提供实验依据。
1 材料与方法
1.1 研究对象
随机筛选2017年9—11月上海市公共卫生临床中心肝病科乙型肝炎病毒e抗原(hepatitis B virus e antigen, HBeAg)阳性CHB初治患者9例,无基础疾病健康者9例。采集静脉血5 mL,加入含分离胶的促凝管,室温静置至少30 min,3 000g离心 15 min,取上层淡黄色血清约 2 mL,置-80 ℃冰箱备用。本研究通过了上海市公共卫生临床中心医学伦理委员会批准,志愿者均签署了知情同意书。
1.2 方法
1.2.1仪器与试剂外泌体RNA提取试剂盒为exoRNeasy Serum/Plasma Midi Kit(德国Qiagen公司,cat.no.77044)。透射电子显微镜型号Philips CM120(荷兰Philips公司)。兔单抗Anti-CD63 [EPR5702](ab134045)、兔单抗Anti-TSG101 [EPR7130(B)](ab125011)购自英国Abcam公司,β-actin [GT5512]购自美国GeneTex公司。Stepone plus实时荧光定量PCR仪购自美国Applied Biosystems公司。TaqManTMMicroRNA Reverse Transcription Kit购自美国Applied Biosystems公司,Bulge-Loop Reverse Transcription Primers购自广州市锐博生物科技有限公司,Thunderbird SYBR qPCR Mix购自日本Toyobo公司。miR-122反转录引物序列为hsa-miR-122-3p:5′-AACGCCAUUAUCACACUAA-AUA-3′,由广州市锐博生物科技生物有限公司合成。
1.2.2血清中外泌体的提取德国Qiagen公司exoRNeasy Serum/Plasma Midi Kit使用膜亲和结合步骤从血清中分离外泌体,步骤简述如下。①血清梯度离心步骤: 4 ℃, 2 000g离心10 min,去除死细胞,取上清液继续 10 000g离心30 min;然后 14 000g离心10 min,彻底去除血清中的细胞碎片,进行后续外泌体的提取(图1)。②正常人和CHB患者血清分别取250、500、1 000 μL,加入磷酸盐缓冲液(phosphate buffered saline,PBS)稀释至总体积均为 1 000 μL,然后按试剂盒说明书操作,可获得外泌体,用于后续鉴定。
1.2.3外泌体生物学特性鉴定①透射电子显微镜形态观察[12]:用50 μL PBS溶解Qiagen试剂盒提取的1 mL血清中的外泌体。采用磷钨酸负染色法,将Parafilm膜平整黏贴于玻璃表面,50 μL样品滴于膜上,带有Formvar支持膜的铜网覆盖在样品液滴上,使其漂浮3~10 min。将50 μL 2%磷钨酸染液滴于Parafilm膜上,用滤纸沿铜网边缘吸干液体。白炽灯下干燥10 min,备用。透射电子显微镜下观察。②蛋白免疫印迹法检测外泌体标记蛋白[12]:用50 μL RIPA裂解液裂解Qiagen试剂盒提取的1 mL血清中的外泌体,进行12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE),10~15 mA恒流电泳3~4 h。然后以湿转法将SDS-PAGE凝胶上的蛋白转至硝酸纤维素(nitrocellulose,NC)膜,用含5%脱脂奶粉的含吐温20的PBS(PBS with Tween 20,PBST)封闭液置于摇床,室温封闭1 h以上。加入一抗(1∶1 000 封闭液稀释),4 ℃过夜。次日,PBST 洗膜(5 min,3次)后加入相应的二抗室温反应2 h,加入化学发光底物显色观察。
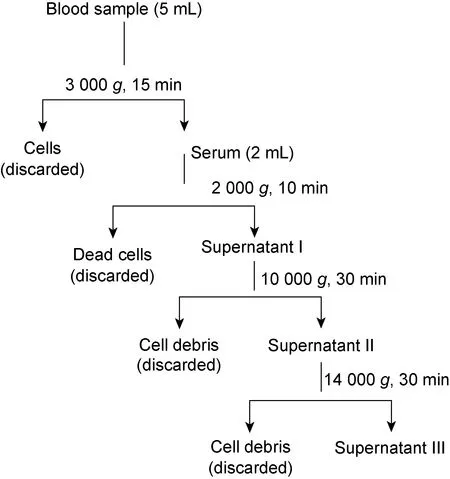
Cells, fragments, apoptotic bodies and other components in serum were completely removed by gradient centrifugation and then the serum was used to isolate exosomes.
图1血清梯度离心流程图
Fig.1Flowchartofgradientcentrifugationofserum
1.2.4血清外泌体总RNA提取及miRNA检测[14]外泌体中总RNA提取按Qiagen公司试剂盒exoRNeasy Serum/Plasma Midi Kit 说明书操作。使用QIAzol 裂解结合于离心柱膜上的外泌体,在 QIAzol 洗脱液中加入氯仿,回收水相与乙醇混合。将所有液体转移至RNeasy MinElute离心柱中瞬离30 s,然后用Buffer RWT和RPE洗3 次,离心,最后加14 μL RNase-free水,获得总RNA。取11 μL RNase-free水溶解的外泌体总RNA,加入5 μL反转录引物Mix,70 ℃放置 10 min,冰上孵育2 min。然后加入反转录体系进行miRNA特异性反转录,获得20 μL cDNA产物。将cDNA原液稀释4倍后,取2 μL行实时荧光定量PCR检测。反应条件:95 ℃预变性 1 min;95 ℃变性10 s,60 ℃退火延伸 30 s, 40个循环。以外源性线虫cel-miR-39 为内参基因,2-△△Ct值表示miR-122的相对表达量。
1.3 统计学处理
采用SPSS 17.0进行统计学分析。应用 K-S 检验对数据进行正态性检验,两组间计量数据比较采用F检验和t检验,3组间计量数据比较采用单因素方差分析;分类资料采用卡方检验。P<0.05 为差异有统计学意义。
2 结果
2.1 外泌体形态学鉴定
透射电子显微镜(×46 000)观察显示,采用exoRNeasy Serum/Plasma Midi Kit获得的外泌体为大小不等的圆形至椭圆形囊泡状结构,可呈分散或聚集分布,由染色较深的脂质双层膜及其内染色较淡的低电子密度物质组成,囊泡粒径大小多分布于40~100 nm,与文献报道的 30~150 nm 基本一致(图2)。
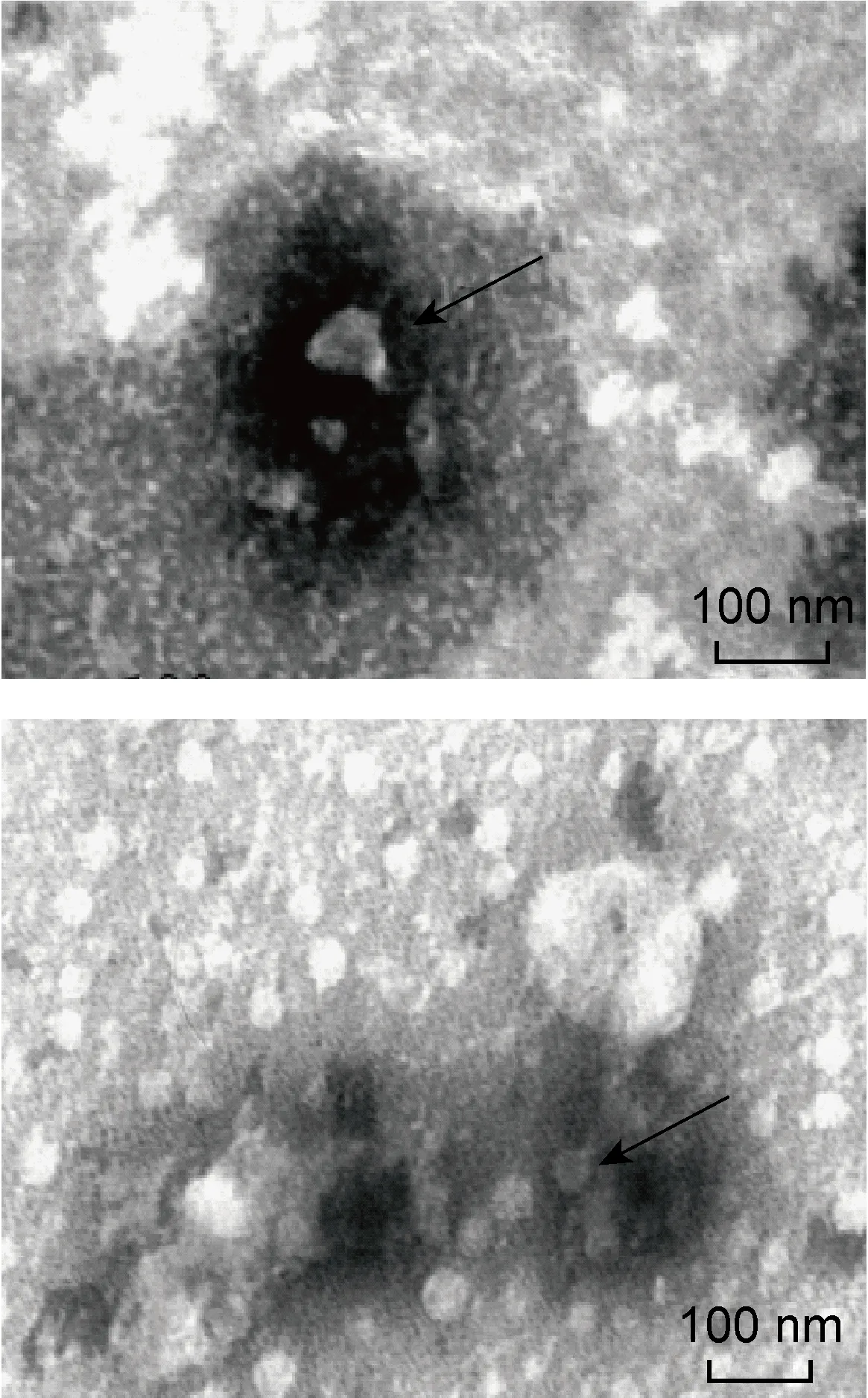
The arrows refer to the exosomes.
图2透射电子显微镜观察Qiagen试剂盒提取的外泌体
Fig.2TransmissionelectronmicroscopyofserumexosomesisolatedbyQiagenexoRNeasySerum/PlasmaMidiKit
2.2 外泌体表面标记蛋白的表达鉴定
采用蛋白免疫印迹法检测外泌体标记蛋白的表达情况。结果显示,exoRNeasy Serum/Plasma Midi Kit提取的外泌体表达其表面特异性标记蛋白TSG101和CD63,但内参β-actin阴性;对照样品中TSG101和CD63低表达,β-actin阳性。结果表明, exoRNeasy Serum/Plasma Midi Kit从血清中提取的外泌体确实存在(图3)。
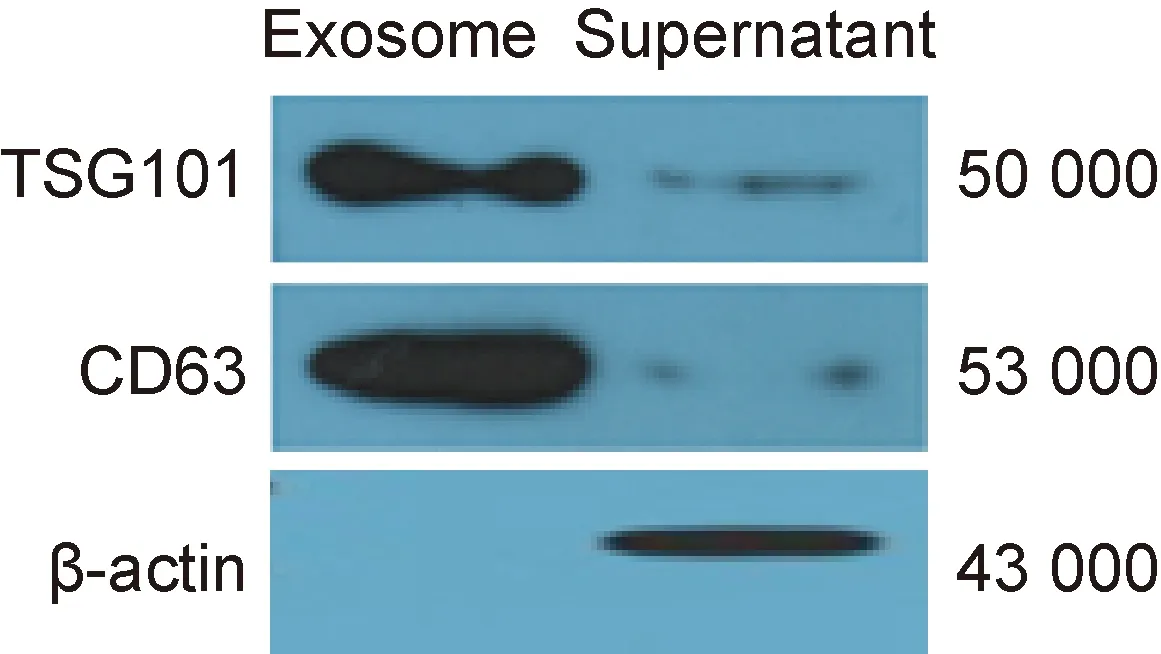
图3蛋白免疫印迹法检测外泌体和非外泌体的标记
Fig.3Westernblottinganalysisofexosomalandnonexosomalmarkers
2.3 实时荧光定量 PCR 检测从不同体积血清中提取的外泌体中 miR-122的表达
miR-122是肝细胞中含量最丰富的miRNA,占肝脏总miRNA的70%,且与肝脏生理功能密切相关,它能通过结合病毒RNA来直接抑制乙型肝炎病毒(hepatitis B virus,HBV)复制[15]。很多研究报道血清miR-122可作为肝脏损伤的生物标记,且其水平与丙氨酸氨基转氨酶(alanine aminotransferase,ALT)、HBV DNA和HBV表面抗原(HBV surface antigen,HBsAg)密切相关[16-17]。研究表明,与正常人相比,CHB患者尤其是HBeAg阳性患者循环中miR-122水平升高[18],因此本实验选取miR-122来比较HBeAg阳性CHB患者与健康人从不同量血清中提取的外泌体中miRNA表达量。采用exoRNeasy Serum/Plasma Midi Kit提取CHB患者和健康人血清外泌体的总RNA,反转录为cDNA后行实时荧光定量PCR检测。内参基因cel-miR-39在不同类型的样本中表达水平稳定,循环阈值(cycle threshold,Ct)约为13。结果显示, CHB 患者和健康人的血清体积每增加1倍,Ct值递减一个循环,PCR信号随血清体积呈线性增加。采用实时荧光定量 PCR 检测CHB患者和健康人从不同体积血清中提取的外泌体中miR-122表达情况,初始血清量分别为250、500、1 000 μL,CHB患者miR-122表达量比健康人分别上调 22.44、21.48、20.69 倍(P=0.42)(图4~5)。
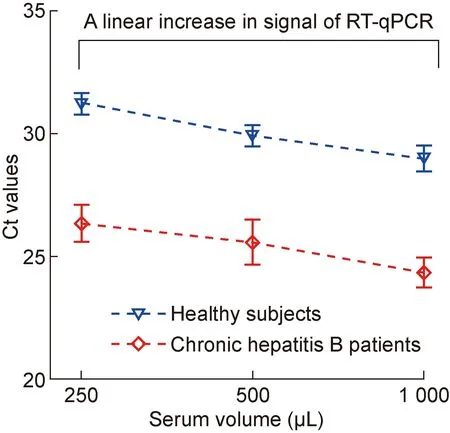
图4实时荧光定量PCR检测血清外泌体中miR-122的Ct值
Fig.4TheCtvalueofmiR-122inserumexosomesdetectedbyreal-timefluorescentquantitativePCR
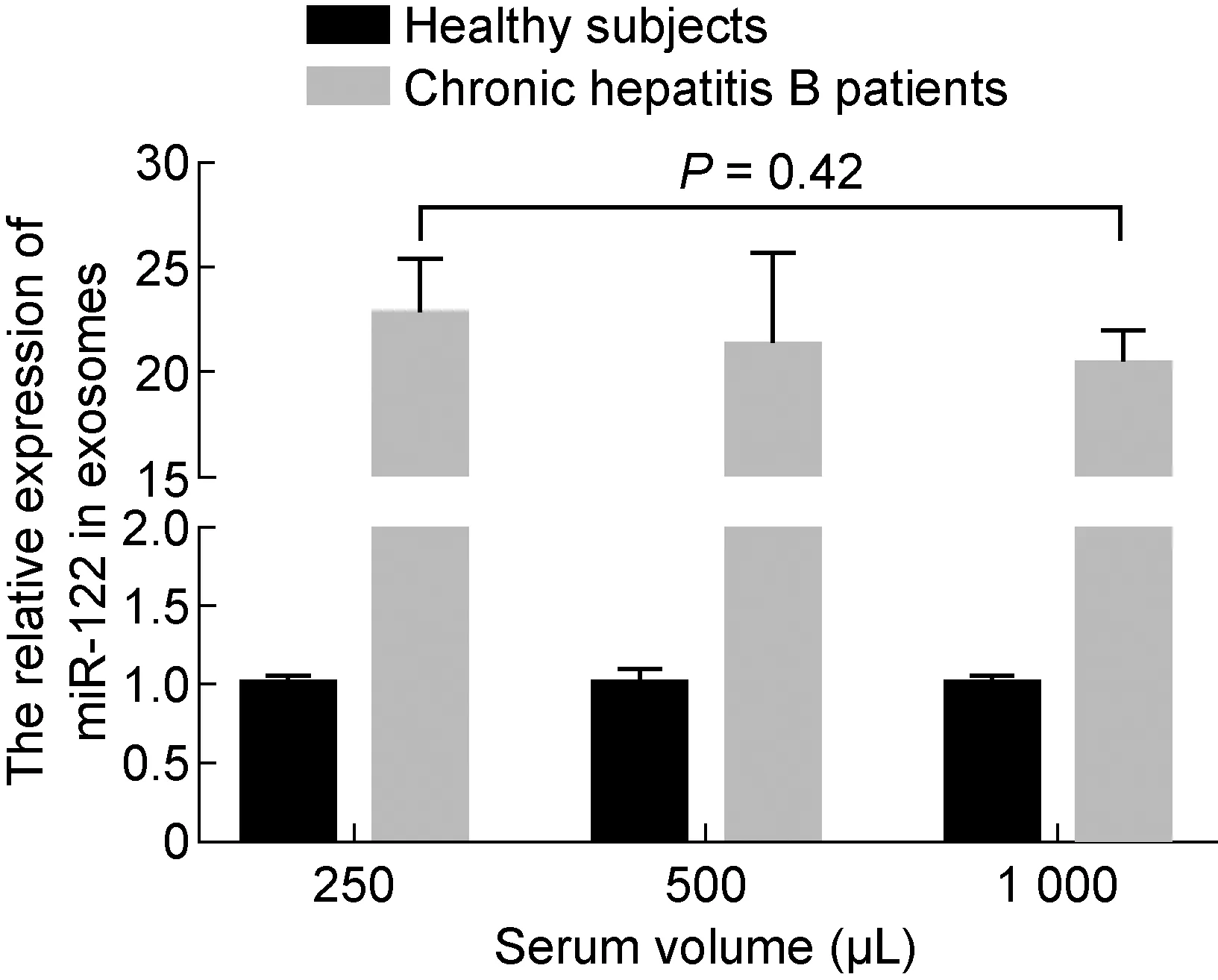
图5实时荧光定量PCR检测健康人和慢性乙型肝炎患者不同血清量外泌体中miR-122的表达
Fig.5TheexpressionofmiR-122inexosomesfromserumwithdifferentvolumeinchronichepatitisBpatientsandhealthysubjectsdetectedbyreal-timefluorescentquantitativePCR
3 讨论
外泌体是由多种细胞分泌的膜性生物运输体,其内容物种类繁多。外泌体的生物功能有物质运输、信息传递和免疫调节等,还携带大量病理生理生物标记信息。外泌体被释放至体液和微环境时,可携带生物信息进行长距离的细胞间通讯。研究表明,外泌体在临床诊断和治疗中有广阔应用前景[19],在心血管疾病[20]、神经系统疾病[21]、肿瘤[22]和肝脏疾病[23]诊治中扮演着极其重要的角色。很多研究发现,外泌体源性miRNA可作为一种生物标记用于疾病诊断和预后。外泌体膜结构的保护使体液中外泌体源性miRNA等不易被破坏,具有更好的抗降解能力,因此是一种理想的非侵入性“液体活检”方法[24]。
迄今为止,虽然血清外泌体的提取方法很多,但最大的局限性是缺少标准化的外泌体分离方法,以及样本的收集和处理方法,如何获取高质量外泌体及其内含物仍是困扰研究者们的一个难题。经典的差速超速离心法富集外泌体步骤繁琐耗时,技术要求高,所需血清量多;基于聚合物沉淀的方法提取的外泌体纯度低,掺杂很多杂质;基于表面蛋白标记亲和分离方法获得的为某个蛋白标记阳性的外泌体亚群,不能反映外泌体的整体情况[10-11];凝胶尺寸排阻色谱分离的外泌体缺乏特异性,符合过滤尺寸内的任何微粒包括细胞碎片、血小板和淋巴细胞等都会被分离出来,不利于下游分析。本研究使用最新的膜亲和离心柱方法提取血清中外泌体及外泌体中RNA,可高效率、低损失地获得外泌体RNA,适合临床实验室工作,有利于下游的分析验证[25]。
本研究通过电子显微镜和蛋白免疫印迹法对exoRNeasy Serum/Plasma Midi Kit提取的外泌体生物学形态和表面标记蛋白进行验证。结果显示,外泌体在电子显微镜下显示为直径30~100 nm的脂质双层膜的囊泡状结构,其表面表达外泌体特征性蛋白TSG101和CD63,但不表达β-actin,证实该方法提取的确实是外泌体。exoRNeasy Serum/Plasma Midi Kit操作手册中标准血清量为1 mL,但当临床血清资源有限时,250或500 μL血清能否达到同样的实验效果,本研究对此进行了初步探索,用实时荧光定量PCR对CHB与健康人不同体积血清中提取的外泌体miR-122表达量进行分析。结果显示,血清体积每增加1倍,Ct值递减1个循环,PCR信号随血清体积呈线性增加。针对不同初始血清量,CHB患者miR-122表达量相比健康人升高的倍数没有统计学差异。因此,利用exoRNeasy Serum/Plasma Midi Kit提取外泌体中miRNA验证表达差异时,少量血清可达到与1 mL血清相同的结果,这对解决临床血清资源有限这一问题有实际意义。
本研究也存在一定局限性。首先,本研究例数较少,后续需扩大样本量,进一步评价该方法的临床应用价值。其次,对于CHB患者血清中表达丰度较低的miRNA是否可达到相同的验证效果,还需进一步探索。
综上所述,使用Qiagen exoRNeasy Serum/Plasma Midi Kit提取血清外泌体时,需根据研究的疾病、目的、下游实验设计及实际样本量来综合考虑实验使用的血清量。
[1] Pan BT, Teng K, Wu C, Adam M, Johnstone RM. Electron microscopic evidence for externalization of the transferrin receptor in vesicular form in sheep reticulocytes [J]. J Cell Biol, 1985, 101(3): 942-948.
[2] Chevillet JR, Kang Q, Ruf IK, Briggs HA, Vojtech LN, Hughes SM, Cheng HH, Arroyo JD, Meredith EK, Gallichotte EN, Pogosova-Agadjanyan EL, Morrissey C, Stirewalt DL, Hladik F, Yu EY, Higano CS, Tewari M. Quantitative and stoichiometric analysis of the microRNA content of exosomes [J]. Proc Natl Acad Sci USA, 2014, 111(41): 14888-14893.
[3] Keerthikumar S, Chisanga D, Ariyaratne D, Al Saffar H, Anand S, Zhao K, Samuel M, Pathan M, Jois M, Chilamkurti N, Gangoda L, Mathivanan S. ExoCarta: A web-based compendium of exosomal cargo [J]. J Mol Biol, 2016, 428(4): 688-692.
[4] Denzer K, Kleijmeer MJ, Heijnen HF, Stoorvogel W, Geuze HJ. Exosome: from internal vesicle of the multivesicular body to intercellular signaling device [J]. J Cell Sci, 2000, 113(Pt 19): 3365-3374.
[5] Michael A, Bajracharya SD, Yuen PS, Zhou H, Star RA, Illei GG, Alevizos I. Exosomes from human saliva as a source of microRNA biomarkers [J]. Oral Dis, 2010, 16(1): 34-38.
[6] 黄依瑶,唐月汀,覃思华,徐咏, 安泰学, 郑磊.血清中外泌体及外泌体RNA提取方法的比较 [J].中华检验医学杂志,2016,39(6):427-432.
[7] Zeringer E, Barta T, Li M, Vlassov AV. Strategies for isolation of exosomes [J]. Cold Spring Harb Protoc, 2015(4): 319-323.
[8] Szabo G, Momen-Heravi F. Extracellular vesicles in liver disease and potential as biomarkers and therapeutic targets [J]. Nat Rev Gastroenterol Hepatol, 2017, 14(8): 455-466.
[9] 王鑫伟,毛建文.试剂盒法与差速超速离心法所提血清外泌体的形态学比较 [J].临床与病理杂志,2016,36(11):1837-1841.
[10] Tauro BJ, Greening DW, Mathias RA, Ji H, Mathivanan S, Scott AM, Simpson RJ. Comparison of ultracentrifugation, density gradient separation, and immunoaffinity capture methods for isolating human colon cancer cell line LIM 1863-derived exosomes [J]. Methods, 2012, 56:293-304.
[11] Théry C, Amigorena S, Raposo G, Clayton A. Isolation and characterization of exosomes from cell culture supernatants and biological fluids [J]. Curr Protoc Cell Biol, 2006. doi: 10.1002/0471143030.cb0322s30.
[12] Enderle D, Spiel A, Coticchia CM, Berghoff E, Mueller R, Schlumpberger M, Sprenger-Haussels M, Shaffer JM, Lader E, Skog J, Noerholm M. Characterization of RNA from exosomes and other extracellular vesicles isolated by a novel spin column-based method [J]. PLoS One, 2015, 10(8): e0136133.
[13] Tang YT, Huang YY, Zheng L, Qin SH, Xu XP, An TX, Xu Y, Wu YS, Hu XM, Ping BH, Wang Q. Comparison of isolation methods of exosomes and exosomal RNA from cell culture medium and serum [J]. Int J Mol Med, 2017, 40(3): 834-844.
[14] Li J, Zhang X, Chen L, Zhang Z, Zhang J, Wang W, Wu M, Shi B, Zhang X, Kozlowski M, Hu Y, Yuan Z. Circulating miR-210 and miR-22 combined with ALT predict the virological response to interferon-alpha therapy of CHB patients [J]. Sci Rep, 2017, 7(1): 15658.
[15] Lamontagne J, Steel LF, Bouchard MJ. Hepatitis B virus and microRNAs: Complex interactions affecting hepatitis B virus replication and hepatitis B virus-associated diseases [J]. World J Gastroenterol, 2015, 21(24): 7375-7399.
[16] Bala S, Petrasek J, Mundkur S, Catalano D, Levin I, Ward J, Alao H, Kodys K, Szabo G. Circulating microRNAs in exosomes indicate hepatocyte injury and inflammation in alcoholic, drug-induced, and inflammatory liver diseases [J]. Hepatology, 2012, 56(5): 1946-1957.
[17] Zhang X, Zhang Z, Dai F, Shi B, Chen L, Zhang X, Zang G, Zhang J, Chen X, Qian F, Hu Y, Yuan Z. Comparison of circulating, hepatocyte specific messenger RNA and microRNA as biomarkers for chronic hepatitis B and C [J]. PLoS One, 2014, 9(3): e92112.
[18] Arataki K, Hayes CN, Akamatsu S, Akiyama R, Abe H, Tsuge M, Miki D, Ochi H, Hiraga N, Imamura M, Takahashi S, Aikata H, Kawaoka T, Kawakami H, Ohishi W, Chayama K. Circulating microRNA-22 correlates with microRNA-122 and represents viral replication and liver injury in patients with chronic hepatitis B [J]. J Med Virol, 2013, 85(5): 789-798.
[19] 王仁峰,耿振,李朝阳,鲍会静,李雪,周迪苏,宋士伟,刘运德.ExoQuick提取人血清外泌体方法改良及比较 [J].实用医学杂志,2015,31(15):2458-2462.
[20] Widera C, Gupta SK, Lorenzen JM, Bang C, Bauersachs J, Bethmann K, Kempf T, Wollert KC, Thum T. Diagnostic and prognostic impact of six circulating microRNAs in acute coronary syndrome [J]. J Mol Cell Cardiol, 2011, 51(5): 872-875.
[21] Lugli G, Cohen AM, Bennett DA, Shah RC, Fields CJ, Hernandez AG, Smalheiser NR. Plasma exosomal miRNAs in persons with and without Alzheimer disease: altered expression and prospects for biomarkers [J]. PLoS One, 2015, 10(10): e0139233.
[22] Madhavan B, Yue S, Galli U, Rana S, Gross W, Müller M, Giese NA, Kalthoff H, Becker T, Büchler MW, Zöller M. Combined evaluation of a panel of protein and miRNA serum-exosome biomarkers for pancreatic cancer diagnosis increases sensitivity and specificity [J]. Int J Cancer, 2015, 136(11): 2616-2627.
[23] Sugimachi K, Matsumura T, Hirata H, Uchi R, Ueda M, Ueo H, Shinden Y, Iguchi T, Eguchi H, Shirabe K, Ochiya T, Maehara Y, Mimori K. Identification of a bona fide microRNA biomarker in serum exosomes that predicts hepatocellular carcinoma recurrence after liver transplantation [J]. Br J Cancer, 2015, 112(3): 532-538.
[24] 孙一帆,唐石伏.外泌体应用于肝细胞癌诊疗的研究进展 [J].肿瘤,2016,36(8):944-951.
[25] 杨倩,刘兰心,黄荷凤.多囊卵巢综合征患者卵泡液外泌体的提取鉴定及其miRNAs的提取和检测 [J].上海交通大学学报(医学版),2017,37(8):1085-1089.
