外科治疗食管鳞癌的长期生存结果
——上海市胸科医院单中心结果分析
2018-06-07李志刚张晓彬郭旭峰孙益峰杨煜李斌顾海勇华荣茅腾
李志刚 张晓彬 郭旭峰 孙益峰 杨煜 李斌 顾海勇 华荣 茅腾
食管癌是中国男性第5大致死性肿瘤,而中国又是世界上食管癌发病分布最为集中的地理区域,全世界有一半以上的食管癌都发生在中国,其疾病相关生存仅为20.9%[1]。
目前食管癌的多学科治疗中仍以外科为核心手段,不管是对于早期肿瘤的初始外科切除,还是对于进展期患者的术前诱导和术后辅助相结合,外科切除仍然是获得长期生存的关键技术。中国是食管癌外科治疗最为活跃的地区,但术式多样,手术入路和淋巴结清扫都不甚相同。更为重要的是中国一直缺乏统一的数据管理系统,不管从经费投入还是职位设置等方面都没有对食管癌外科治疗的结果做出完善描述。既往研究[2-5]报道,中国食管癌患者的5年生存率为36%~46%。中国近10年对于食管癌的外科治疗有了突飞猛进的发展,尤其是微创技术、多学科治疗、规范化技术推广,都堪称全世界最为活跃的区域。
为了使我们近年的技术进步有确实的数据对照,上海市胸科医院作为国内最具代表性的食管癌治疗中心,对既往2012—2014年治疗患者的长期生存及相关影响因素做了详细分析,期望可成为将来5年中国食管癌外科治疗新成果的参照依据。
资料与方法
一、 临床资料
本研究回顾了上海市胸科医院2012—2014年期间所有的食管癌外科治疗患者1 012例,剔除其中98例食管腺癌、39例其他病理类型患者,剩余食管鳞癌患者875例。再剔除其中5例内镜切除和6例经裂孔的食管切除患者,选取其中经胸手术患者864例作为本研究对象。
二、 方法
1. 观察指标:对所有患者的住院病历进行回顾后,将患者的一般情况、手术方式、围术期并发症作为研究指标进行分析。患者的生存结果通过门诊随访、电话随访获得,生存随访率100%。
2. 主要并发症指标。①肺炎:影像学证实新的肺部浸润影;临床表现包括发热、脓性痰、白细胞增多和氧分压下降等。②吻合口瘘分级。Ⅰ级:局部吻合口瘘,不需要治疗措施或进食方式的改变;Ⅱ级:局部吻合口瘘,需要干预(非手术),如介入引流、支架置入或床边切开等;Ⅲ级:局部缺陷,需要手术治疗。③声带损伤/麻痹:切除后声带功能障碍,确认和评估应通过直接检查。Ⅰ级:暂时性损伤,不需要治疗(允许改变进食方式);Ⅱ级:损伤需要选择性外科手术,如甲状软骨成形术或声带内移术;Ⅲ级:需要急性手术干预的损伤(由于误吸或呼吸问题),如甲状软骨成形术或声带内移术。
三、 统计学处理
结 果
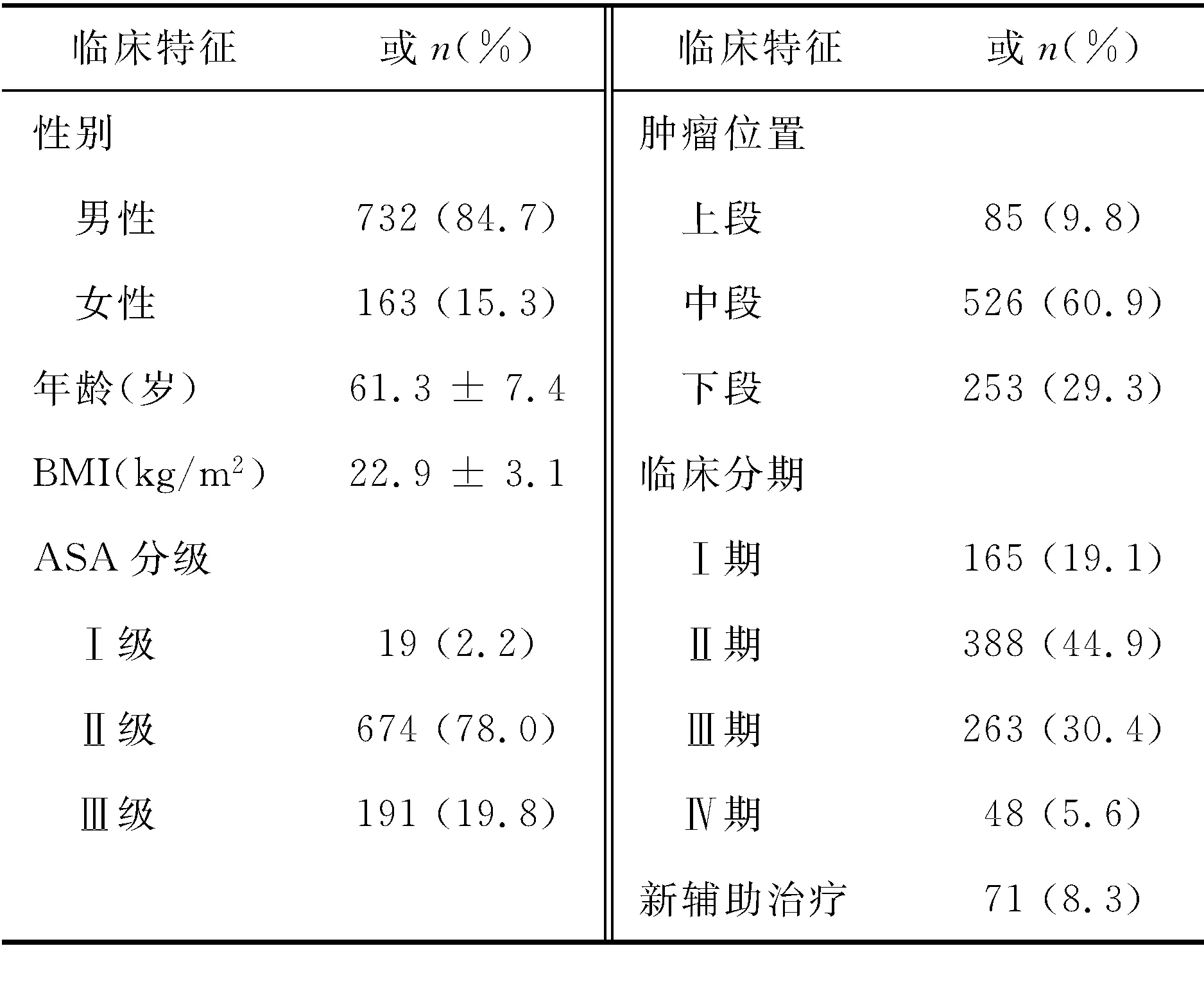
一、 食管癌患者的基线资料
864例外科治疗的食管癌患者中,男性占84.7%,平均年龄(61.3±7.4)岁,体重指数(body mass index,BMI)为(22.9±3.1)kg/m2。中段肿瘤最为常见,占78.0%;临床分期以进展期为主,Ⅰ、Ⅱ、Ⅲ、Ⅳ期分别为19.1%、44.9%%、30.4%和5.6%。新辅助治疗仅在71例患者中实施(8.3%)(表1)。
表1864例食管癌患者的基线资料[n(%)]
二、 食管癌患者术中、术后指标分析
McKeown左颈、右胸、腹三切口是最多使用的手术进路(64.2%),其次是Ivor-Lewis和左胸进路(24.5%和11.3%)。开放手术是研究期间最常用的手术方式(76.4%),但2014年微创食管癌切除术(minimally invasive esophagectomy,MIE)数量较2012年有明显增加,从14.3%增至39.8%。R0切除率为94.0%。平均手术时间(226.3±63.6)min。在手术病理分析中,淋巴结平均切取数目为11.3个,病理0(诱导治疗后完全缓解)、Ⅰ、Ⅱ、Ⅲ、Ⅳ期分别占1.3%、14.9%、43.5%、33.9%和6.4%(表2)。
三、 食管癌患者术后并发症发生情况
术后恢复期间,患者的再手术率为3.2%,再入重症监护室(intensive care unit,ICU)比例为8.4%,术后平均住院时间为14 d,ICU平均驻留时间为4 d。手术总体并发症发生率为41.8%,其中肺炎最为常见(21.5%),吻合口瘘发生率17.5%,喉返神经麻痹12.4%,呼吸功能衰竭5.3%。术后30 d手术相关病死率1.9%,90 d病死率3.1%(表2、3)。
表2864例食管癌患者术中、术后结果

注:术后住院时间和ICU入住时间以中位数表示
表3864例食管癌患者术后并发症发生情况

四、 食管癌患者术后复发情况
所有患者均完成随访,中位随访时间54.2个月。对R0切除的812例患者进行复发状况分析,发现中位复发时间12.9月,总体复发率38.1%。食管及吻合口局部、区域淋巴结、远处转移率分别为5.5%(45/812)、19.0%(154/812)和26.5%(215/812)。纵隔是区域淋巴结最常见的复发位置(62.3%,96/154),远处转移中肺转移最多(49.3%,106/215)(图1、表4)。5年无病生存率(disease free survival,DFS)为47.2%。
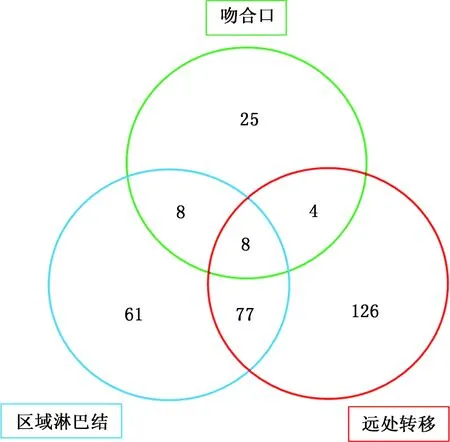
图1 复发转移模式图
表4309例食管癌患者的复发模式

五、 食管癌患者术后生存情况分析
1. 总体生存情况:所有患者1、3、5年总体生存率(overall survival,OS)分别为85.5%、61.2%和49.3%(图2)。对不同分期患者的分层生存中,0、Ⅰ、Ⅱ、Ⅲ和Ⅳ期的5年OS分别为90.9%、84.0%、58.4%、31.3%和5.5%。
2. 不同分层亚组分析:女性患者的5年OS略优于男性(61.5%vs55.5%,P=0.353),上、中、下段食管癌患者的5年OS分别为42.3%、47.9%和54.5% (P=0.296)。MIE患者的5年OS明显优于开放手术(66.5%vs44.0%,P<0.001),即便进行匹配后,仍显示明显优势(65.8%vs54.4%,P=0.020)(图3)。行左胸、Ivor-Lewis和McKeown三种术式的患者术后OS比较差异无统计学意义(P>0.05)。术后辅助治疗对远期生存有明显受益,不仅体现在淋巴结阳性(N+)患者中(OS:33.3%vs31.5%,DFS:30.2%vs24.6%),而且对淋巴结阴性(N0)患者同样有效(T3N0M0期患者的OS:66.0%vs49.5%,DFS:60.1%vs44.7%)(图4)。
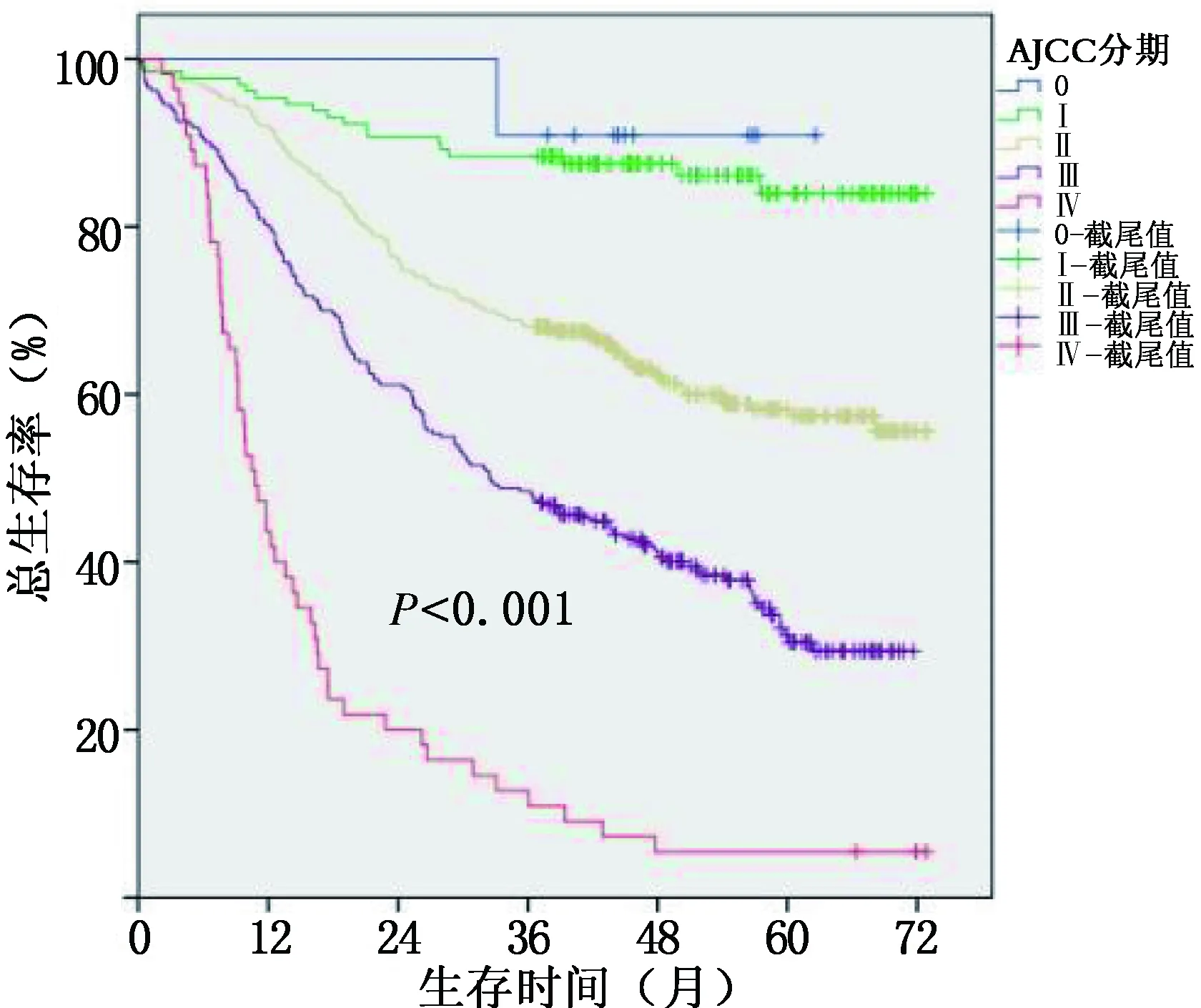
图2 864例食管癌患者术后总体生存率

图3 食管癌患者行微创和开放手术后总体生存率比较。A. 未匹配前两组比较;B. 经过倾向性评分匹配后两组比较(匹配因素包括年龄、BMI、ASA分级、肿瘤位置、手术路径、新辅助治疗和术后病理分期)
讨 论
本研究是一个入组864例食管鳞癌患者的大组回顾性报道,中位随访时间54.2个月,最终得出5年OS为49.3%、DFS为47.2%的结果。上海市胸科医院作为中国极具代表性的胸外科中心,此结果较准确地反映出我国在2010年以后食管鳞癌外科治疗的结果,与东亚同样是食管鳞癌发病大国的日本、韩国治疗结果[6-10]相似。
在这一大组的回顾性研究中,可以清晰地看出右胸进路已逐渐成为食管鳞癌的主流治疗径路,在淋巴结清扫和有效切缘控制中,相较于左胸更显优势。虽然在本研究中左胸手术的5年OS并没有相较于右胸有明显劣势,Sweet、Ivor-Lewis和McKeown的5年OS分别为50.7%、41.9%和52.3%(P=0.802),尤其是左胸手术患者多为食管下段肿瘤,相较于中上段肿瘤患者本来就更易获得肿瘤控制。同时,在本研究中,淋巴结的平均获取数目仅为11个,可见在2011—2014年间右胸进路的淋巴结清扫也未达到理想的标准,因此,这可能也是降低本研究中两组患者生存差异的重要原因。另外,左胸手术相对术式简单、手术时间短,围术期恢复上的优势也可能提高了其5年OS。在复旦大学肿瘤医院的随机对照研究[11]中,显示左胸围术期病死率亦高于右胸。这与我国既往的大组左胸报道结果不符,可能和各单位左胸手术经验不同有关[12-14]。
MIE已经逐渐成为目前食管癌治疗的主流手术方式,但既有的大组回顾性研究均没有显示出明显的生存优势[15-18]。仅有的一项随机对照研究[19]正在日本进行,还没有确定的结果。但在本组中,MIE却比传统开放手术显示出明显的生存优势(65.8%vs54.4%,P=0.020),可能原因有以下几点:首先MIE患者的淋巴结转移率为26.3%,而开放组则为43.5%,显示出MIE组在选择患者中可能肿瘤负荷更低,由此造成生存获益。虽然在匹配后,两组基线趋同,但MIE仍然显示生存优势,可能与术者手术选择有关。此研究涵盖3年内的患者,参与手术医师超过10人,而MIE集中由2位医师实施,因此可能对生存差异产生影响。因此,一项经过严格设计的随机对照研究才是证实MIE是否有生存优势的最佳手段。从既往开放手术的生存数据分析,MIE不太可能在肿瘤控制方面显示出更多的优势,但围术期并发症的降低和生活质量的改善,可能会从侧面影响其远期结果。

图4 食管癌患者术后辅助治疗对生存结果的影响。A. pN+患者总体生存率;B. pN+患者无病生存率;C. pT2N0M0患者总体生存率;D. pT2N0M0患者无病生存率;E. pT3N0M0患者总体生存率;F. pT3N0M0患者无病生存率
在本组研究中,新辅助治疗的使用率很低,仅为8.3%,而全组Ⅱ期以上患者超过80%,与NCCN指南中推荐的诱导治疗指征一致性相差甚远。本组接受诱导治疗患者多为Ⅲ期以上患者,明显晚于非诱导患者,因此OS反而较差。这与中国食管癌治疗习惯和患者接受度有关,因此在本组中术后辅助治疗是最为重要的多学科治疗模式。对于食管鳞癌的术后辅助治疗最为重要的证据就是JCOG8501试验[20],该试验显示术后辅助治疗仅对于淋巴结转移的患者有益,但本研究反而将这一生存改善扩展至淋巴结阴性的患者中,无论是T2N0M0还是T3N0M0。这一不同于以往的结果可能源于本研究的入组患者较多,而且由于淋巴结采样数较少,可能不能真正地反映淋巴结转移状况,所以假N0也是一个干扰因素。如需证实术后辅助治疗对于N0患者的生存影响,还需严格的更大样本证实。
本研究还有诸多不足,主要包括以下几个方面:①回顾性分析,资料完整性明显不足;②参与手术医师较多,在手术进路、淋巴结清扫方面都有差异;③一些复发信息源于亲属电话随访,准确度不足;④新辅助治疗比例太低。
综上所述,本研究是来自中国最具代表性的胸外科中心,涵盖3年共计864例食管鳞癌患者,结果显示5年OS达到49.3%,不劣于东亚其他主要食管癌发病国家,从侧面反映了近十年中国食管癌疗效的进步。但对于其中的影响因素尚缺乏前瞻性对照研究,如新辅助治疗和MIE,这些都需要在将来的工作中逐一解决。
参 考 文 献
1 Zeng H, Zheng R, Guo Y, et al. Cancer survival in China, 2003-2005: a population-based study [J]. Int J Cancer, 2015, 136(8):1921-1930.
2 Zhang X, Yang Y, Ye B, et al. Minimally invasive esophagectomy is a safe surgical treatment for locally advanced pathologic T3 esophageal squamous cell carcinoma [J]. J Thorac Dis, 2017,9(9):2982-2991.
3 Zeng Y, Liang W, Liu J, et al. Esophageal cancer in elderly patients: a population-based study [J]. J Thorac Dis, 2018,10(1):448-457.
4 Chen JG, Chen HZ, Zhu J, et al. Cancer survival in patients from a hospital-based cancer registry, China [J]. J Cancer, 2018,9(5):851-860.
5 Wong MCS, Hamilton W, Whiteman DC, et al. Global Incidence and mortality of oesophageal cancer and their correlation with socioeconomic indicators temporal patterns and trends in 41 countries [J]. Sci Rep, 2018,8(1):4522.
6 Tachimori Y, Ozawa S, Numasaki H, et al. Comprehensive registry of esophageal cancer in Japan, 2009 [J]. Esophagus, 2016,13:110-137.
7 Ohkura Y, Shindoh J, Ueno M, et al. Comparison of outcome of esophagectomy versus nonsurgical treatment for resectable esophageal cancer with clinical complete response to neoadjuvant therapy [J].Ann Surg Oncol. 2018. doi: 10.1245/s10434-018-6437-2. [Epub ahead of print]
8 Ichikawa H, Kosugi SI, Kanda T, et al. Surgical and long-term outcomes following oesophagectomy in oesophageal cancer patients with comorbidity [J]. Int J Surg,2016,36(PtA):212-218.
9 Koo DH, Park SI, Kim YH, et al. Phase II study of use of a single cycle of induction chemotherapy and concurrent chemoradiotherapy containing capecitabine/cisplatin followed by surgery for patients with resectable esophageal squamous cell carcinoma: long-term follow-up data [J]. Cancer Chemother Pharmacol, 2012,69(3):655-663.
10 Park S, Hwang Y, Lee HJ, et al. Comparison of robot-assisted esophagectomy and thoracoscopic esophagectomy in esophageal squamous cell carcinoma [J]. J Thorac Dis, 2016,8(10):2853-2861.
11 Li B, Xiang J, Zhang Y, et al. Comparison of Ivor-LewisvsSweet esophagectomy for esophageal squamous cell carcinoma: a randomized clinical trial [J]. JAMA Surg, 2015,150(4):292-298.
12 Wang ZQ, Wang WP, Yuan Y, et al. Left thoracotomy for middle or lower thoracic esophageal carcinoma: still Sweet enough? [J] J Thorac Dis, 2016,8(11):3187-3196.
13 Wang ZQ, Deng HY, Hu Y, et al. Prognostic value of right upper mediastinal lymphadenectomy in Sweet procedure for esophageal cancer [J]. J Thorac Dis, 2016,8(12):3625-3632.
14 Ma J, Zhan C, Wang L, et al. The sweet approach is still worthwhile in modern esophagectomy [J]. Ann Thorac Surg, 2014,97(5):1728-1733.
15 Wang H, Shen Y, Feng M, et al. Outcomes, quality of life, and survival after esophagectomy for squamous cell carcinoma: A propensity score-matched comparison of operative approaches [J]. J Thorac Cardiovasc Surg, 2015,149(4):1006-1014.
16 Nafteux P, Moons J, Coosemans W, et al. Minimally invasive oesophagectomy: a valuable alternative to open oesophagectomy for the treatment of early oesophageal and gastro-oesophageal junction carcinoma [J]. Eur J Cardiothorac Surg, 2011,40(6):1455-1463.
17 Lazzarino AI, Nagpal K, Bottle A, et al. Open versus minimally invasive esophagectomy: trends of utilization and associated outcomes in England [J]. Ann Surg, 2010,252(2):292-298.
18 Dolan JP, Kaur T, Diggs BS, et al. Impact of comorbidity on outcomes and overall survival after open and minimally invasive esophagectomy for locally advanced esophageal cancer [J]. Surg Endosc, 2013:27(11):4094-4103.
19 Kataoka K, Takeuchi H, Mizusawa J, et al. A randomized Phase Ⅲ trial of thoracoscopic versus open esophagectomy for thoracic esophageal cancer: Japan Clinical Oncology Group Study JCOG1409 [J]. Jpn J Clin Oncol, 2016:46(2):174-177.
20 Kurihara M, Izumi T, Yoshida S, et al. A cooperative randomized study on tegafur plus mitomycin C versus combined tegafur and uracil plus mitomycin C in the treatment of advanced gastric cancer[J]. Jpn J Cancer Res,1991:82(5):613-620.
