靶向HSP90抑制剂
——VER-52296在嗜铬细胞瘤细胞系PC12中的作用及其机制
2018-06-04徐飞飞林登强孟立蒋文徐云泽廉建坡汪成合何竑超祝宇
徐飞飞 林登强 孟立 蒋文 徐云泽 廉建坡 汪成合 何竑超 祝宇
嗜铬细胞瘤(pheochromocytomas,PCCs)是一种肾上腺髓质和肾上腺外交感神经系统来源的肿瘤,人群的散发病例为2~8人次/100万。肾上腺PCCs主要发生于肾上腺髓质,有10%~20%的神经瘤起源于交感神经节,故亦称为副神经节瘤[1]。PCCs中约10%为恶性PCCs,目前,临床上对于恶性PCCs的治疗手段非常有限,外科手术依然是治疗恶性PCCs的主要方法,但仍然很难达到治愈的目标[2]。分子靶向治疗是恶性PCCs治疗的发展趋势,靶向治疗是目前的研究热点。在多种肿瘤的生长过程中,热休克蛋白90(heat shock protein 90,HSP90)的抗凋亡作用对其肿瘤的形成以及转移起到了极其重要的作用,故对肿瘤的HSP90的靶点抑制可作为干扰肿瘤生长的重要方式[3-6]。
HSP90是一类广泛存在于细胞中的分子伴侣蛋白,参与多种蛋白的正确折叠,从而维持其结合的客户蛋白结构与功能的稳定[7-9]。其部分客户蛋白,如:PI3K/AKT通路的蛋白及在MEK/ERK通路中的蛋白,与肿瘤的增殖、凋亡和肿瘤的转移等肿瘤相关事件相关。动物实验和临床前实验证实,靶向抑制肿瘤细胞HSP90蛋白可以抑制甚至逆转肿瘤的发生和发展[10]。HSP90有望成为一个非常有潜力的恶性PCCs的治疗靶点。 VER-52296是第二代HSP90抑制剂,为三唑杂环酮型小分子化合物,安全性高且疗效好,对肿瘤细胞的抑制作用相较于其他HSP90抑制剂更为有效和安全。PC12细胞来自成年大鼠肾上腺髓质的PCCs细胞系,通常有未分化型和分化型两种类型,未分化型其细胞多呈圆形倾向于聚成小团簇状;分化型则细胞体积大,突触较长较多,形成网络,类似交感神经元样的分化。因分化型的PC12细胞与人PCCs细胞形态和生物学特性相似,本研究选择了分化型PC12细胞。本实验分析研究了 VER-52296对PC12细胞的细胞增殖、细胞周期、凋亡和迁移能力的影响,以及与其相关的信号通路的调节机制,从而探讨 VER-52296对治疗恶性PCCs的可能性。
材料与方法
一、材料
大鼠PCCs细胞PC12购自中科院上海细胞库;HSP90抑制剂购自美国Selleck公司;Anti-HSP70、anti-PI3K、anti-AKT、anti-MEK、anti-ERK、anti-ACTIN均购自Cell Signaling TECHNOLOGY公司;细胞周期与凋亡试剂盒购自美国BD公司;胎牛血清、马血清购自美国Gibco公司。
二、细胞培养
在5%(体积分数)CO2恒温孵育箱中进行细胞培养,培养液含10%马血清、5%胎牛血清(Fetal Bovine Serum,FBS)、1%(体积分数)双抗,每3 d换液或传代一次。其后将PC12细胞接种于96孔板(CCK8)或6 cm培养皿(流式细胞仪或蛋白质检测),细胞密度70%~80%用于实验。
三、CCK8法测定细胞存活率
实验分为空白组、对照组和实验组3组。取处于对数生长期的PC12细胞制成5×104/ml细胞悬液,以每孔100 μl接种于96孔板中,培养24 h后更换培养液,其后分别加入含不同终浓度 VER-52296的培养液(10、25、50、100、200 nmol/L)。空白组只加培养液不加细胞,对照组每孔加入100 μl细胞悬液,实验组加入不同终浓度的 VER-52296。96孔板四周加入PBS填充,每孔设5个复孔。然后分别于用药后24、48、72 h加入10% CCK8溶液10 μl/孔,继续培养4 h后弃去孔内液体,摇床上摇匀10 min后用酶标仪检测其在570 nm吸光度(A)值。实验重复3次,按以下公式计算细胞抑制率。细胞抑制率(%)=1-(实验组A-空白组A)/(阴性组A-空白组A)×100%。
四、细胞周期检测
收集实验处理过的对数生长期细胞,常规消化离心后,重悬制成单细胞悬液(每管至少2×105个细胞),1 000 rpm离心5 min,弃去上清后,用PBS溶液清洗1次,在离心管中留约0.5 ml PBS,加入70%冰乙醇5 ml混匀固定,4 ℃ 放置48 h以上。检测时,离心去乙醇,PBS清洗1次,在离心管中留1 ml PBS,打散细胞团,加入Rnase 5 μl(10 g/L),37 ℃ 放置1 h,加入PI(0.1 g/L)染液,室温避光染色30 min,计数10 000个细胞,流式细胞仪检测细胞周期时相。
五、细胞迁移实验
取对数生长期的PC12细胞,于无血清培养液中培养24 h后常规消化,用无血清DMEM制成单细胞悬液,以2×105个细胞/孔浓度加入Transwell小室,上室加入小剂量 VER-52296,作为实验组。在下室加入500 μl含有10% FBS的完全培养液。常规培养8 h后,用4%多聚甲醛固定,结晶紫染色,在显微镜下观察并计数。
六、Western blot
收集处理后的细胞,用PBS缓冲液清洗细胞2遍,加入RIPA、PMSF和Cocktail(体积比100∶1∶10),超声裂解细胞,于冰上裂解30 min。4 ℃ 12 000 r/min 离心30 min,收集上清液,定量后用4×Loading buffer稀释煮沸,-20 ℃保存。定量用BSA法测定蛋白质浓度,调整蛋白浓度,按30 μg/孔上样,取蛋白样品于10% SDS-PAGE中电泳,转膜后在3% BSA中室温下封闭l h,加一抗HSP70(1∶1 000),AKT(1∶1 000)、P-AKT(1∶1 000)、MEK和ERK (1∶1 000)、P-MEK和P-ERK(1∶1 000)。TBST洗涤3次后与3% BSA稀释的相应二抗(1∶20 000)作用1 h,使用Image Lab软件进行显影。
七、统计学方法

结 果
一、VER-52296对PC12细胞增殖的抑制作用
CCK8法检测结果表明48 h半数抑制浓度(IC50)为75 nmol/L,72 h IC50为30 nmol/L,在10~200 nmol/L浓度范围内有显著的增殖抑制作用,VER-52296在200 nmol/L浓度范围内,72 h时间范围内,呈剂量-时间依赖性抑制肿瘤细胞的增殖,结果具有统计学意义(P<0.05)(图1)。
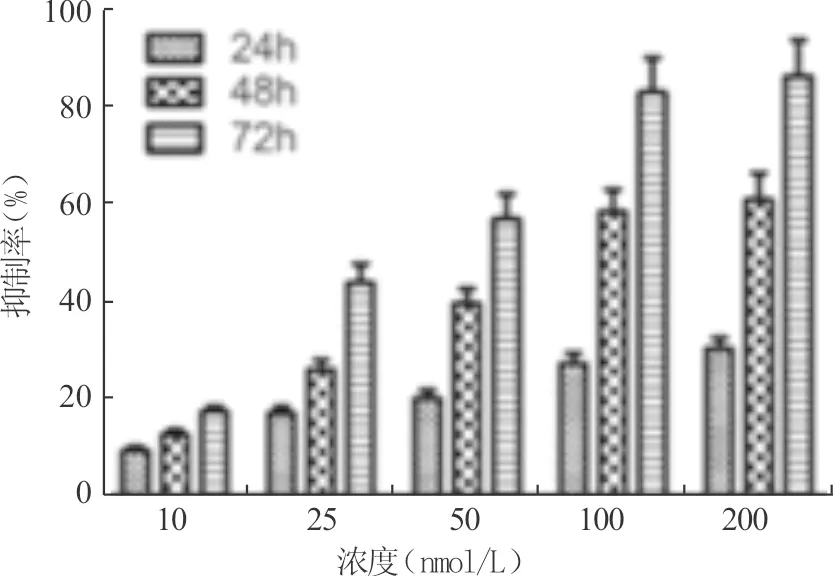
图1 VER-52296对PC12细胞增殖的抑制作用
二、VER-52296对PC12细胞迁移的影响
小剂量VER-52296(150 nmol/L)作用于PC12细胞8 h后,可明显抑制PC12细胞的迁移能力,与对照组相比,差异有统计学意义(P<0.05)(图2)。

A:实验结果统计;B:对照组;C:实验组
图2 对照组与实验组PC12细胞迁移数目比较(结晶紫染色,×200)
三、VER-52296对PC12细胞周期的影响
以不同浓度 VER-52296作用于PC12细胞,24 h 后流式细胞仪测定其细胞周期。结果显示,与对照组相比,100、200、400 nmol/L浓度组G2期细胞明显增加,G1期细胞明显减少,差异具有统计学意义(P<0.05),且在一定浓度范围内相应增加 VER-52296的剂量可使PC12细胞周期阻滞相对更加明显(图3)。

图3 细胞周期分析
四、细胞凋亡的影响
应用Annexin V-PI试剂盒检测 VER-52296对PC12细胞的凋亡诱导作用,结果显示, VER-52296处理PC12细胞48 h后,PC12细胞的早期凋亡细胞比例明显增加,且有剂量依赖性,各不同剂量组与对照组比较,差异有统计学意义(图4)。

A:实验结果统计;B:实验结果图
图4 细胞凋亡分析
五、HSP70、AKT、MEK、ERK、P-AKT、P-MEK及P-ERK蛋白水平
小剂量 VER-52296作用于细胞24 h后,可使HSP70蛋白表达明显增加,使P-AKT、P-MEK、P-ERK的表达明显降低,各组与未处理组相比均具有统计学意义(P<0.05),而对于AKT、MEK、ERK等的下调作用并不明显。HSP70水平上调,两条通路的磷酸化部分水平上调,但是总蛋白水平没有明显的变化(图5)。

图5 HSP70、PI3K-AKT和MEK/ERK信号通路蛋白水平
讨 论
目前,临床上对恶性PCCs的治疗方案非常有限,主要是由于该病的发病率低,发病机制复杂。同样不容乐观的是,很少有细胞毒性药物用于治疗恶性PCCs。细胞内信号转导通路的异常调节与多种肿瘤的发生、进展有着不可忽视的关系。多年来,人们通过对细胞信号转导通路的不断研究,发现多种信号通路转导蛋白、生长因子及其受体在恶性PCCs中过度表达,表明这些因素可能与恶性PCCs的发生、发展及预后有关。HSP90目前已被证实与多种蛋白的成熟与稳定折叠相关,而这些蛋白对于肿瘤细胞的生长与转移非常关键,因此,HSP90有可能成为对于肿瘤治疗非常有潜力的一个靶点[6,11]。格尔德霉素(17-AAG)是近些年来癌症治疗中研究最为广泛的一个HSP90抑制剂。然而,其在临床上的应用因严重的肝毒性及与细胞治疗效果抵抗等不良反应而受到限制[11-13]。基于相关研究,我们猜测, VER-52296可以作为一种对肿瘤细胞有毒性,同时又能避免17-AAG药物不良反应的一种更好的小分子抑制剂[13]。VER52296主要是通过与HSP90蛋白的N端结构域相结合而抑制HSP90蛋白的活性,促使其客户蛋白的活性下降而产生抗肿瘤的效应。本研究发现,VER-52296能有效抑制肿瘤的生长,且在体外和体内均表现出对恶性PCCs的诱导凋亡效果。因此,我们认为, VER-52296对于治疗恶性PCCs,不论是在单独用药还是与其他药物联用,都将成为一个非常合理有效的治疗选择。
然而,HSP90在进化上是一种高度保守的分子伴侣蛋白,能够调控其客户蛋白的正确折叠及保持其成熟结构稳定。已经报道的HSP90的客户蛋白种类超过200种,涵盖了多种蛋白激酶、部分类固醇激素受体等[14]。在多种肿瘤细胞中,HSP90能够调节异常折叠的癌基因相关蛋白,以维持该类蛋白的功能,从而引起肿瘤的性质发生改变。关于HSP90的客户蛋白,如AKT、PKC、PDK-1等的研究,均有提及HSP90参与了肿瘤增殖、转移等细胞行为表现过程[15-16]。
我们在前期研究中发现,HSP90在恶性PCCs组织中表达异常增高,提示HSP90通路的异常上调可能与肿瘤新生血管形成及恶性PCCs的发生、发展及远处转移机制有关。故应用特异性HSP90抑制剂,可能影响到肿瘤细胞中多个信号转导通路,从而实现对肿瘤细胞的生长周期、凋亡、迁移侵袭等方面产生抑制作用。
本研究发现, VER-52296可显著抑制PC12细胞的增殖和迁移,且有时间和剂量依赖性。同时发现暴露于 VER-52296的细胞中出现了呈剂量依赖的肿瘤细胞诱导凋亡和细胞周期阻滞。
我们推测,VER-52296可能是通过HSP90特异相关的客户蛋白的磷酸化失活从而发挥调节作用,故我们在研究中评估了PI3K/AKT信号通路和MEK/ERK信号通路,这两条通路与肾上腺PCCs的疾病进展均密切相关[17]。首先,我们评估了HSP70蛋白的表达水平,发现HSP70暴露于 VER-52296 24 h后,表现出一种与剂量依赖的表达水平上调的关系,而HSP70水平上调正是HSP90抑制有效的一个典型标志。与HSP70上调形成鲜明反差的是,暴露于 VER-52296后,磷酸化的AKT、MEK、ERK出现了明显的下调,同时,这3个信号蛋白的总蛋白的表达并未出现明显的改变。相关研究表明,PI3K/AKT和MEK/ERK这两条信号通路在促进肿瘤形成的信号中,表现出各自功能的同时也产生了信号通路之间的蛋白相互作用[17-18]。本研究中,由 VER-52296所产生的对PI3K/AKT和MEK/ERK信号通路的抑制,可以对其在细胞凋亡中产生明显的促进作用以及显著促使细胞周期静止等作用做出较为合理的解释。同时,对这几条肿瘤形成通路的抑制作用也被认为与克服肿瘤的抗药性、对治疗疾病有益相关。
综上,VER-52296显著抑制恶性PCCs细胞的增殖,这种效果可能是由于使与肿瘤存活和肿瘤形成相关蛋白下调或失活所致。 VER-52296是一个非常有潜力的治疗恶性PCCs的新型小分子抑制剂。
[1] Klingle HC, Klingler PJ, Martin JK Jr, et al. Pheochromocytoma[J]. Urology,2001,57(6):1025-1032.
[2] Zarnegar R, Kebebew E, Duh QY, et al. Malignant Pheochromocytoma[J]. Surg Oncol Clin N Am,2006,15(3):555-571.
[3] Fishbein L. Pheochromocytoma and Paraganglioma Genetics, Diagnosis, and Treatment[J]. Hematol Oncol Clin North Am,2016,30(1):135-150.
[4] Lowery AJ, Walsh S, Mcdermott EW, et al. Molecular And Therapeutic Advances In The Diagnosis And Management Of Malignant Pheochromocytomas And Paragangliomas[J]. Oncologist,2013,18(4):391-407.
[5] Bauer S, Yu LK, Demetri GD, et al. Heat Shock Protein 90 Inhibition In Imatinib-Resistant Gastrointestinal Stromal Tumor[J]. Cancer Res,2006,66(18):9153-9161.
[6] Banerji U. Heat shock protein 90 as a drug target: Some like it hot[J]. Clin Cancer Res,2009,15(1):9-14.
[7] Montemurro M, Bauer S. Treatment Of Gastrointestinal Stromal Tumor After Imatinib And Sunitinib[J]. Curr Opin Oncol,2011,23(4):367-372.
[8] Xu Y, Qi Y, Rui W, et al. Expression And Diagnostic Relevance Of Heat Shock Protein 90 And Signal Transducer And Activator Of Transcription 3 In Malignant Pheochromocytoma[J]. J Clin Pathol,2013,66(4):286-290.
[9] Boltze C, Mundschenk J, Unger N, et al. Expression Profile Of The Telomeric Complex Discriminates Between Benign And Malignant Pheochromocytoma[J]. J Clin Endocrinol Metab,2003,88(9):4280-4286.
[10] Lee KH, Lee JH, Han SW, et al. Antitumor activity of NVP-AUY922, a novel heat shock protein 90 inhibitor, in human gastric cancer cells is mediated through proteasomal degradation of client proteins[J]. Cancer Sci,2011,102(7):1388-1395.
[11] Jarosz D, HSP90: A Global Regulator Of The Genotype-To-Phenotype Map In Cancers, In HSP90 In Cancer: Beyond The Usual Suspects[J] Cancer Res,2016,129:225-247.
[12] Piper PW, Millson SH. Mechanisms Of Resistance To Hsp90 Inhibitor Drugs: A Complex Mosaic Emerges[J]. Pharmaceuticals (Basel, Switzerland),2011,4(11):1400-1422.
[13] Gaspar N, Sharp SY, Pacey S, et al. Acquired Resistance To 17-Allylamino-17-Demethoxygeldanamycin (17-Aag, Tanespimycin) In Glioblastoma Cells[J]. Cancer Res,2009,69(5):1966-1975.
[14] Zhao R, Houry WA. HSP90: A Chaperone For Protein Folding And Gene Regulation[J]. Biochem Cell Biol,2005,83(6):703-710.
[15] Goetz MP, Toft DO, Ames MM, et al. The HSP90 Chaperone—Complex As A Novel Target For Cancer Therapy[J]. Ann Oncol,2003,14(8):1169-1176.
[16] Whitesell L, Lindquist SL. HSP90 and the chaperoning of cancer[J]. Nat Rev Cancer,2005,5(10):761-772.
[17] Noelting S, Garcia E, Alusi G, et al. Combined Blockade Of Signalling Pathways Shows Marked Anti-Tumour Potential In Phaeochromocytoma Cell Lines[J]. J Mol Endocrinol,2012,49(2):79-96.
[18] Carracedo A, Ma L, Teruya-Feldstein J, et al. Inhibition of mtorc1 leads to Mapk pathway activation through a Pi3k-dependent feedback loop in human cancer[J]. J Clin Invest,2008,118(9):3065-3074.
