刺五加发酵茶工艺优化及其抗氧化活性
2018-05-31化洪苓尹文哲武天琦
化洪苓, 尹文哲, 张 智,*, 李 晴, 武天琦, 刘 洋, 吕 歌
(1.东北林业大学 林学院, 黑龙江 哈尔滨 150040;2.哈尔滨医科大学附属第二医院, 黑龙江 哈尔滨 150086)
刺五加属五加科植物,别名五加参(Acanthopanaxsentieosus),是我国北方地区特产常用药材之一。刺五加的主要成分为皂苷类,其中包括有紫丁香苷、金丝桃苷和齐墩果酸等;此外刺五加叶含有丰富的黄酮类活性物质[1]。刺五加不仅具有药用食用作用,还有较强的固土抗蚀能力,有很重要的生态作用[2]。关于刺五加在抗肿瘤、抗炎、增强免疫功能、抗衰老[3]等方面的效用功能已有大量研究报道。汪琢等[4]研究了刺五加异嗪皮啶对体外培养的3种肿瘤细胞有抑制作用。Saito等[5]研究了刺五加果实对高脂小鼠通过降低胰岛素抵抗来调节肥胖的问题。刺五加亦能益智安神、补肾健脾,治疗腰膝酸软、失眠多梦等病症[6-9]。刺五加的有益之处如此众多,而目前刺五加的主要产品仅集中于药片、口服液等药品类以及少量果糕和饮品等食品类,其尚未被综合和广泛的利用起来。
本实验利用微生物菌种对刺五加鲜叶进行固态发酵,通过单因素和响应面试验优化发酵工艺制得口感浑厚,有效成分高的刺五加发酵茶饮品,更有利于刺五加资源的利用与开发。通过比较发酵前后DPPH自由基清除能力、ABTS自由基清除能力、羟自由基清除能力、超氧阴离子自由基清除能力和总还原力的不同,进一步研究固态发酵对刺五加的有益改变。
1 材料与方法
1.1 材料与试剂
菌种:米曲霉、红曲霉和产朊假丝酵母,由东北林业大学食品微生物实验室提供;刺五加鲜叶产自于黑龙江省小兴安岭地区。
无水乙醇、亚硝酸钠、硝酸铝、氢氧化钠、石油醚、硫酸亚铁、水杨酸、铁氰化钾、三氯醋酸、氯化铁、过硫酸钾、抗坏血酸,分析纯,天津天力化学试剂有限公司;AB-8型大孔吸附树脂,天津市汇达化工有限公司;芦丁标准品试剂(纯度大于98%),上海源叶生物科技有限公司;DPPH,ABTS标准品(纯度大于98%),美国Sigma公司;抗超氧阴离子试剂盒,南京建成生物工程研究有限公司。
1.2 仪器与设备
722s型可见分光光度计,中国上海精密科学仪器有限公司;YXQ-LS-18S型手提式压力蒸汽灭菌器,上海博迅实业有限公司医疗设备厂;SW-CJ-1G型超净工作台,江苏净通净化设备有限公司;DL-6M型立式离心机,湖南星科科学仪器有限公司;电子恒温不锈钢水浴锅,上海宜昌仪器纱筛厂;电热鼓风干燥箱,上海一恒科技有限公司;KQ-300DE型数控超声波清洗器,昆山市超声仪器有限公司;IS-RSD3型台式恒温振荡器,上海智城分析仪器制造有限公司。
1.3 实验方法
1.3.1芦丁标准曲线的绘制
芦丁标准曲线的绘制参考文献[10]。取芦丁标准品分别制得质量浓度为0.2、0.4、0.6、0.8和1.0 mg/mL的芦丁标准品液。取5个不同质量浓度的芦丁标准品液1 mL于10 mL容量瓶中,加入体积分数为50%的乙醇4 mL,质量分数为5%的亚硝酸钠0.4 mL反应6 min,质量分数为10%的硝酸铝0.4 mL反应6 min,最后加入质量分数为4%的氢氧化钠4 mL,并用体积分数为50%的乙醇溶液定容,室温反应15 min后于510 nm处测定吸光度。以吸光度为横坐标,标准液浓度为纵坐标绘制芦丁标准曲线并得到回归方程y=1.132 7x+0.005 4,相关系数R2=0.999 6。
1.3.2刺五加黄酮含量的测定
取经石油醚处理后的刺五加研磨过60目筛,质量浓度0.05 g/mL、50%乙醇溶液75 ℃超声1 h,离心取上清液于100 mL容量瓶中,得到的滤渣重复上一步超声过程,2次超声提取液用50%乙醇定容,参照1.3.1测定510 nm处吸光度,根据回归方程计算黄酮含量[11]。黄酮得率如式(1):

(1)
式(1)中,w(黄酮),mg/g;ρ为提取液样品中的黄酮质量浓度,mg/mL;V1为稀释体积,mL;V2为测定定容体积,mL;m为刺五加叶质量,g。
1.3.3感官评价指标
参照GB/T 21733—2008《茶饮料》标准,由10位同学从产品的色泽、气味、滋味和组织状态进行鉴定,总分数由20%色泽+20%气味+30%滋味+30%澄清度权重分数算出,见表1。

表1 感官评价标准Tab.1 Sensory evaluation criteria
1.3.4菌种生长曲线的测定
对米曲霉、红曲霉和产朊假丝酵母分别进行生长曲线的测定,以确定较佳的添加时间。米曲霉和红曲霉采用测菌丝体干重法。红曲霉在每天同一时间离心去上清液,烘干后测量其干重,共测量5 d;米曲霉从培养起每2 h离心去上清液测干重,共测量30 h。产朊假丝酵母采用OD值法测定,利用分光光度计每2 h测定培养液的吸光值,共测量44 h,每组进行3次重复性实验,根据测定数据绘制生长曲线。根据结果判断菌种进入对数生长期时,为较佳添加时间。
1.3.5发酵菌种的筛选
选用米曲霉,红曲霉和产朊假丝酵母分别对刺五加鲜叶进行固态发酵,通过测定黄酮含量和感官分数确定菌种。取7.5 g刺五加鲜叶(叶中干物质的质量分数为40%)为发酵底物,将每一单独菌种以总质量的15%接种于发酵体系中,放置在35 ℃的环境中进行固态发酵。确定好的单菌种进行发酵比例添加实验,添加比例分别为:比例1为米曲霉∶红曲霉=1∶1;比例2为米曲霉∶红曲霉∶产朊假丝酵母=1∶1∶1;比例3为米曲霉∶红曲霉∶产朊假丝酵母=1∶2∶1;比例4为米曲霉∶红曲霉∶产朊假丝酵母=2∶2∶1;比例5为米曲霉∶红曲霉∶产朊假丝酵母=2∶3∶1,每组实验进行3次重复性实验,最终选定发酵菌种及其添加比例。
1.3.6刺五加发酵茶工艺的单因素实验
1.3.6.1 水分单因素实验
取7.5 g刺五加鲜叶为发酵底物,固定发酵温度,发酵时间和接种量,考察在固态发酵体系中40%,45%,50%,55%和60%水分下对刺五加发酵的影响,每组设3次重复实验,综合单因素结果和发酵后刺五加实际情况,选出较佳水分含量条件。
1.3.6.2 接种量单因素实验
考察在固态发酵体系总含水量的10%,12%,15%,18%和20%接种量下对刺五加固态发酵的影响,每组设3次重复实验,综合单因素结果和发酵后刺五加实际情况,选出较佳接种量。
1.3.6.3 发酵温度单因素实验
考察在25,30,35,40和45 ℃温度下对刺五加固态发酵的影响,每组设3次重复实验,综合单因素实验结果和发酵后刺五加实际情况,选出较佳发酵温度。
1.3.6.4 发酵时间单因素实验
考察在3,4,5,6和7 d下对刺五加固态发酵的影响,每组设3次重复实验,综合单因素结果和发酵后刺五加实际情况,选出较佳发酵时间。
1.3.7响应面优化试验
根据单因素实验的结果,以固态发酵过程中的水分含量,接种量,发酵温度和发酵时间为关键工艺参数设计4因素3水平响应面优化试验,以黄酮含量和茶叶感官得分为双指标共设计29组实验优化发酵工艺。
1.3.8刺五加黄酮抗氧化活性实验
根据1.3.7节确定的最优发酵工艺后进行刺五加黄酮提取,提取液经AB-8大孔树脂[12]吸附纯化,并通过体积分数为60%的乙醇溶液洗脱,将乙醇溶剂回收后并干燥,得到刺五加黄酮干粉。将该样品配制不同浓度对其进行DPPH自由基清除率[13-14],羟自由基清除率[15-17],ABTS自由基清除率[18],总还原能力[19-20]的测定和超氧阴离子自由基试剂盒的测定。
1.4 数据处理
数据通过软件SPSS 22.0和Statistix 8.1进行相关计算处理,作图利用OriginPro 8.6与Excel 2010进行处理。
2 结果与分析
2.1 3种不同菌种生长曲线的分析
产朊假丝酵母,米曲霉和红曲霉的菌种生长曲线结果见图1。根据OD值法得到图1a,菌丝体干重法得到图1b和图1c。

图1 3种菌种的生长曲线Fig.1 Growth curves of three strains
由图1可知产朊假丝酵母和米曲霉均在第18小时进入对数生长期;而红曲霉在第3天进入对数生长期。根据菌种生长曲线的结果,选取在对数生长期的菌种进行固态发酵有益于发酵的顺利进行。
2.2 单菌发酵筛选对实验结果的分析
菌种单独固态发酵刺五加鲜叶得到的黄酮含量和感官得分实验结果见图2。
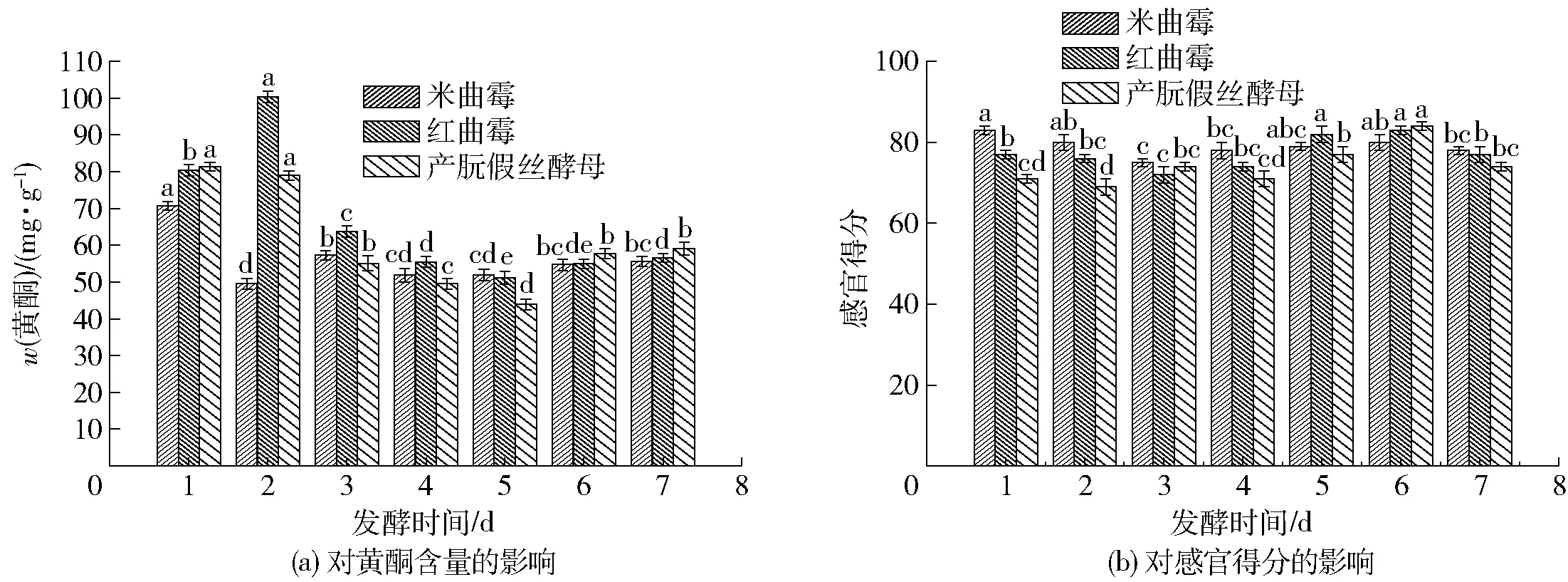
图2 单菌发酵筛选对实验结果的影响Fig.2 Effect of single bacteria fermentation on experimental results
从图2可知,3种微生物单独发酵,大致的走向是发酵前期黄酮含量减少,后期再逐渐恢复,第6天与第7天黄酮含量差距不大,而感官得分在发酵第6天均比第7天要好,所以发酵大致选在6 d完成。第2天黄酮含量高可能是红曲霉在第1天适应新的发酵底物和环境,第2天由于发酵代谢使黄酮类物质大幅提高,随着发酵时间的推进,又有新的菌种出现,虽是单菌发酵但后期也归于多种菌的共同作用,只是单独添加的菌种更有优势,成为优势菌种。共同作用也解释了虽然添加的单个微生物菌种不同,但后期发酵后得到的黄酮含量和感官得分都是相差不显著的。
2.3 不同添加比例混菌发酵对发酵的分析
产朊假丝酵母,米曲霉和红曲霉以5种不同添加比例混合进行固态发酵刺五加鲜叶得到的黄酮含量和感官得分实验结果分别见表2和表3。
比例1为米曲霉∶红曲霉=1∶1;比例2为米曲霉∶红曲霉∶产朊假丝酵母=1∶1∶1;比例3为米曲霉∶红曲霉∶产朊假丝酵母=1∶2∶1;比例4为米曲霉∶红曲霉∶产朊假丝酵母=2∶2∶1;比例5为米曲霉∶红曲霉∶产朊假丝酵母=2∶3∶1。
表2和表3根据单菌发酵结果采用不同添加比例混合菌发酵后黄酮含量和对应的感官得分。表3明显比图2a的黄酮含量增加,不同添加比例菌种作用的发酵趋势和单菌种的发酵趋势一致,也进一步证实了2.2节中在固态发酵体系内菌种最终会达成共同作用的结论,多种微生物的加入相当于起到促进和增强的效果,因此在发酵时间上也由6 d缩短到了4 d或5 d。结合表2和表3结果,综合黄酮含量和感官得分的结果,选取比例3进行进一步的研究。
2.4 单因素实验对发酵结果的分析
分别对发酵底物水分含量、发酵菌种接种量、发酵温度和发酵时间进行研究,单因素结果见图3。
由图3a可知,黄酮含量在40%~50%水分含量中迅速增加,在50%~60%的水分含量中缓慢减少,而当水分含量超过60%,不仅黄酮含量大幅度减少,发酵后的感官得分也迅速降低并伴有杂菌生长。原因可能是固态发酵中的水分不宜过多,过多的水分容易造成染菌和霉变的风险。感官得分和黄酮含量均在水分含量为50%的时候达到最大。
由图3b可知,接种量在10%~15%时,黄酮含量显著上升;在接种量大于15%后,缓慢降低。由于发酵最终都将进入共同作用的结论,当菌种总数达到一定时,即启动共同作用的时刻,因此也不需要过量的添加。在接种量15%时,双指标值最高。
由图3c可知,35 ℃时,黄酮含量和感官得分达到最大。温度过高或过低都不利于微生物的繁殖生长,选取适宜的温度对固态发酵尤为重要。
由图3d可知,茶叶感官得分随着发酵天数的增加快速提高,第4天达到最高,继续发酵得分缓慢降低。而黄酮含量在第4天达到最高后,第5天便显著减少,综合两项指标选取发酵时间为4 d。

图3 单因素实验对发酵结果的影响Fig.3 Effects of single factor experiments on fermentation results
2.5 Box-Behnken试验设计及结果
根据单因素实验结果,通过响应面法对水分含量、接种量、发酵温度和发酵时间4个单因素进行分析,结果见表4。



表4 Box-Behnken试验设计及其响应值Tab.4 Box-Behnken design matrix and response values
响应面相互作用如图4,根据模型最优的发酵工艺条件为水分含量51%,接种量15%,36 ℃,发酵4.5 d预测得到的刺五加发酵茶黄酮含量为105.97 mg/g,茶叶感官得分92分。参照最优工艺条件进行实际固态发酵,3次平行实验得到刺五加发酵茶黄酮含量(105.37±1.58)mg/g,感官得分(92±1)分,与预测值接近。
2.6 刺五加发酵前后抗氧化活性的比较
根据最优工艺发酵后得到的刺五加参照1.3.2节制得干粉,对比相同质量浓度下发酵前后的刺五加黄酮提取物抗氧化活性,维生素C作对照。由结果可知,发酵后刺五加的抗氧化活性均高于未发酵刺五加。下图中小写字母代表差异显著,p<0.05。其中第一个或前两个字母表示固定浓度3种物质的差异性;最后一个字母表示同种物质,质量浓度上的差异性。发酵前后刺五加抗氧化实验结果如图5。

表5 黄酮为响应值的试验结果方差分析Tab.5 Analysis of variance of regression model equation
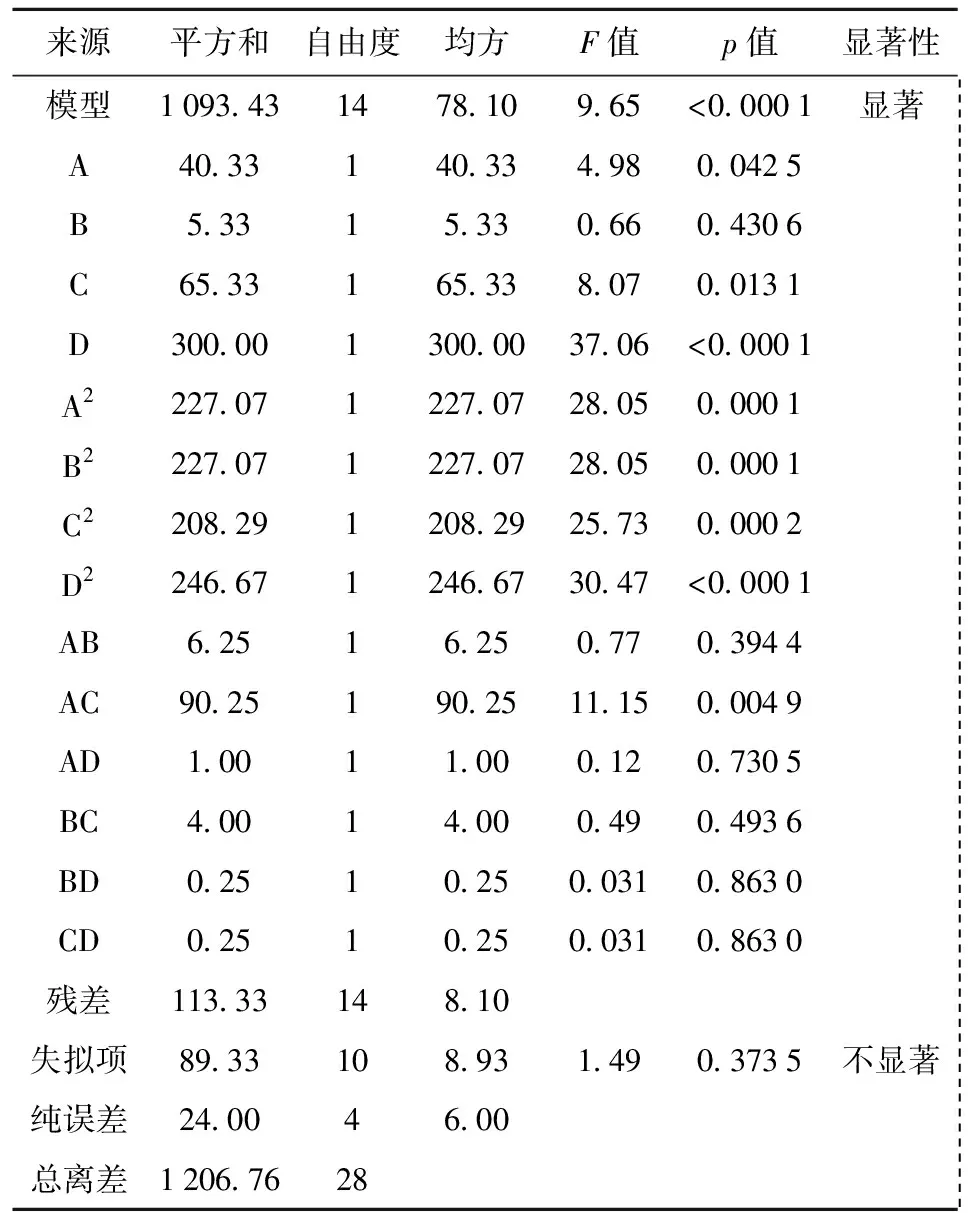
表6 感官得分为响应值的试验结果方差分析Tab.6 Analysis of variance of regression model equation

图4 各因素交互作用对黄酮含量和感官得分的影响Fig.4 Effect of each factor to flavonoids contents and sensory score

图5 刺五加抗氧化作用的研究Fig.5 Study on antioxidant effects of Acanthopanax senticosus
由图5可知,在质量浓度小于0.4 mg/mL时,发酵前刺五加和发酵后刺五加均随着浓度的增加,清除率也显著增加;质量浓度大于0.4 mg/mL后,随着质量浓度的增加,清除率增加缓慢。当质量浓度达到0.8 mg/mL时,发酵后刺五加对DPPH自由基的清除率为(94.34±1.67)%,达到相同质量浓度的维生素C对DPPH自由基的清除率的94.55%。未发酵刺五加的IC50为93.06 μg/mL;发酵后刺五加的IC50为63.24 μg/mL。
随着质量浓度的增加,对羟自由基的清除能力迅速增强,当质量浓度达到0.4 mg/mL后,清除能力缓慢增加。刺五加黄酮提取物对羟自由基的清除能力比相同质量浓度的维生素C对照品对羟自由基清除能力强。在质量浓度0.8 mg/mL时,发酵前刺五加提取物对羟自由基的清除能力是维生素C对照品的2倍,发酵后刺五提取物加则是维生素C对照品的2.7倍。因此刺五加黄酮提取物具有较强的羟自由基的清除能力。未发酵刺五加的IC50为0.59 mg/mL;发酵后刺五加的IC50为0.22 mg/mL。
在质量浓度小于0.1 mg/mL时,3种物质均随着质量浓度的增加,清除率迅速提高;质量浓度大于0.1 mg/mL后,随着质量浓度的增加,未发酵刺五加和维生素C清除率缓慢增加;而发酵后刺五加继续快速增加,且在质量浓度达到0.2 mg/mL时,发酵后刺五加对ABTS自由基的清除率超过了相同质量浓度的维生素C。未发酵刺五加的IC50为72.80 μg/mL,发酵后刺五加的IC50为21.75 μg/mL,与未发酵刺五加相比有大幅提升。
在质量浓度小于0.4 mg/mL时,3种物质均随着质量浓度的增加,清除率也显著增加;质量浓度大于0.4 mg/mL后,随着质量浓度的增加,清除率趋于平缓。当质量浓度达到0.8 mg/mL时,发酵后刺五加抗超氧阴离子活力为(212.05±5.07)U/L,达到相同质量浓度的维生素C抗超氧阴离子活力(228.34±15.46)U/L的92.87%。
吸光值越高,总还原力越强。在质量浓度小于0.4 mg/mL时,三种物质均随着质量浓度的增加,清除率也显著增加;质量浓度大于0.4 mg/mL后,随着浓度的增加,清除率趋于平缓。未发酵刺五加与发酵后刺五加的增长趋势基本相同。
3 结 论
通过单因素和响应面试验优化刺五加发酵茶工艺,得到的较佳参数为51%的水分含量,15%的接种量在36 ℃下发酵4.5 d。发酵后得到刺五加黄酮含量为(105.37±1.58)mg/g,感官得分(92±1)分,较之未发酵刺五加的黄酮含量提高32.37%。在混合菌参与的固态发酵体系中,微生物承担了重要的使命和角色。通过3株菌种以不同添加比例进行固态发酵,利用微生物互生,共生的特点产生的次级代谢物可以有效地提高刺五加的风味和口感并大大减少发酵时间提高产量。米曲霉主要分泌物质将大分子水不溶性物质分解成胞内酶和胞外酶,使大部分直链淀粉转化为糖以改善原刺五加发涩味的口感[21];酵母菌代谢的酸和酯类可以使茶叶更柔和醇厚;红曲霉产生的红色素调节刺五加茶叶的色泽。不仅限于3种菌的混合,在真正的体系中共生出大量的其他菌种来一同协调整体发酵。通过色香味的综合改良达到刺五加发酵茶的浓,陈的感觉。比较发酵前后的抗氧化活性,得出发酵后刺五加在对DPPH自由基、羟自由基、ABTS自由基、超氧阴离子自由基和总还原力的作用上均比未发酵刺五加的效果好且均体现质量浓度依赖性和时间依赖性,实验结果与张英华等[14]研究结果趋势相同。可见刺五加发酵茶不仅改善了风味,更提高了活性成分黄酮的含量,一举两得。
本实验为创新刺五加资源的开发和利用及今后工业化的发展提供一定的理论依据,但还需对发酵过程中菌种对刺五加的作用进行进一步的追踪分析,并对发酵后刺五加其他活性成分的变化及影响因素进行深层的探究。
参考文献:
[1] HUANG L, ZHAO H, HUANG B, et al.Acanthopanaxsenticosus: review of botany, chemistry and pharmacology[J]. Die Pharmazie, 2011, 66(2): 83-97.
[2] 黄丽, 陈武荣, 林丽, 等. 濒危植物刺五加开发利用若干问题的探讨[J]. 南方园艺, 2012, 23(2): 41-43.
HUANG L,CHEN W R, LIN L, et al. Discussion on development of endangeredEleutherococcussenticosus[J]. Southern Horticulture, 2012, 23(2): 41-43.
[3] PARK M. FermentedAcanthopanaxkoreanumroot extract reduces UVB-and H2O2-induced senescence in human skin fibroblast cells[J]. Journal of Microbiology and Biotechnology, 2016, 26(7): 1224-1233.
[4] 汪琢, 姜守刚, 郭晓帆, 等. 刺五加中异嗪皮啶提取工艺优化及其抗肿瘤、抗氧化活性研究[J]. 天然产物研究与开发, 2015, 27(6): 1092-1098.
WANG Z, JIANG S G, GUO X F, et al. Optimization of extraction conditions for iofaxidin fromEleutherococcussenticosusand its antioxidant, ntitumor activities[J]. Nature Production Research Development, 2015, 27(6): 1092-1098.
[5] SAITO T, NISHIDA M, SAITO M, et al. The fruit ofAcanthopanaxsenticosus(Rupr. et Maxim.) harms improves insulin resistance and hepatic lipid accumulation by modulation of liver adenosine monophosphate-activated protein kinase activity and lipogenic gene expression in high-fat diet-fed obese mice[J]. Nutrition Research, 2016, 36(10): 1090-1097.
[6] 潘菊华, 李多娇, 王彦云. 刺五加抗抑郁作用探析[J]. 中医学报, 2016, 31(1): 83-86.
PAN J H, LI D J, WANG Y Y. Mechanism analysis of the anti-depression effect ofAcanthopanax[J]. China Journal Of Chinese Medicine, 2016, 31(1): 83-86.
[7] 田松阳,于成龙,徐微,等. 刺五加水提取物的抗氧化活性研究[J]. 食品工业科技,2016 (21):110-113,194.
TIAN S Y, YU C L, XU W, et al. Antioxidant activity of water extraction fromAcanthopanaxsenticosus[J]. Science and Technology of Food Industry, 2016,(21):110-113,194.
[8] LI X, ZHANG S, WANG K, et al. Neuroprotective effects of extract ofAcanthopanaxsenticosusharms on SH-SY5Y cells overexpressing wild-type or A53T mutant synuclein[J]. Phytomedicine, 2014, 21(5): 704-711.
[9] HUANG L, HUANG B, YE Q, et al. Bioactivity-guided fractionation for anti-fatigue property ofAcanthopanaxsenticosus[J]. Journal of Ethnopharmacology, 2011, 133(1): 213-219.
[10] 白生文, 汤超, 田京, 等. 沙棘果渣总黄酮提取工艺及抗氧化活性分析[J]. 食品科学, 2015(10): 59-64.
BAI S W,TANG C,TIAN J,et al. Extraction and anti-oxidant activity of total flavonoids from sea buckthorn pomace[J]. Food Science, 2015(10): 59-64.
[11] 刘文闯, 刘春明, 陆娟, 等. 刺五加叶中总黄酮的分离提取及抗氧化活性研究[J]. 辽宁中医杂志, 2011, 38(8): 1622-1625.
LIU W C, LIU C M, LU J, et al. Studies on the extraction and antioxidant activity evaluation of the flavoniods from the leaves ofAcanthopanaxsenticosus[J]. Liaoning Journal of Traditional Chinese Medicine, 2011, 38(8): 1622-1625.
[12] 赵丽萍, 江岩. AB-8, NKA 两种大孔树脂对药桑椹花青素分离纯化的比较[J]. 食品科技, 2013 (4): 219-223.
ZHAO L P, JIANG Y. Comparison on puriflcation of anthocyanins from black mulberry by AB-8 and NKA macroporous resins[J]. Food Science And Technology, 2013 (4): 219-223.
[13] OLIVEIRA G, TRMIN T, SOUSA R, et al. Batch-injection analysis with amperometric detection of the DPPH radical for evaluation of antioxidant capacity[J]. Food Chemistry, 2016, 192: 691-697.
[14] 张英华, 关雪. 刺五加叶中黄酮类提取物的抗氧化性及抑菌作用研究[J]. 东北农业大学学报, 2012, 43(3): 85-90.
ZHANG Y H, GUAN X. Antioxidation and antibacterial property of flavonoids compounds extracted fromAcanthopanaxleaves[J]. Journal of Northeast Agricultural University, 2012, 43(3): 85-90.
[15] 侯学敏, 李林霞, 张直峰, 等. 响应面法优化薄荷叶总黄酮提取工艺及抗氧化活性[J]. 食品科学, 2013, 34(6): 124-128.
HOU X M, LI L X, ZHANG Z F, et al. Total flavonoids fromMenthahaplocalyxBriq. leaves: optimization of extraction process by response surface methodo-logy and antioxidant activity[J]. Food Science, 2013, 34(6): 124-128.
[16] ZHANG X, LIU X, KIM Y, et al. Chemical consti-tuents and their acetyl cholinesterase inhibitory and antioxidant activities from leaves ofAcanthopanaxhenryi: potential complementary source against Alzheimer’s disease[J]. Archives of Pharmacal Research, 2014, 37(5): 606-616.
[17] LI X. Solvent effects and improvements in the deoxyribose degradation assay for hydroxyl radical-scavenging[J]. Food Chemistry, 2013, 141(3): 2083-2088.
[18] 宋思圆, 苏平, 王丽娟, 等. 响应面试验优化超声提取黄秋葵花果胶多糖工艺及其体外抗氧化活性[J]. 食品科学, 2017, 38(2): 283-289.
SONG S Y, SU P, WANG L J, et al. Optimization of ultrasonic-assisted extraction by response surface methodology and antioxidant activities of pectic polysaccharide from okra flowers[J]. Food Science, 2017, 38(2): 283-289.
[19] 刘松, 董晓芳, 佟建明. 多糖提取和抗氧化活性评价方法的研究现状和进展[J]. 动物营养学报, 2016, 28(11): 3391-3399.
LIU S, DONG X F, TONG J M. research status and progress of extraction and antioxidant activity evaluation methods of polysaccharides[J]. Chinese Journal of Anilma Nutrition, 2016, 28(11): 3391-3399.
[20] 喻艳, 逯海朋, 贾亚楠, 等. 桑椹中酚类物质极性分布及抗氧化活性评价[J]. 食品与发酵工业, 2017, 43(1): 73-79.
YU Y, LU H P, JIA Y N, et al. Determination of mulberry total phenolic content and its antioxidant activity[J]. Food and Fermentation Industries, 2017, 43(1): 73-79.
[21] 周春红,黄振兴,阮文权,等. 微生物对普洱茶渥堆过程中特定风味成分变化的影响[J]. 食品与发酵工业, 2009(7):36-39.
ZHOU C H,HUANG Z X,RUAN W Q, et al. Influence of microorganisms on certain flavor chemicals of puer tea during its piling[J]. Food and Fermentation Industries, 2009(7):36-39.
