鲜猪肉中沙门氏菌生长动力模型的建立与验证
2018-05-31殷玉洁倪培恩刘丹蕾张菊梅吴清平王大鹏
殷玉洁, 倪培恩, 刘丹蕾, 张菊梅, 吴清平, 王大鹏,*
(1.上海交通大学 农业与生物学院 食品科学与工程系, 上海 200240;2.广东省微生物研究所/省部共建华南应用微生物国家重点实验室/广东省菌种保藏与应用重点实验室/广东省微生物应用新技术公共实验室, 广东 广州 510070)
沙门氏菌(Salmonella)是主要的食源性致病菌之一。据报道,全球每年因该菌感染导致约9.38亿例腹泻病例,约有15万人死于由非伤寒沙门氏菌引起的疾病[1]。在我国,70%~80%的细菌性食物中毒事件是由沙门氏菌感染引发的[2]。猪肉是中国人餐桌上常见食材,也是食源性致病细菌生长的温床,市售新鲜猪肉的沙门氏菌检出率高达38.0%以上[3-5]。市售新鲜猪肉中所污染沙门氏菌的生长繁殖规律尚不清楚,政府管理部门很难对其进行有效防控。
食品中沙门氏菌的种类和丰度对该菌的消长有影响[6]。目前,关于沙门氏菌生长模型的研究主要采用单一菌种进行人工污染,故难以准确反映出猪肉中细菌的实际生长状况[7-8]。环境因素是影响猪肉中沙门氏菌等致病细菌消长的重要影响因子之一,其中,温度变化是影响沙门氏菌生长的主要因素[9]。此外,沙门氏菌为适应温度的变化往往会表现出一系列反应[6,9]。本团队对上海市市售农产品中沙门氏菌污染情况的调查结果显示,猪肉中以肠炎沙门氏菌 (SalmonellaEnteritidis)、鼠伤寒沙门氏菌 (SalmonellaTyphimurium)和德尔卑沙门氏菌(SalmonellaDerby)3种血清型为主[10];因此,本研究拟以这3种血清型沙门氏菌作为研究对象,人工污染新鲜猪肉,利用预测微生物学中的生长预测模型建立不同恒温条件下沙门氏菌的生长模型,并验证其有效性,为政府监管部门防控沙门氏菌的污染提供理论支撑,降低因该菌污染所引起的食品安全风险。
1 材料与方法
1.1 实验材料
新鲜猪肉(里脊肉),购于上海市闵行区某大型超市;Luria-Bertani(LB)液/固体培养基,购于青岛高科技工业园海博生物技术有限公司;无菌生理盐水:称取9.0 g的氯化钠(NaCl),以少量去离子水充分溶解后,定容至1 000 mL。分装后,进行121 ℃灭菌(15 min)。
1.2 仪器与设备
MLS-3780型高压灭菌锅,日本SANYO公司;AES Chemunex型均质机,法国Marcy- L’etoile公司;超纯水机,美国Milli-Q公司;SW-CJ-1F型超净工作台,苏州安泰空气技术有限公司;微波炉,韩国LG公司;电子天平,瑞士Mettler Toledo公司;微量移液器,德国Eppendorf公司;MS-2型涡旋振荡器,德国IKA公司;HP-9272型恒温培养箱,上海一恒科学仪器有限公司;HZ-8211K型恒温摇床,太仓市科教仪器厂;LRH-150F型电热鼓风干燥箱,上海一恒科学仪器有限公司;Whirl-Park®型无菌均质袋,深圳Nasco公司;MIR-154型培养箱,日本SANYO公司。
1.3 实验方法
1.3.1菌株活化
用无菌接种环分别蘸取适量甘油冷冻管冻存的不同血清型沙门氏菌[10],LB平板上划线后,于37 ℃恒温培养箱中倒置培养过夜。次日,用无菌接种环挑取单菌落接种于LB液体培养基中,于37 ℃恒温摇床中振荡培养10~12 h。
1.3.2菌悬液的制备
取不同菌株的LB培养液,调整OD600为0.6,等比例混合。用无菌生理盐水将混合菌液梯度稀释,最终制成浓度为103~104CFU/mL的菌悬液,以备后续接种使用。
1.3.3样品制备
从超市购置新鲜猪里脊肉,在冷藏(0~4 ℃)条件下于1 h内带回实验室。将猪肉置于紫外灯下灭菌30 min,用无菌手术刀将猪肉均匀分块,每块25.0 g,厚度3.0~5.0 mm。
1.3.4接种
将1.3.3制备的肉块置于1.3.2中所制备的菌悬液中室温浸泡20 min,沥干肉块多余水分。将肉块分别放入不同的无菌保鲜盒(每个保鲜盒中放有一个无菌不锈钢架,防止肉块在恒温放置过程中与产生的肉汁接触而影响实验结果)中并分别置于4、10、25、33、37 ℃培养箱,每组3份,进行平行实验。
1.3.5沙门氏菌生长曲线测定
将1.3.4中的人工污染猪肉样品分别置于5个设定温度恒温培养箱中培养。每隔一段时间,每组分别取出3份25.0 g平行样品,分别置于无菌均质袋中,加入225 mL无菌生理盐水,均质机拍打3 min。用无菌生理盐水对处理样品的混合液进行10倍梯度稀释。取3个适宜梯度的稀释液(1.0 mL)涂布于LB平板上,37 ℃过夜培养,次日计数。具体方法参照GB 4789.2—2016[11]。
1.4 数据处理
所有数据均由Origin Pro 2017以及DMfit 3.5软件进行分析。
1.4.1沙门氏菌初级模型建立
基于修正的Gompertz模型,利用DMfit 3.5软件将沙门氏菌在不同温度下生长量的变化情况进行曲线拟合,得到沙门氏菌的初级生长模型。
修正的Gompertz模型方程见式(1)。
(1)
式(1)中:t是培养时间,h;N(t)是t时的微生物数量,CFU/g;N0是t=0时的初始微生物数量,CFU/g;Nmax表示生长至稳定期时的最大微生物数量,CFU/g;μmax表示微生物生长的最大比生长速率,h-1;λ表示微生物生长过程中的延滞期,h。
1.4.2温度对沙门氏菌生长影响二级模型的建立
由1.4.1建立的初级模型得到μmax和λ等参数,根据参数建立沙门氏菌的二级生长模型。二级生长模型以初级模型为基础,主要用于描述初级模型的参数(如λ、μmax等)与不同的环境参数(如温度、水分活度、pH值等)之间的关系。本研究主要着重于温度对初级模型参数(μmax和λ)的影响,利用平方根模型描述温度与μmax和温度与λ之间的变化关系。具体模型如式(2)和式(3)。
(2)
(3)
式(2)和式(3)中:T表示培养温度,℃;Tmin表示最低生长温度,℃;bμmax和bλ分别是两个方程的常数。
1.4.3沙门氏菌生长模型的验证
1.4.3.1 模型的内部验证
生长模型的内部验证主要基于各项数学参数。在本实验中主要利用Af、Bf、均方根误差(RMSE)、判定系数(R2)以及残差分析对模型进行内部验证。Af(见式(4))表示预测值与观测值之间的准确程度,如果Af>1,并且值越接近1,说明预测值和观测值越接近,该模型具有较高的准确度[12]。Bf(见式(5))表示预测值与观测值之间的偏差程度,若Bf<1,表示预测值比观测值小,表示该模型的预测值处于一个合理的范围内[12]。RMSE(见式(6))可以用来衡量预测准确度,说明该模型预测值的离散程度[12]。
(4)
(5)
(6)
在式(4)、式(5)中,μpre表示根据生长模型得到的微生物数量的预测值;μobs表示在相同时间,实际实验中所观察到的微生物数量;n表示实验次数。
R2用来对模型方程的拟合优度进行评价,如果R2越接近1,则表示该模型的拟合优度越高。残差分析指观测值与预测值之间的差,即实际观察值与模型预测值的差,并以此来分析模型的可靠性。
1.4.3.2 模型的外部验证
选取20 ℃和28 ℃作为额外的验证温度,在相同环境下对沙门氏菌进行生长曲线的测定,对已建立的模型进行可靠性评估。实验步骤同1.3。
1.4.4波动温度下沙门氏菌生长模型的建立
模拟日常生活中消费者购买冷藏的新鲜猪肉,带回家,再冷藏的过程。以4 ℃ 6 h,20 ℃ 3 h和4 ℃ 90 h作为波动温度条件,建立沙门氏菌在鲜猪肉中的生长模型。以等效生长时间理论为基础,用修正的Gompertz模型可以较好地描述波动温度下微生物的生长过程。当微生物在T1温度下培养时间t1,该阶段可用方程表示,见式(7)。
(7)
当微生物在温度T1下培养时间t1后,又进入温度T2培养时间t2时,根据EGT原理,T1温度下培养时长t1的过程,等效于在T2温度时培养时长te的生长过程,可用方程表示,见式(8)。
(8)
将λ1、λ2、μ1、μ2代入式(7)和式(8)后,可以得到te值。在温度T1培养t1后,温度波动至温度T2,这一过程可以用式(9)表述,其中Δt表示在温度T2时培养的时间。
(9)
1.4.5波动温度下沙门氏菌生长模型的验证
在波动温度下,该模型可靠性可以用Af、Bf等参数进行评价;但Af和Bf不再根据μmax进行计算,而是把同一时间点上观测得到的细菌量和模型预测得到的细菌量进行比较,再计算得到Af和Bf。波动温度下Af和Bf的计算公式见式(10)、式(11)。
(10)
(11)
2 结果与分析
2.1 市售新鲜猪肉中沙门氏菌初级生长模型分析
对在5个恒定温度下人工污染猪肉样品中的沙门氏菌进行计数,利用修正的Gompertz方程对结果进行拟合,得到沙门氏菌在猪肉中的生长曲线(图1)。图1显示,沙门氏菌在不同温度下生长曲线均能形成良好的“S”型,且温度对其生长影响较大。限定温度范围内,培养温度越高,细菌生长速率越高。当环境温度控制在10 ℃以下时,可以有效限制沙门氏菌生长。研究结果提示:为了较好地降低沙门氏菌的污染风险,需要尽早将食品低温保存。

图1 新鲜猪肉中沙门氏菌在不同温度下的生长曲线Fig.1 Growth curves of Salmonella at different temperatures in fresh pork
沙门氏菌生长动力模型参数分析见表1。由表1可见,不同培养温度下,各初级生长模型的判定系数R2均大于0.99,证明修正的Gompertz模型可以较好地反映出新鲜猪肉中沙门氏菌的生长规律。沙门氏菌的μmax和λ与温度关系密切,沙门氏菌的μmax随温度的升高而升高。当温度在4 ℃时,沙门氏菌的μmax为0.017 28,生长十分缓慢;当温度为37 ℃时,该菌μmax为0.818 5,远高于4 ℃时的μmax。沙门氏菌的λ随着温度的升高而不断减小。当温度在4 ℃时,λ为77.471 9;当温度达到37 ℃时,λ仅为2.279 5。温度对于沙门氏菌的最终浓度也有一定影响,25、33、37 ℃时的最终浓度均能达到108CFU/g以上,而在4 ℃和10 ℃这两个较低温度下,其最终浓度均低于108CFU/g。此结果与郑婷等[7]研究结果相吻合,其在冷却牛肉中沙门氏菌生长预测模型的建立研究中,同样证实生长速率与迟滞期对温度都具有很强的相关性。

表1 不同温度下沙门氏菌的生长参数Tab.1 Growth parameters of Salmonella at different temperatures
2.2 沙门氏菌二级模型分析与验证结果
2.2.1二级模型分析

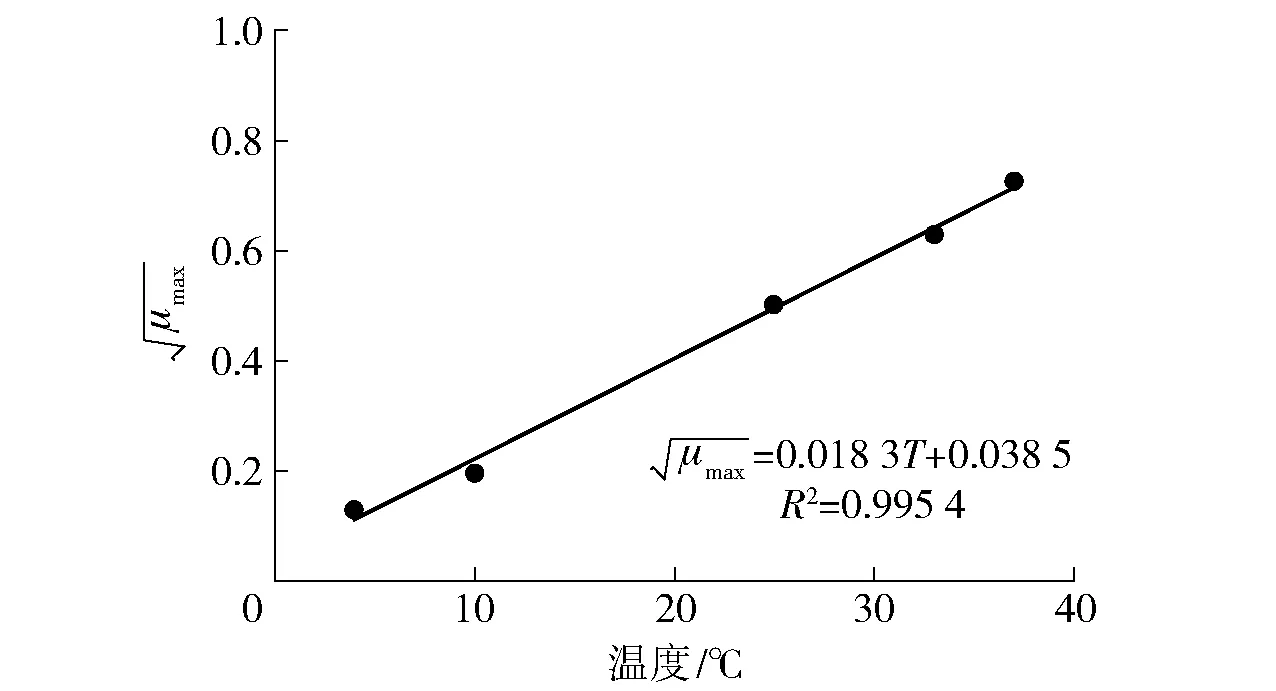
图2 温度与μmax的关系Fig.2 Fitted curve of the maximum specific growth rate and temperature

图3 温度与λ的关系Fig.3 Fitted curve of lag phase and temperature
2.2.2沙门氏菌生长模型验证结果分析


图4 沙门氏菌生长速率平方根模型的残差Fig.4 Residual error of Salmonella growth rate model
2)外部验证结果分析。根据在20 ℃和28 ℃两个温度下的额外实验所获得的实验数据,对已经建立的温度与μmax的关系进行二级模型的验证。结果见表2。
Te Giffel等[14]认为,Bf值在0.75~1.25时,该模型可信度较高,可以被接受。Braun等[15]认为,Af值在1.1~1.9时,生长模型可被接受。由表2可知,外部验证温度为20 ℃和28 ℃时,Bf分别为0.936 9和0.846 3,Af为1.174 6和1.181 6,均在可接受的范围内。
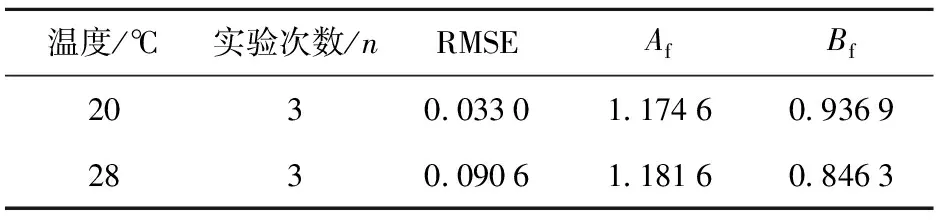
表2 模型外部验证中Af和BfTab.2 Af and Bf of external validation of model
2.3 波动温度下沙门氏菌生长模型分析与验证结果
在利用修正的Gompertz模型建立沙门氏菌初级生长模型的基础上,根据平方根模型,建立沙门氏菌的二级模型,见式(12)、式(13)。
(12)
(13)
在波动温度为4 ℃ 6 h,20 ℃ 3 h,4 ℃ 90 h的条件下,以恒定温度下建立的二级模型为基础,根据等效生长理论建立波动温度下沙门氏菌的生长模型。对新鲜猪肉中沙门氏菌在该条件下的实际生长状况进行定量测定。通过比较实测值与模型的预测值,评估该模型的可靠性,模型的建立与验证见图5。从图5结果中可以看出,实测值的分布趋势与模型曲线的趋势基本一致,且都落在预测曲线附近,表明建立的预测模型与沙门氏菌实际生长情况较为吻合。随温度升高至20 ℃,沙门氏菌的浓度有一个明显的上升趋势,说明温度的升高明显加快了沙门氏菌的生长,所以消费者在购买完猪肉后应及时将猪肉带回家,尽早烹饪或置于低温贮存。通过该预测模型还可以发现,在100 h内,沙门氏菌在波动温度下的生长量一直保持在103.8CFU/g以下,说明消费者从购买猪肉开始,再到将猪肉放在冰箱保存的4 d内,在低温条件下,沙门氏菌的生长量不大。在实验过程中也发现,猪肉的表面也未出现明显的腐败现象,无异味产生,这也验证了猪肉在该波动温度下微生物生长速度缓慢。

图5 波动温度下沙门氏菌浓度的实测值与预测值Fig.5 Observed values and predicted curves of Salmonella grown in pork at fluctuating temperature
图6表示在波动温度下,同一时间点沙门氏菌生长量的实测值与预测值之间的相关性。其中R2=0.944,说明预测值与实测值之间的相关性较高。

图6 波动温度下同一时间点沙门氏菌浓度实测值与预测值的相关性比较Fig.6 Observed values and predicted values under variable temperatures
本实验利用Af和Bf对波动温度下所建立的沙门氏菌生长模型进行评价,结果见表3。由表3可知,Af=1.136 2,误差在15%内,属于文献[14-15]得到的可接受范围;该模型的Bf=0.895 4,同样在文献[14-15]得到的可接受的范围内。因此,在波动温度下建立的生长模型在预测沙门氏菌生长状况方面可靠性较高。

表3 波动温度下沙门氏菌生长模型的准确性评价Tab.3 Af and Bf of predictive model at fluctuating temperatures
3 结 论
选取具有代表我国居民日常肉类膳食的市售新鲜猪肉为实验对象,将前期研究中得到的猪肉中检出率最高、分布最广的3种血清型沙门氏菌混合物对猪肉进行人工污染。分别测定了4、10、25、33、37 ℃五个恒定温度下细菌的生长规律,建立了市售新鲜猪肉中沙门氏菌的生长预测模型并利用DMfit 3.5软件进行拟合分析。
1)所得5个恒定温度下沙门氏菌的生长预测模型,R2均大于0.99,模型拟合程度高,结果可靠;μmax和λ分别随温度的升高而增大和缩短。在初级模型基础上建立了沙门氏菌的二级模型,该模型能够准确地反映出温度与μmax和λ间的关系,残差绝对值均小于0.05,在置信水平α= 0.05上可信。用20 ℃和28 ℃对模型进行验证,其Bf分别为0.936 9和0.846 3,Af为1.174 6和1.181 6,均在可接受的范围内,表明该模型能有效预测猪肉中沙门氏菌的生长状况。
2)基于等效时间理论建立的波动温度下沙门氏菌的生长预测模型,实测值的分布趋势与模型曲线的趋势基本一致。同一时间点沙门氏菌生长量的实测值与预测值之间的R2=0.944,模型拟合良好。利用Af和Bf对波动温度下所建立的生长模型进行评价,Af=1.136 2,Bf=0.895 4,表明波动温度下建立的生长模型在预测沙门氏菌生长状况方面可靠性较高。
3)研究结果提示,消费者在购买猪肉后应尽快食用或放在低温环境下保存,以降低因沙门氏菌增殖而增加的食品安全风险。
参考文献:
[1] MAJOWICZ S, MUSTO J, SCALLAN E, et al. The global burden of nontyphoidalSalmonellagastroenteritis[J]. Clinical Infectious Diseases, 2010, 50(6): 882-889.
[2] 王军, 郑增忍,王晶钰.动物源性食品中沙门氏菌的风险评估[J]. 中国动物检疫, 2007, 24(4): 23-25.
WANG J, ZHENG Z R, WANG J Y. Risk assessment ofSalmonellain animal origin foods[J]. Chinese Journal of Animal Quarantine, 2007, 24(4): 23-25.
[3] 张莉,尹德凤, 张大文, 等. 常温下热鲜猪肉中沙门氏菌生长预测模型的建立[J]. 食品工业, 2017, 38(7): 201-205.
ZHANG L, YIN D F, ZHANG D W, et al.Predictive models forSalmonellain fresh pork at household temperatures[J]. Food Industry, 2017, 38(7): 201-205.
[4] BAI L, LAN R, ZAHNG X, et al. Prevalence ofSalmonellaisolates from chicken and pig slaughterhouses and emergence of ciprofloxacin and cefotaxime co-resistantS.entericaserovarIndiana in Henan, China[J]. PLoS ONE, 2015, 10(12): e0144532.
[5] 陈玲, 张菊梅, 杨小鹃, 等. 南方食品中沙门氏菌污染调查及分型[J]. 微生物学报, 2013, 53(12):1326-1333.
CHEN L, ZHANG J M, YANG X J, et al.Prevalence and characterization ofSalmonellaspp. from foods in South China[J]. Acta Microbiologica Sinica, 2013, 53(12): 1326-1333.
[6] MARGAS E, MENESES N, BEATRICE C P, et al. Survival and death kinetics ofSalmonellastrains at low relative humidity,attached to stainless steel surfaces[J]. International Journal of Food Microbiology,2014,187(18): 33-40.
[7] 郑婷, 董鹏程, 王仁欢,等. 冷却牛肉中沙门氏菌生长预测模型的建立和验证[J]. 食品与发酵工业, 2015, 41(7): 38-44.
ZHENG T, DONG P C, WANG R H, et al.Establishment and validation of predictive model ofSalmonellain beef[J]. Food and Fermentation Industries, 2015, 41(7): 38-44.
[8] WEN X, DICKSON J S. Survival ofCampylobacterjejuniandSalmonellaentericatyphimurium in vacuum-packed, moisture enhanced pork[J]. Journal of Food Protection, 2012,75(3):576-580.
[9] HUANG L. Estimation of growth ofClostridiumperfringensin cooked beef under fluctuating temperature conditions[J]. Food Microbiology, 2003, 20(5): 549-559.
[10] NI P E, XV Q, YIN Y J, et al. Prevalence and characteri-zation ofSalmonellaserovars isolated from farm products in Shanghai[J]. Food Control, 2018, 85: 269-275.
[11] 中华人民共和国国家卫生和计划生育委员会. 食品微生物检验 菌落总数测定:GB 4789.2—2016[S]. 北京: 中国标准出版社, 2016.
[12] 王军, 董庆利, 丁甜. 预测微生物模型的评价方法[J]. 食品科学, 2011, 32(21): 268-272.
WANG J, DONG Q L, DING T. An overview of evaluation methods for predictive microbial growth models[J]. Food Science, 2011, 32(21): 268-272.
[13] 张新林, 谢晶, 钱韵芳,等.不同温度条件下三文鱼中荧光假单胞菌生长预测模型的建立[J]. 食品科学, 2017, 38(21): 74-79.
ZHANG X L, XIE J,QIAN Y F, et al.Predictive growth model forPseudomonasfluorescencein salmon at different temperatures[J]. Food Science, 2017, 38(21): 74-79.
[14] TE GIFFEL M C, ZWIETERING M H. Validation of predictive models describing the growth ofListeriamonocytogenes[J]. International Journal of Food Microbiology, 1999, 46(2): 135-149.
[15] BRAUN P, SUTHERLAND J P. Predictive modelling of growth and enzyme production and activity by a cocktail ofPseudomonasspp.,ShewanellaputrefaciensandAcinetobactersp.[J]. International Journal of Food Microbiology, 2003, 86(3): 271-282.
