PRRSV诱导猪体内肺泡巨噬细胞炎症模型的建立
2018-05-30罗文涓杨剑敖妙刘妍璨覃一峰文露婷黎江韦英益胡庭俊
罗文涓 杨剑 敖妙 刘妍璨 覃一峰 文露婷 黎江 韦英益 胡庭俊
摘要:【目的】建立猪繁殖与呼吸综合征病毒(PRRSV)诱导体内猪肺泡巨噬细胞(PAM)炎症模型,评价PRRSV感染对仔猪免疫系统的影响,为猪繁殖与呼吸综合征(PRRS)的临床诊断及科学防控提供参考依据。【方法】以PRRSV-GXNN1396株人工感染30日龄健康断奶仔猪,复制出PRRS病症,剖杀后采集病料,通过组织病理学和RT-PCR检测观察各免疫器官组织的病理变化及其病毒分布情况,并检测PAM细胞内的COX-1、COX-2等酶活性变化及IL-6、IL-8、IL-10、IL-1β、IFN-y、MCP-1和TNF-a等炎性细胞因子水平变化。【结果】断奶仔猪接种PRRSV-GXNN1396株后第3d开始表现出典型的PRRS病症,PRRSV主要集中在肺脏、颌下淋巴结、血液和扁桃体等样品组织中,攻毒仔猪各主要器官的实质细胞及有关淋巴细胞均出现不同程度坏死和炎症细胞浸入现象,尤其以肺脏、肾脏、脾脏等器官受损严重,出现巨噬细胞和淋巴细胞浸润。PRRSV感染早期(第3d)仔猪PAM细胞中的ROS水平及COX-2、IL-6、IL-8、TL-10和TNF-a等因子水平均呈升高趋势,且COX-2、IL-6、IL-8和TNF-a因子水平极显著升高(P<0.01);随着感染天数的增加,PAM细胞内的COX-2、IL-6和IL-8因子水平呈下降趋势,TNF-a因子水平呈上升趋势。【结论】成功建立了PRRSV诱导仔猪体内PAM细胞炎症模型,进一步佐证PRRSV主要侵害猪的免疫器官组织,以达到免疫抑制的效果,并推断感染第3d是病猪炎症反应的高峰期。
关键词:猪;猪繁殖与呼吸综合征病毒(PRRSV);肺泡巨噬细胞(PAM);炎症模型;炎性细胞因子
0引言
【研究意义】猪繁殖与呼吸综合征病毒(Porcinereproductive and respiratory syndrome virus,PRRSV)隶属于尼多病毒目(Nidovirale)、动脉炎病毒科(Ar-teriviridae)、动脉炎病毒属(Arterivirus),为单股正链RNA病毒;PRRSV感染能引起妊娠母猪晚期流产、产死胎、木乃伊胎及新生仔猪和生长猪出现呼吸障碍或死亡(张华等,2016)。肺泡巨噬细胞(Pulmo-nary alveolar macrophages,PAM)是影响宿主免疫系统重要的免疫细胞,也是PRRSV感染最主要的靶细胞,即PRRSV感染可导致PAM细胞的免疫功能受到抑制(Lunney et al,2016;焦文强等,2017)。因此,研究猪群感染PRRSV后PAM细胞不同时间段胞内炎性细胞因子的变化规律,对揭示PRRSV感染宿主的致病机制具有重要意义。【前人研究进展】PRRSV在全球大部分地区流行,是目前危害养猪业的主要疾病之一(黎源强,2014;高延娜等,2016;焦文强等,2017),而PRRSV如何介导炎症反应及其调控的分子机制已成为研究热点。李传民等(2014)利用不同浓度的PRRSV感染PAM细胞,并在不同时间点检测干扰素y诱导蛋白30基因(IFI3D)的表达情况,结果表明,IFI30基因在PRRSV感染PAM细胞过程中的表达变化规律可能是PRRSV与宿主相互作用的机制之一。王超(2015)研究证实,PRRSV感染激活NL-RP3炎症小体并产生IL-1β等促炎性细胞因子抵御病毒入侵和保护机体,同时编码能拮抗NLRP3炎症小体活化的蛋白——nsp11和nspla,以抑制炎症发生,从而使其能在宿主体内持续增殖。余志彬(2016)研究发现PRRSV感染可诱导IL-12p40和IL-12p35表达,其中,PRRSV对IL-12p40的诱导依赖于JNK-AP-1和NF-KB信号途径,而对IL-12p35的诱导依赖于p38 MAPK和PKC信号通路。张玲等(2016)研究表明,PRRSV能引起强烈的肺部病理学变化和病毒血症,且与IL-1β、IL-6、TNF-a等炎性细胞因子存在一定关联。夏天奇等(2017)研究表明,PRRSV感染PAM细胞体外诱导IL-10表达水平的差异可能是其诱导p38 MAPK磷酸化水平差异所致。【本研究切入点】明确PRRSV诱导炎性细胞因子信号转导通路是揭示其致病和免疫机制的关键,但目前以PRRSV感染仔猪建立体内PAM细胞炎症模型的研究较少。【拟解决的关键问题】以PRRSV-GXNN1396株感染健康断奶仔猪,通过组织病理学和RT-PCR检测观察各免疫器官组织的病理变化及其病毒分布情况,并检测PAM细胞内的COX-1、COX-2等酶活性变化及IL-6、IL-8、TL-10、IL-1B、WN-y、MCP-1、TNF-a等炎性细胞因子水平变化,评价PRRSV感染对仔猪免疫系统的影响,为猪繁殖与呼吸综合征(PRRS)的临床诊断及科学防控提供参考依据。
1材料与方法
1.1试验材料
PRRSV-GXNNl396株(P3)由广西大学预防兽医学重点实验室提供,经Marc-145细胞(猴胚胎肾上皮细胞)增殖后获得PRRSV-GXNNl396株,其病毒滴度为4x104/0.1 mL;Marc-145细胞购自中国科学院上海生命科学研究院细胞资源中心,由广西大学动物科学技术学院药理实验室保存提供;30日龄健康断奶仔猪购自广西南宁上方牧业有限责任公司,经RT-PCR/PCR和ELISA检测PRRSV/PCV-2抗体及抗原均呈阴性;病毒基因組DNA/RNA提取试剂盒购自北京康为世纪生物科技有限公司;COX-1、COX-2、IL-6、IL-8、IL-10、IL-1B、WN-y,MCP-1和TNF-a等检测试剂盒购自江苏晶美生物科技有限公司,XOD、ROS和MPO等检测试剂盒购自南京建成生物工程研究所。主要仪器设备:UV1750型紫外分光光度计、Multimode PlateReader多功能酶标仪、S1000梯度PCR仪、C150细胞培养箱和TS100-F倒置显微镜等。
1.2试验方法
1.2.1试验分组及处理将12头30日龄健康断奶仔猪随机分为两组,其中,攻毒组经滴鼻感染/头颈部肌肉注射(2.0 mL/头),病毒量为4x104TCID50的PRRSV-GXNN1396株,空白对照组感染等剂量RPMI-1640。接种后每天观察仔猪的临床表现,测定体温和体重变化。
1.2.2病毒核酸檢测于感染后第2 d(攻毒48 h),采集供试仔猪血清、鼻拭子、肛门拭子进行病毒检测,确定仔猪是否感染PRRSV。剖杀后采集PAM细胞、血清、鼻拭子、肛门拭子及各组织器官,采用RT-PCR进行病毒检测,具体操作参照病毒基因组DNA/RNA提取试剂盒说明。
1.2.3组织病理学观察采集试验仔猪的颌下淋巴结、腹股沟淋巴结、肠系膜淋巴结、胸腺、肺脏、心脏、肝脏、脾脏、肾脏和扁桃体等器官组织,以10%甲醛固定,按常规流程制备石蜡切片,经HE染色后进行光学显微镜观察。
1.2.4炎性细胞因子水平检测
经前腔静脉采血后,颈静脉放血致死试验仔猪。无菌解剖,剥离气管并用无菌棉线结扎,取出完整肺脏,用无菌PBS充分冲洗肺脏表面,清除血渍和污物,用灭菌手术剪剪断结扎的气管,移液管吸取PBS灌入肺脏使其充盈,用手轻捏揉肺叶数次后,收集肺脏中的液体,重复灌洗多次;收集的液体过200目滤筛后分装于50.0 mL离心管中,4℃下2000 r/min离心10 min;用10%RPMI-1640稀释后进行细胞计数,调节其浓度至1x108/mL,超声波破碎分装后立即进行检测或-80℃保存备用。血样常温静置2h后8000r/min离心3 min,取上清液分装检测或-80℃保存备用。ROS水平采用荧光探针进行测定,NO含量采用Griess法测定,GSH含量采用酶标法测定,XOD、MPO和iNOS活性采用分光光度法测定,COX-1、COX-2、IL-6、IL-8、TL-10、IL-1B、IFN-y、MCP-1和TNF-a因子水平采用ELISA试剂盒进行测定。
1.3统计分析
试验数据采用SPSS 21.0进行单因素方差分析(One-way ANOVA)。
2结果与分析
2.1攻毒仔猪的临床症状
断奶仔猪接种PRRSV-GXNN1396株后第3 d开始表现出典型的PRRS病症,体温上升到40.0℃以上,食欲不振,精神沉郁,尿黄,部分病猪伴有流清鼻涕和呼吸困难症状;攻毒后5~6 d仔猪出现轻微腹泻,体温持续性升高,眼部结膜炎,部分仔猪可见耳部、体表皮肤微发紫等症状。空白对照组仔猪未见异常症状。
2.2病毒分布情况
攻毒后48 h进行前腔静脉采血,并剖杀仔猪采集鼻拭子、肛门拭子及器官组织病料,分批次进行RNA抽提,检测仔猪感染PRRSV情况,结果显示,从攻毒组仔猪的血样及各种病料组织均能检测到PRRSV核酸,而空白对照组仔猪未检测出PRRSV核酸。对比各病料样品中的PRRSV核酸含量,发现其主要集中在肺脏、颌下淋巴结、血液和扁桃体等样品组织中,即PRRSV主要集中在宿主的免疫器官。
2.3器官组织病理变化
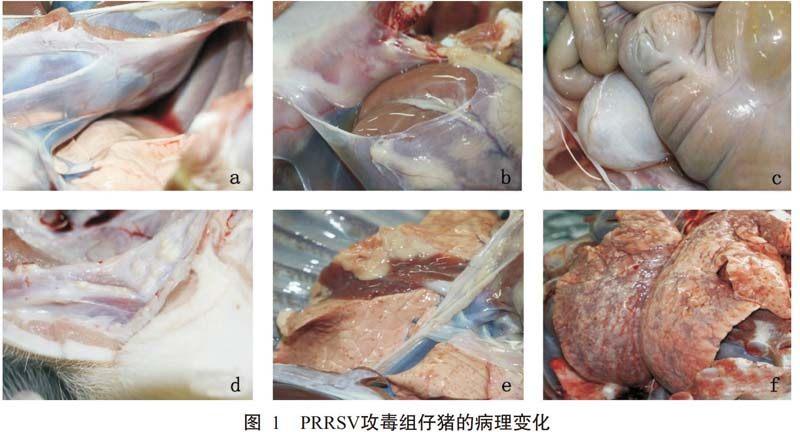
通过剖检观察发现,空白对照组仔猪的器官组织未见异常病理变化,而攻毒组仔猪出现PRRSV感染的典型病理变化,且病变主要集中在肺脏和淋巴结等免疫器官组织。由图1可看出,攻毒组仔猪出现明显的纤维性胸膜炎、腹膜炎及心包炎,其胸腔、腹腔出现大量积液,伴有恶臭味;心脏被膜也出现严重炎症,有黏着感及大量心包积液;颌下淋巴结及腹股沟淋巴结周围出现大量大小不一的乳白色结节;肺脏呈间质增生性肺炎,其隔叶呈大面积严重的“肉样变”,且伴有不同程度的出血点,个别仔猪的整个肺脏呈暗红色,出现分布较均匀的“肉样变”及出血点,肺小叶间隔增宽,严重水肿。
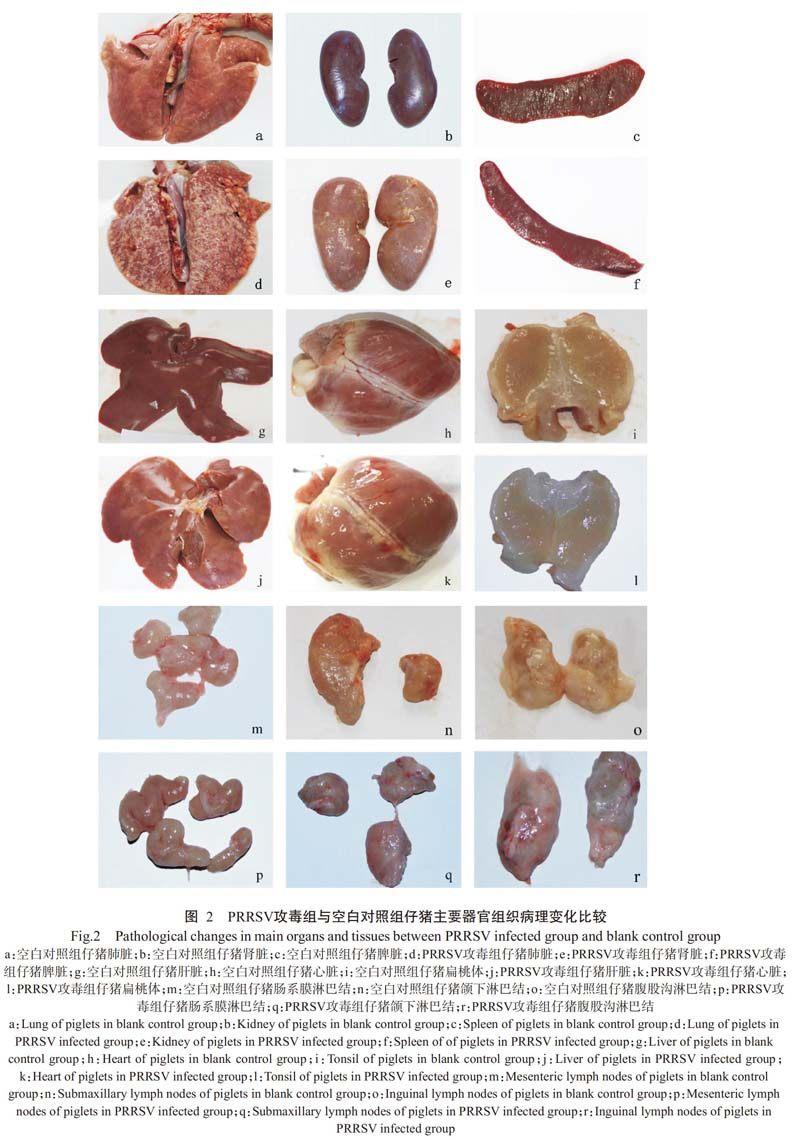
与空白对照组仔猪进行对比,结果(图2)发现攻毒组仔猪肺部呈特征性的间质性肺炎病变,其尖叶、心叶和膈叶均出现明显的暗红色“肉样变”区域,有出血点、肿大和问质增宽;肾脏呈褐色或土黄色,质地较脆,未见明显肿胀;脾脏轻微肿胀,无明显病变;肝脏轻微肿大、淤血;心脏出现心包炎,心冠脂肪呈胶冻样;扁桃体轻微充血、出血;肠系膜、颌下和腹股沟等处的淋巴结肿大、轻微出血。
2.4病理组织切片观察结果
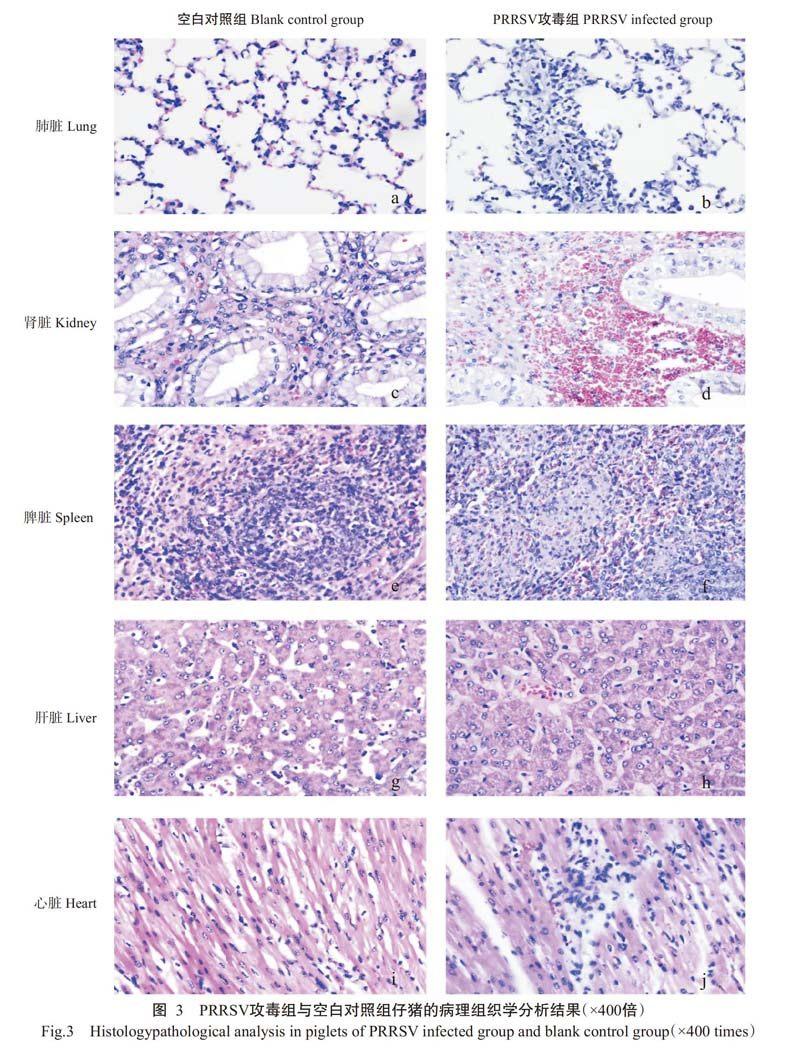
于攻毒后第3和6d分别剖杀试验仔猪,并采集脾脏、肾脏、肝脏等器官组织制作病理切片,经HE染色,观察其病理变化。结果(图3)发现,空白对照仔猪的器官组织结构均未出现异常变化,而攻毒组仔猪的器官组织结构均发生明显病变。肺脏:主要表现为间质增生性肺炎,肺间质的PAM细胞呈增生现象,导致问质增宽,肺泡膈轻微变厚,有少量酸性粒细胞浸润,大量巨噬细胞浸润。肾脏:主要表现为急性出血性间质性肾炎,皮质部上皮细胞肿胀,有出血现象;髓质部严重充血、淤血,有少量炎性细胞浸润。脾脏:主要表现为急性坏死性脾炎,脾小体广泛性充血、出血,淋巴组织灶状坏死严重,且伴有中性粒细胞浸润。肝脏:主要表现为肝细胞肿胀、颗粒变性,伴有轻微充血、出血现象,有嗜中性粒细胞和淋巴细胞浸润。心肌:主要表现为心肌纤维间有淋巴细胞、巨噬细胞浸润,且伴有轻微的充血、出血现象。
2.5炎性细胞因子水平检测结果
2.5.1ROS水平由图4可看出,与空白对照组仔猪相比,攻毒组仔猪在攻毒后第6 d的PAM细胞内ROS水平极显著升高(P<0.01,下同),表明PRRSv感染能提高仔猪PAM细胞内的ROS水平,且随感染天数的增加而逐渐提高。
2.5.2NO含量由图5所示,与空白对照组仔猪相比,攻毒组仔猪PAM细胞内的NO含量较低,且随感染天数的增加无显著变化(P>0.05,下同),表明PRRSV感染能降低仔猪PAM细胞内的NO含量。
2.5.3GSH含量由图6可看出,与空白对照组仔猪相比,攻毒组仔猪在攻毒后第3 d的PAM细胞内GSH含量极显著降低,但至攻毒后第6 d略有回升,且显著高于空白对照组(P<0.05,下同)。
2.5.4XOD、MPO和iNOS活性由图7可看出,与空白对照组仔猪相比,攻毒组仔猪攻毒后第3 d的PAM细胞内XOD活性极显著降低,但至攻毒后第6 dPAM细胞内的XOD活性显著升高;仔猪PAM细胞内的MPO和iNOS活性随攻毒及感染天数的增加无显著变化。
2.5.5
COX-1、COX-2、IL-6、IL-8、TL-10、IL-1β、IFN-y、MCP-1和TNF-a因子水平
由图8可看出,PRRSV感染整体上能提高仔猪PAM细胞内的COX-2、IL-6、IL-8、IL-10和TNF-a因子水平,降低COX-1、IL-1β、IFN-y和MCP-1因子水平。与空白对照组仔猪相比,PRRSV感染早期(第3 d)攻毒组仔猪PAM细胞内的COX-2、IL-6、IL-8和TNF-a水平极显著升高,而COX-1水平极显著降低。随着感染天数的增加,PAM细胞内COX-2、IL-6和IL-8因子水平呈下降趋势,TNF-at因子水平呈上升趋势,而IL-10、IL-1B、MCP-1、COX-1和IFN-y因子水平无显著变化。
3讨论
PRRS暴发于20世纪80年代末,PRRSV在不断变异过程中形成了毒力更强的变异毒株,即高致病性PRRSV(田克恭,2015;宋吉卫,2016)。高致病性PRRSV感染病猪除表现出经典的蓝耳病症状外,还可见体温明显升高(在41.0℃以上),且呈持续性高热;皮肤发红,部分病猪耳部发绀、出血、瘀血呈紫红色;精神沉郁;食欲减退或废绝;眼部结膜炎,眼睑水肿;伴有咳嗽、气喘等呼吸障碍。该病传染性强,死亡率高,流行期长,给养猪业造成巨大的经济损失(宋淑英等,2015;高延娜等,2016)。本研究以PRRSV-GXNN1396株人工感染断奶仔猪,成功复制出典型的PRRS病症,病猪出现持续高热(40.0~42.0℃)、呼吸困难、食欲不振、精神沉郁、耳部发绀、眼部结膜炎等症状,与生产中的临床发病特征相似。此外,剖解观察发现病猪出现肺脏实变、淋巴结肿大等病变,组织结构病理变化也主要表现为间质性肺炎、淋巴样组织炎症,与Amarilla等(2017)、苏景(2017)的研究结果一致。
病理组织学变化观察及病毒分布检测是研究PRRSV致病机理的基础(王隆柏等,2016)。本研究结果显示,PRRSV感染仔猪各主要器官的实质细胞及有关淋巴细胞均出现不同程度坏死和炎症细胞浸入现象,尤其以肺脏、肾脏、脾脏等器官受损严重,出现巨噬细胞和淋巴细胞浸润;病毒核酸RT-PCR检测结果显示,PRRSV主要集中于肺脏、颌下淋巴结、血液和扁桃体等样品组织中,与李冰等(2015)的研究结果相似,即PRRSV感染猪体后肺脏出现急性间质性肺炎,大量肺泡细胞变性坏死、脱落,大量纤维和巨噬细胞增生,淋巴结坏死等现象。其原因是PRRSV在单核巨噬细胞内完成病毒繁殖复制过程,主要侵害富含巨噬细胞或单核细胞的组织器官。PRRSV感染除引起广泛性血管炎和炎性细胞聚集外,还随渗出物进入各组织部位并被巨噬细胞吞噬,同时病毒进行自我复制,进而造成特征性的坏死性炎症病变(李易儒等,2016;陈泽芳和赵爱莉,2017)。可见,PRRSV主要侵害猪的免疫器官组织,以达到免疫抑制的效果。
PRRSV感染豬体会引起免疫系统产生免疫保护作用(Correas et al,2017),刺激白细胞介素、淋巴因子、干扰素等细胞因子的免疫调节过程(宋爽,2013;李建臻等,2016)。本研究采用ELISA试剂盒检测猪PAM细胞中ROS、NO和GSH含量,COX-1、COX-2、IL-6、IL-8、IL-10、IL-1β、IFN-y、MCP-1和TNF-a因子水平及XOD、MPO和iNOS活性的变化,结果显示,PRRSV感染早期(第3d)仔猪PAM细胞中的ROS水平及COX-2、IL-6、IL-8、IL-10和TNF-a等因子水平均呈升高趋势,且COX-2、IL-6、IL-8和TNF-a因子水平极显著升高,因此推断感染第3 d是病猪炎症反应的高峰期。本研究成功建立了PRRSV诱导仔猪体内PAM细胞炎症模型,可为PRRSV感染的临床诊断及科学防控提供参考依据。但由于本研究仅选取攻毒后第3和6d两个检测时间点进行对比分析,所得结论尚需通过多株PRRSV毒株进行对比验证,并增加检测时间点,探究不同PRRSV毒株在不同时间点对仔猪免疫系统造成的危害,揭示PRRSV感染宿主的致病机制。
4结论
成功建立了PRRSV诱导仔猪体内猪PAM细胞炎症模型,进一步佐证PRRSV主要侵害猪的免疫器官组织,以达到免疫抑制的效果,并推断感染第3d是病猪炎症反应的高峰期。
