载EWVDV多模态纳米粒的相变及体外血栓靶向性研究*
2018-05-29郭大静重庆医科大学附属第二医院放射科重庆400010
周 君,徐 杰,张 瑜,刘 佳,郭大静(重庆医科大学附属第二医院放射科,重庆400010)
动脉血栓严重威胁人类健康,可引起心肌梗死、缺血性脑卒中、肺栓塞等严重疾病,在世界范围内其发病率和病死率居高不下[1]。因此,早期准确诊断、及时治疗能挽救缺血坏死组织,减少并发症,降低病死率。近年来,分子影像学的发展促进了动脉血栓的早期诊断及个体化治疗。国内外已有大量靶向诊断血栓的分子探针[2-5],在此基础上,本研究旨在利用聚乳酸/羟基乙酸(PLGA)为载体,制备载血栓亲和性肽谷氨酸-色氨酸-缬氨酸-天冬氨酸-缬氨酸(EWVDV)的超声及磁共振相变型多模态分子探针,以期借助多模态分子影像技术从分子及细胞水平实现对血栓的早期精准诊断,为血栓性疾病的治疗及预后判断提供基础依据。
1 材料与方法
1.1 材料
1.1.1 仪器 光学显微镜(日本Olympus公司);激光粒径仪(Zeta SIZER 3000HS,英国Malvern公司);流式细胞仪(FSCS-Vantate SE,美国BD公司);红外仪(美国Fluke公司);超声仪(意大利Esaote公司);光声成像系统(Vevo Laser,加拿大 VisualSonics公司);3.0T磁共振扫描仪(荷兰Philips公司)。
1.1.2 试剂 羧基PLGA(配比75∶25,相对分子质量为8 000,济南岱罡生物材料有限公司);有机物可溶性Fe3O4纳米粒子(油酸表面修饰,美国Ocean NanoTech公司);全氟己烷(PFH,美国Elf Atochem公司);印度墨水(美国Amresco公司);GA修饰的EWVDV肽(上海吉尔生化有限公司);1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)、N-羟基琥珀酰亚胺(NHS)、2-(N-吗啡啉)乙磺酸(MES)、聚乙烯醇(PVA)及 DiI染色剂均购于美国Sigma公司;其他试剂均为国产分析纯。
1.2 多模态纳米粒的制备及表征
1.2.1 非靶向多模态纳米粒的制备 采用三步乳化法,首先取200 μL 10%印度墨水加入200 μL PFH,声振70 s(功率100 W)形成黑色乳液;将100 mg PLGA加入3 mL二氯甲烷,待其完全溶解后加入80 μL经油酸修饰的Fe3O4,振摇20 min,使其充分混合;然后倒入上述黑色乳液,声振70 s形成深灰色初乳;最后加入10 mL 4%PVA溶液,声振70 s,形成浅灰色乳液;加入20 mL 2%异丙醇,将上述溶液置于通风橱搅拌2 h,使有机溶剂充分挥发,全程冰浴。再经双蒸水洗涤、离心3次,得非靶向纳米粒(PFH-Ink-Fe)。制备PFH-Fe及PFH-Ink纳米粒时分别省去印度墨水及Fe3O4的投入,其他步骤同上;将制备的纳米粒置于4℃冰箱内储存备用。DiI染色非靶向纳米粒制备在溶解PLGA时加入少量DiI。
1.2.2 靶向血栓多模态纳米粒制备 采用碳二亚胺法[6],取少量PFH-Ink-Fe纳米粒分散在10 mL MES缓冲液(0.1 mol/L,pH=5.0)中,加入过量的偶联活化剂EDC/NHS(质量比2∶1)于4℃孵育2 h,用双蒸水离心、洗涤去除未反应的EDC/NHS,将活化后的PFH-Ink-Fe纳米粒分散于10 mL MES缓冲液(0.1 mol/L,pH=8.0)中,加入适量GA修饰及罗丹明标记的EWVDV肽置于摇床上孵育1 h,用双蒸水离心、洗涤去除未反应的EWVDV肽,即得靶向血栓多模态分子探针(EWVDVPFH-Ink-Fe),EWVDV-PFH-Fe、EWVDV-PFH-Ink 纳米
粒的制备方法同上;将制备好的纳米粒置于4℃冰箱内储存备用。
1.2.3 靶向血栓多模态纳米粒理化性质表征 (1)观察纳米粒形态、大小及分散性。(2)检测纳米粒的粒径及粒径分布。(3)检测罗丹明标记的EWVDV的连接率。
1.3 热致相变 取50 μL 10 mg/mL EWVDV-PFH-Ink-Fe纳米粒滴在载玻片上,用加热板分别加热到50、55、60、65、70、75、80 ℃,于每组温度下加热 2、3、4、5、6、7 min时各采1次图。观察相变微泡大小。
1.4 光致相变及超声成像
1.4.1 激光辐照时间与纳米粒温度关系 将200 μL 10mg/mLEWVDV-PFH-Ink-Fe纳米粒加入孔径为0.5cm2的琼脂糖凝胶孔洞模型内,采用808 nm激光仪,将激光探头固定于模型正上方4 cm处,分别用辐照强度A=0.444 W/cm2、B=0.930 W/cm2、C=1.294 W/cm2、D=1.730 W/cm2对EWVDV-PFH-Ink-Fe纳米粒进行激光辐照,同时用红外仪记录温度变化,每隔10 s采图1次,共30次,组合为激光辐照时间与纳米粒热致相变光镜图。
1.4.2 激光辐照后纳米粒温度与超声成像研究 将200 μL 10 mg/mL EWVDV-PFH-Ink-Fe纳米粒加入孔径为0.5 cm2的琼脂糖凝胶孔洞模型内,将激光探头固定于模型正上方4 cm处对样品进行激光辐照,同时用红外仪记录实时温度,当样品温度达到 50、55、60、65、70、75、80℃时,用超声仪分别在B模式和造影模式下采集超声声像图,采用DFY超声图像定量分析软件测量图像声强度。
1.5 纳米粒光声成像及磁共振成像研究
1.5.1 纳米粒光声成像 将200μL10mg/mL的EWVDVPFH-Ink-Fe纳米粒加入孔径为0.5 cm2的琼脂糖凝胶孔洞模型内,激光辐照60 s,激发波长706 nm,用光声成像系统采集图像。
1.5.2 纳米粒磁共振成像 分别将3 mL双蒸水及3 mL质量浓度分别为 0.4、0.8、1.2、1.6、2.0 mg/mL 的 EWVDVPFH-Ink-Fe纳米粒加入Eppendorf管中,每管均用8%明胶溶液定容至4 mL,充分混匀,避免纳米粒发生沉降,以双蒸水为背景,置于3.0T磁共振扫描仪上行T2WI扫描,采用头颅专用单通道正交线圈,FFE序列。扫描参数:TR=87 ms,TE=9 ms,翻转角度(FP)45°,体素0.6 mm×0.6 mm×3.0 mm,矩阵 147×147,激励次数 4次。
1.6 纳米粒对体外血栓靶向性 取新西兰大白兔耳缘静脉血10 mL,加至20 mL烧杯中,37℃孵育5 h至血栓形成。将血栓切成10 mm×10 mm大小,分别加入5 mL 10 mg/mL均经 DiI染色的PFH-Ink-Fe纳米粒和EWVDV-PFH-Ink-Fe纳米粒中孵育30 min,37℃水浴。
取出血栓,用磷酸盐缓冲溶液(PBS)反复冲洗,去除游离纳米粒。将血栓做冰冻切片,在普通光镜和荧光显微镜下观察。为防止切片变干,部分切片上滴加少量双蒸水。
2 结 果
2.1 纳米粒的理化特性 EWVDV-PFH-Ink-Fe纳米粒在光镜下显示其粒径较均一,表面光滑,呈球形,分散性好,激光粒径仪测得微球的平均粒径为370.7 nm,PDI=0.172。流式细胞仪测得罗丹明标记的EWVDV的连接率为62.5%。
2.2 热致相变 光镜下见EWVDV-PFH-Ink-Fe纳米粒在各个温度组下不同加热时间点均变成微泡,相变纳米粒的数量由少变多,体积从小到大,并向中心聚集,部分体积较大的微泡破裂产生射流现象,冲击周围的微泡。在相同温度下,加热时间越长,相变纳米粒的数目越多,直径越大;在相同的加热时间下,随着温度升高,相变纳米粒数目越多,直径越大,见图1。纳米粒相变后直径从数十微米到数百微米不等,较大的微泡可达210 μm左右。

图1 EWVDV-PFH-Ink-Fe纳米粒热致相变光镜图
2.3 光致相变及超声成像
2.3.1 激光辐照时间与纳米粒温度关系 在A=0.444 W/cm2、B=0.930 W/cm2、C=1.294 W/cm2、D=1.730 W/cm2等4组不同辐照强度下,EWVDV-PFH-Ink-Fe纳米粒温度在实验时间内均逐渐升高,且辐照功率越高温度升高幅度越大,速度越快。在辐照强度为1.730 W/cm2时,纳米粒于280 s达到最高温度91.7℃,见图2。

图2 激光辐照时间与EWVDV-PFH-Ink-Fe纳米粒温度关系
2.3.2 激光辐照后纳米粒温度与超声成像研究 当激光辐照后EWVDV-PFH-Ink-Fe纳米粒温度为50、55℃时,肉眼未见明显相变微泡,超声仪未探测到明显回声信号;当纳米粒温度达到60~80℃时,在凝胶模型上方可见白色、大小均匀相变微泡,B模式及造影模式下均探及微泡产生的强回声;超过60℃后B模式下回声强度明显升高,并保持在相对稳定状态,而造影模式下回声强度随温度的增高而逐渐升高,见图3。

图3 激光辐照EWVDV-PFH-Ink-Fe纳米粒达到不同温度时B模式及对比模式下声像图
2.4 纳米粒光声成像及磁共振成像
2.4.1 纳米粒光声成像 光声成像系统可检测到EWVDV-PFH-Ink-Fe纳米粒的红色光声信号,证实了Fe3O4和印度墨水的光声成像能力。见图4。
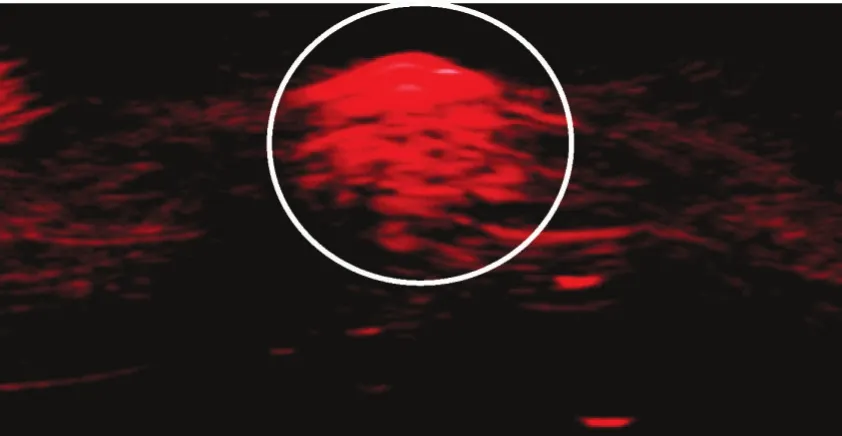
图4 EWVDV-PFH-Ink-Fe纳米粒光声成像图
2.4.2 纳米粒磁共振成像 磁共振扫描示各组不同水平EWVDV-PFH-Ink-Fe纳米粒信号与双蒸水信号比较均有不同程度降低,且随样品中纳米粒水平的增加,T2信号的降低越发明显,证实该纳米粒可有效降低T2信号。见图5。
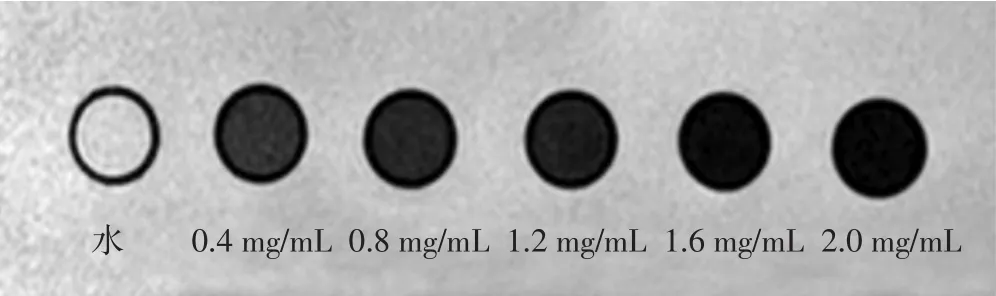
图5 EWVDV-PFH-Ink-Fe纳米粒磁共振扫描图
2.5 纳米粒对体外血栓靶向性 经过荧光显微镜绿光激发后,PFH-Ink-Fe组因为物理吸附作用,于血栓表面可见少量黄色荧光,EWVDV-PFH-Ink-Fe组可见大量荧光纳米粒连接于血栓表面,明显多于PFH-Ink-Fe组,表明多功能纳米粒对血栓有良好靶向性。为防止血栓切片变干,作者在部分切片上滴了少量双蒸水后,发现切片上的探针发生了相变,且进入血栓内部,见图6。

图6 靶向组纳米粒(EWVDV-PFH-Ink-Fe)及非靶向纳米粒(PFH-Ink-Fe)对体外血栓靶向性
3 讨 论
核磁共振成像分子影像学具有较高的组织分辨率、多参数、多方位成像等优点,可同时获得解剖及生理信息,本课题组前期通过磁共振分子成像技术实现了对血栓的靶向诊断及治疗研究[6-8],但磁共振扫描耗时较长,敏感度较低。超声分子影像作为分子影像学的一个重要分支,在近几年得以兴起和快速发展,但目前使用的超声微泡造影剂存在粒径大、稳定性差等不足;而单纯光声成像存在穿透力较弱等劣势。单一影像学成像模式已不能满足临床多样化和个体化需求,多种成像模式联合应用能够互补不足,更全面地提供血栓的病理生理学信息[9-12]。目前国内鲜有血栓多模态分子探针的报道。本研究联合超声、光声及磁共振成像技术,期望从分子水平上实现对血栓更全面的影像学表征。
在本研究纳米粒的超声成像研究中,经激光辐照后纳米粒的温度达到或高于60℃时,在B模式和对比模式下可获得令人满意的回声信号,而在60℃以下则未探测到明显的强回声,有学者认为激光辐照致相变的原理是纳米粒中的吸光物质吸收光的能量转化为热能,使纳米粒中的氟碳物质温度升高,发生相变[13]。本研究结果显示,激光辐照强度为0.930、1.294、1.730 W/cm2时,分子探针分别在120、70、40 s时达到60℃,而当激光辐照强度为0.444 W/cm2时,分子探针在实验时间内不能达到60℃。由此可以看出,为了获得令人满意的超声图像,激光照射强度和时间需要满足相应的要求,激光辐照时间越长,辐射强度越大,纳米粒温度越高,而回声信号越明显。激光辐照后纳米粒温度的明显升高也说明了纳米粒对激光能量有良好的吸收能力,这种优异的光吸收特性不仅有利于超声成像,还在光热疗领域具有很大的潜力。
Fe3O4和印度墨水均可用于光声成像[14-15],EWVDVPFH-Ink-Fe纳米粒在光声成像仪中可观测到红色光声信号,同时,Fe3O4也可用作磁共振对比剂,在纳米粒磁共振成像中,不同水平EWVDV-PFH-Ink-Fe纳米粒信号与双蒸水背景信号比较均有不同程度的降低,且随样品水平的增加,T2信号的降低越发明显,证实该纳米粒可有效降低T2信号,该结果与大量国内外研究一致[16-18],证实了纳米粒中的Fe应用于磁共振成像中具有优良的有效性及稳定性,这也归因于经油酸修饰的Fe3O4镶嵌于PLGA壳中,不会发生明显的突释现象。
在热致相变研究中,由于样品加热到设定温度需要一定时间,所以1 min图像的研究意义不大;而加热后期样品会被加热板烤干,相变纳米粒不稳定,所以选择条件稳定的时间(2~7 min)作为研究时间段。随着加热时间延长及加热温度的上升,发生相变的纳米粒数目越多且直径越大,这一规律有助于指导纳米粒在体内的应用,当纳米粒应用于体内时,需发生相变才能实现超声显像。但纳米粒相变后的粒径需控制在一定范围内,避免粒径过大引起血管阻塞,而这一结果为纳米粒的相变可控性提供了重要依据。然而体内环境复杂,纳米粒在体内的相变及超声成像待后期工作进一步探索。
文献研究显示,活化血小板表面同时高表达GPⅡb/Ⅲa受体和P-选择素[19]。前期研究利用RGDS/cRGD肽成功构建靶向血栓中激活血小板GPⅡb/Ⅲa受体的纳米粒,体内外实验显示其靶向性能良好[6-8],但是动脉中血液流速高,需要更强的靶向力以抵抗动脉血液的高剪切力,P-选择素是黏附分子选择素家族的重要成员,其主要表达在活化的血小板/内皮细胞表面,通过介导细胞初始黏附启动参与了包括白细胞的黏附迁移级联过程,选择素及其配体的靶向作用可以介导细胞滚动[20-21]。EWVDV肽对P-选择素有高度的亲和力,而不会靶向L-选择素和E-选择素,且比其他肽段、糖类物质及内源性配体二硫键连接的唾液黏蛋白二聚体-1(PSGL-1)的靶向性更强[22]。N 端修饰 GA 或羧酸(CA)的EWVDV对P-选择素的靶向能力最强,其靶向性可提高800多倍[22]。本研究体外靶向血栓实验证实,EWVDV-PFH-Ink-Fe纳米粒的靶向性能明显高于PFHFe,作者推测这正是由于EWVDV与P-选择素的靶向结合作用介导了纳米粒在血栓表面的黏附、滚动,使得纳米粒稳定地结合于血栓表面。在体外靶向血栓实验中,为了防止血栓切片变干,作者在部分切片上滴了少量双蒸水后,意外发现切片上的探针发生了相变,且进入血栓内部,作者认为这归因于印度墨水及Fe3O4吸收绿光能量后发生了光致相变作用,同样证明了探针具有优良的光吸收能力,且通过这种相变作用可以促使纳米粒向血栓内部渗透。目前多数血栓分子探针对血栓的靶向均富集于血栓表面[23-26],CHUNG等[24]的研究证实,其制备的探针可以向血栓内部渗透达300 μm。本研究中,借助相变作用,纳米粒可大量向血栓深部渗透,这为靶向溶栓效率的大幅提高奠定了基础。然而,这种相变介导的纳米粒向血栓深部渗透的机制还需要进一步研究。EWVDV-PFH-Ink-Fe纳米粒在体内的靶向及显影性能、代谢分布及安全性会在下一步进行详细验证。
[1]WENDELBOE AM,RASKOB GE.Global burden of thrombosis:epidemiologic aspects[J].Circ Res,2016,118(9):1340-1347.
[2]AY I,BLASI F,RIETZ TA,et al.In vivo molecular imaging of thrombosis and thrombolysis using a fibrin-binding positron emission tomographic probe[J].Circ Cardiovasc Imag,2014,7(4):697-705.
[3]REZAEIANPOUR S,BOZORGI AH,MOGHIMI A,et al.Synthesis and biological evaluation of cyclic[Tc-99m]-HYNIC-CGPRPPC as a Fibrin-Binding peptide for molecular imaging of thrombosis and its comparison with[Tc-99m]-HYNIC-GPRPP[J].Mol Imaging Biol,2017,19(2):256-264.
[4]TANG RB,CHAI WM,YAN FH,et al.Molecular evaluation of thrombosis using X-ray phase contrast imaging with microbubbles targeted to P-selectin in mice[J].Eur Radiol,2016,26(9):3253-3261.
[5]赵元平,胡广全,滕中华,等.环RGD多肽靶向微泡用于动脉血栓成像[J].中国医学影像技术,2013,29(6):857-861.
[6]ZHOU J,GUO DJ,ZHANG Y,et al.Construction and evaluation of Fe3O4-based PLGA nanoparticles carrying rtPA used in the detection of thrombosis and in targeted thrombolysis[J].ACS Appl Mater Interfaces,2014,6(8):5566-5576.
[7]LIU J,XU J,ZHOU J,et al.Fe3O4-based PLGA nanoparticles as Mr contrast agents for the detection of thrombosis[J].Int J Nanomedicine,2017,12(1):1113-1126.
[8]ZHANG Y,ZHOU J,GUO DJ,et al.Preparation and characterization of gadolinium-loaded PLGA particles surface modified with RGDS for the detection of thrombus[J].Int J Nanomedicine,2013,8(1):3745-3756.
[9]SONG YN,HUANG ZY,XU JF,et al.Multimodal SPION-CREKA peptide based agents for molecular imaging of microthrombus in a rat myocardial ischemia-reperfusion model[J].Biomaterials,2014,35(9):2961-2970.
[10]YOO SP,PINEDA F,BARRETT JC,et al.Gadolinium-functionalized peptide amphiphile micelles for multimodal imaging of atherosclerotic lesions[J].ACS omega,2016,1(5):996-1003.
[11]OLIVEIRA BL,BLASI F,RIETZ TA,et al.Multimodal molecular imaging reveals high target uptake and specificity of 111In-and 68Ga-Labeled Fibrin-Binding probes for thrombus detection in rats[J].J Nucl Med,2015,56(10):1587-1592.
[12]MCCARTHY JR,PATEL P,BOTNARU I,et al.Multimodal nanoagents for the detection of intravascular thrombi[J].Bioconjug Chem,2009,20(6):1251-1255.
[13]NIU C,WANG L,WANG Z,et al.Laser irradiated fluorescent perfluorocarbon microparticles in 2-D and 3-D breast cancer cell models[J].Scientific Reports,2017,7(1):43408.
[14]ZHOU P,ZHAO H,WANG Q,et al.Photoacoustic-enabled self-guidance in magnetic-hyperthermia Fe@Fe3O4 nanoparticles for theranostics in vivo[J].Advan Healthcare Mater,2018,7(9):e1701201.
[15]AVIGO C,LASCIO N,ARMANETTI P,et al.Organosilicon phantom for photoacoustic imaging[J].J Biomed Opt,2015,20(4):46008.
[16]TA HT,LI Z,HAGEMEYER CE,et al.Molecular imaging of activated platelets via antibody-targeted ultra-small Iron oxide nanoparticles displaying unique dual MRI contrast[J].Biomaterials,2017,134(1):31-42.
[17]YANG M,FAN QL,ZHANG RP,et al.Dragon fruit-like biocage as an Iron trapping nanoplatform for high efficiency targeted cancer multimodality imaging[J].Biomaterials,2015,69(1):30-37.
[18]SUZUKI M,BACHELET-VIOLETTE L,ROUZET F,et al.Ultrasmall superparamagnetic Iron oxide nanoparticles coated with fucoidan for molecular MRI of intraluminal thrombus[J].Nanomedicine,2015,10(1):73-87.
[19]STOETZER C,NICKEL K,WEIßIG A,et al.Olive oil-based lipid emulsions do not influence platelet receptor expression in comparison to medium and long chain triglycerides in vitro[J].Lipids,2016,51(11):1241-1248.
[20]KLOPOCKI AG,YAGO T,MEHTA P,et al.Replacing a lectin domain residue in L-selectin enhances binding to P-selectin glycoprotein ligand-1 but not to 6-sulfo-sialyl Lewis x[J]. J Biol Chem,2008,283(17):11493-11500.
[21]LINDNER J R.Contrast ultrasound molecular imaging of inflammation in cardiovascular disease[J].Cardiovasc Res,2009,84(2):182-189.
[22]APPELDOORN CC,MOLENAAR TJ,BONNEFOY A,et al.Rational optimization of a short human P-selectin-binding peptide leads to nanomolar affinity antagonists[J].J Biol Chem,2003,278(12):10201-10207.
[23]LI B,JUENET M,AID-LAUNAIS R,et al.Development of polymer microcapsules functionalized with fucoidan to target P-Selectin overexpressedincardiovasculardiseases[J].AdvHealthcMater,2017,6(4):1-5.
[24]CHUNG TW,WANG SS,TSAI WJ.Accelerating thrombolysis with chitosan-coated plasminogen activators encapsulated in poly-(lactide-coglycolide)(PLGA)nanoparticles[J].Biomaterials,2008,29(2):228-237.
[25]WEN AM,WANG YM,JIANG K,et al.Shaping bio-inspired nanotechnologies to target thrombosis for dual optical-magnetic resonance imaging[J].J Mater Chem B,2015,3(29):6037-6045.
[26]CICHA IWONA.Thrombosis:novel nanomedical concepts of diagnosis and treatment[J].World J Cardiol,2015,7(8):434-441.
