太行青山羊附睾头细胞系的建立
2018-05-25邰苗苗郭永娟任有蛇张春香
邰苗苗,郭永娟,任有蛇,张春香
(山西农业大学动物科技学院,太谷 030801)
上世纪动物细胞培养开始出现,现今已经成为医学及生物学中广泛采用的技术方法之一。对于附睾细胞的培养是在上世纪90年代初才逐渐被重视的[1]。目前,附睾细胞原代培养的方法主要有两种:一种方法是将无菌附睾剔除脂肪后,将组织块用胰蛋白酶消化,形成细胞团后,重悬于含5%胎牛血清的培养液[2];另外一种方法是胡向农等[1]报道的方法。无菌取出大鼠附睾,用眼科剪将组织剪成1~2mm3的小块,用胰蛋白酶和胶原酶I消化后,将收集后的细胞重悬于含10%胎牛血清的RPMI1640培养液中,在37℃、5%CO2条件下培养。然而,关于山羊附睾头细胞培养的研究报道还较少。因此,本试验拟在上述原代附睾细胞培养方法的基础上加以改进,实现对太行青山羊附睾头细胞原代培养和冻存,为山羊附睾特异表达蛋白功能的研究提供第一手材料。
1 材料与方法
1.1 材料
本试验选取15日龄太行青山羊公羔附睾头组织作为试验材料,试验动物选自山西农业大学动物科技学院试验基地。
1.2 主要试剂
细胞培养基DMEM/F12、无菌PBS、姬姆萨染液、胰蛋白酶购自博士德生物公司。Guava ViaCount Reagent、GuavaInstrument Cleaning Fluid购自北京强欣博瑞生物技术有限公司。秋水仙素购自TaKaRa公司。胎牛血清(Gibco)、胶原酶I及青霉素链霉素混合液(双抗)购自北京博雅宏兴科技发展有限公司。KCl、NaCl、冰醋酸、甲醇等常用试剂均购自康为世纪生物科技有限公司。二甲基亚砜(DMSO)购自北京索莱宝科技有限公司。
1.3 山羊附睾头组织的获取
选取15日龄公山羊,剪去阴囊周围羊毛,消毒阴囊及腹部皮肤,无菌去势,取出附睾和睾丸组织,用含双抗的温热无菌PBS冲洗,然后用无菌剪刀取下附睾头部组织并浸泡入37℃预热的含双抗无菌PBS中,尽快带回实验室。
1.4 附睾头细胞原代培养
采用酶消化培养法。用37℃预热的含双抗无菌PBS冲洗附睾头组织,去除被膜及血管,洗净血污。然后用眼科剪将附睾头组织剪成1mm3大小,移入离心管中,加入0.25%的胰蛋白酶5mL,37℃、80 r/min振荡30min。终止消化后离心5min,吸去上清,留沉淀。加入2mg/mL的胶原酶I3mL,37℃、80 r/min振荡60min。用200目细胞筛过滤,再用无血清细胞培养液洗涤2~3次,吸去上清。用0.22μm滤器过滤的含血清细胞培养液(88%DMEM/F12,10%胎牛血清,2%双抗)重悬细胞,移入25 cm2培养瓶中,37℃、5%CO2条件下培养。之后,在显微镜下观察细胞生长状况并根据细胞的生长代谢情况更换培养液。
1.5 附睾头细胞传代和冻存

图1 山羊附睾头细胞原代培养生长情况(100×)
当培养瓶中细胞汇合达到90%以上后弃掉旧液,用PBS洗涤2次;加入37℃预热的0.25%胰蛋白酶2mL,37℃消化3~5min,轻轻拍打,显微镜下观察,待细胞变圆、脱壁时,立即用含血清培养基终止消化。将细胞悬液吸出放入离心管中,离心去上清。传代的细胞加入含血清培养液重悬细胞,分别接种至2个培养瓶中,放入细胞培养箱中培养;冻存的细胞加入1mL细胞冷冻保护液(70%DMEM/F12,20%胎牛血清,10%DMSO)重悬细胞后,4℃放置 40min,-20℃放置 90min,-80℃放置过夜,投入液氮中。
1.6 附睾头细胞复苏
细胞复苏方法参照刘海涛等[3]所报道的弃去冻存液后换上新鲜的完全培养基。此后,根据细胞的生长代谢情况更换培养液,显微镜下观察细胞生长状况。
1.7 附睾头细胞生物学特性观察
1.7.1 形态学观察 每隔1天观察并记录附睾头上皮细胞生长状况。
1.7.2 生长曲线绘制 用传至第3代的附睾头细胞进行生长曲线的绘制。取附睾头细胞,用Guava EasyCyte进行计数,调整细胞浓度为1×105个/mL,接种于24孔培养板,每孔约50 000个细胞,放入培养箱中培养。每隔24小时用胰蛋白酶随机消化收集3个孔中的细胞,取细胞悬液50μL,加入450μLGuava ViaCountReagent,混匀,室温避光10min,用Guava EasyCyte进行计数,求平均值,连续记录8 d。依据试验数据,绘制生长曲线。24孔板其余孔每2天更换培养液一次。
1.7.3 染色体分析 按照常规方法进行染色体制片,姬姆萨染液染色后自然干燥,封片,油镜下观察并拍照。
2 结果与分析
2.1 山羊附睾头细胞原代培养结果
组织块消化后,细胞密度较大,细胞刚从组织块中消化分离出,体积较小,形态多呈圆形。原代培养1 d后,显微镜下观察,还存在部分细胞团,没有完全消化,细胞贴于培养瓶底壁,且均处于生长状态。培养2 d后,细胞生长状态很好,融合度达到90%以上,可以看出还有部分细胞团(图1)。
2.2 传代培养结果

图2 山羊附睾头细胞传代培养生长情况(100×)
附睾头细胞经过连续传代后,细胞生长状态仍良好,下图分别为原代细胞传至第1代和5代后第2天的细胞形态,可以看出细胞能够稳定地传代,大的细胞团明显消失,传代后的细胞能够保持原有的细胞形态,维持之前的生长速度,2 d左右细胞基本汇合。
2.3 山羊附睾头细胞复苏培养结果

图3 山羊附睾头细胞复苏后生长情况(100×)
山羊附睾头细胞经过冻存、复苏后,细胞生长状态仍良好,细胞形态与原代细胞形态相似,3 d左右细胞基本汇合(图3)。
2.4 山羊附睾头细胞生长曲线
根据每次记录的细胞数量,以培养天数为横坐标,细胞数量为纵坐标,绘制山羊附睾头细胞生长曲线(图4)。细胞接种第1天,细胞数量低于初始接种数量;从第2~3天开始,细胞进入对数生长期;从第5天开始,细胞生长速度减慢;从第6天开始,细胞进入平台期。结果表明,培养的山羊附睾头细胞生长趋势整体呈“S”型,符合细胞生长规律。
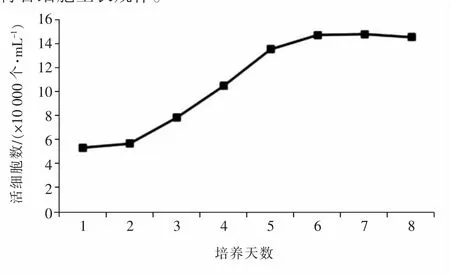
图4 山羊附睾头细胞生长曲线
2.5 染色体分析结果
对山羊附睾头的传代细胞进行染色体数目分析(图5)。结果表明,山羊附睾头细胞的染色体数目为2n=60,说明山羊附睾头细胞经过传代后染色体数目正常,细胞状态良好。

图5 山羊附睾头细胞染色体(400×)
3 讨论
附睾结构和功能分成若干段不同的区域性管腔环境,附睾在胎儿刚出生的时候是不成熟的,上皮细胞在出生后的一段时间内才能获得完全分化的表型[4]。郭丽娜等[5]在对山羊附睾特异蛋白β防御素104a定位时发现,7日龄的山羊附睾头上皮细胞未分化,而60日龄的上皮细胞开始出现明显的分化,细胞呈杆柱状,游离端出现少量短而粗的微纤毛,管腔增大。本试验采用的15日龄的山羊附睾头组织并未分化出上皮细胞,是以低柱状细胞存在,故而没有对细胞进行区分,保留了所有附睾头组织的贴壁细胞。
动物细胞原代培养主要有组织块贴壁法和胰蛋白酶消化法[6]。范晓梅等[7]在对绒山羊附睾上皮细胞培养的过程中发现,两种方法得到的细胞形态无差别,界限清晰,具有良好的分化能力。而组织块消化法建立细胞系周期较长,相同时间内获得的细胞数少于胰蛋白酶消化法。采用胰蛋白酶消化法改进后对原代细胞进行获取,采用37℃恒温振荡、分阶段胰蛋白酶和I型胶原酶消化法,既减少了传统酶消化法每隔一段时间需要进行震荡的步骤,又避免了酶消化时间过长对细胞造成的伤害,提高了酶的消化率和细胞的产出量[8]。胡向农等[1]和范晓梅等[7]建立附睾上皮细胞系时使用的基础培养基为RPMI1640培养基,但由于RPMI1640不含无机盐和次黄嘌呤等物质,可能会导致细胞生长缓慢[9],故本研究选用了营养丰富的DMEM/F12培养基作为细胞基础培养基,试验结果证明细胞生长状态良好,2~3 d基本融合。原代细胞培养最关键的部分就是如何避免细胞污染:从手术去势开始,所有使用的器械均高温高压灭菌后再使用,采取附睾头组织的刀片和剪刀均经过无菌处理,提前准备好添加了青链霉素的温热PBS冲洗组织,培养基中也添加了青链霉素混合液,组织块的剪切和细胞过滤等试验均在超净台操作,这样可以确保每个环节都能够减少细菌侵染细胞的机会,做到无菌培养。
一般的形态学观察之外,本试验还通过细胞连续传代,冻存和复苏,生长曲线测定以及细胞染色体分析等方面进行了细胞的生物学验证,传代细胞贴壁较快,呈“S”型曲线增长,复苏后死细胞较少,能够快速生长起来并且传代,细胞的染色体数目正常,状态良好,具有正常的生长速率和核型,呈现接触抑制和锚定依赖性[2]。
4 结论
本研究成功建立了太行青山羊附睾头细胞系,并对其进行了生长曲线测定和细胞染色体分析等生物学验证。应用本研究所建立的太行青山羊附睾头细胞培养体系可以在体外保持其原形态特征近1个月。表明,此研究所建立的方法适合太行青山羊附睾头细胞的生长。
[1] 胡向农,张忠林,杨建军.大鼠附睾上皮细胞的体外培养与研究[J].南京铁道医学院学报,1999(1):3-5.
[2] 石慧,李建远.附睾上皮细胞体外培养模式综述[J].中外医学研究,2011(9):120-121.
[3] 刘海涛,舒端阳.动物细胞培养问题研究[J].实验教学与仪器,2017(Z1):86-87.
[4] Breton S,Ruan Y C,Park Y J,etal.Regulation of epithelial function,differentiation,and remodeling in the epididymis[J].Asian JAndrol,2016,18(1):3-9.
[5] 郭丽娜,张国林,任有蛇,等.β防御素104a在不同日龄雄性山羊睾丸与附睾中的定位及表达特性[J].山西农业大学学报(自然科学版),2017(12):866-871.
[6] 马红.大白猪仔猪皮肤成纤维细胞系建立及生物学特征[J].华北农学报,2009(S1):96-98.
[7] 范晓梅,张通,栗瑞兰,等.绒山羊附睾上皮细胞培养方法的建立及其生长特性[J].畜牧兽医学报,2017(7):1212-1220.
[8] 杨森,冯付明,王银辉.乳兔成骨细胞原代培养与鉴定:改良胶原酶与胰酶的分段消化[J].中国组织工程研究,2014(38):6129-6135.
[9] 陈东风,刘为纹,房殿春,等.人胆囊上皮细胞的分离、培养及鉴定[J].第三军医大学学报,2001(9):1109-1111.
