不同连翘叶炮制品抑制胰脂肪酶活性比较
2018-05-21周菲胡荣刘晨杰张婉莹陈廷贵张立伟
周菲,胡荣,刘晨杰,张婉莹,陈廷贵,张立伟
(山西大学 分子科学研究所,山西 太原 030006)
0 引言
随着人们生活水平的提高,肥胖已经成为一个全球性公共健康问题。据统计,目前全球已有15亿超重患者和5亿肥胖患者,且肥胖所带来的负面影响已经超过酗酒和吸烟[1]。2013年6月,美国医学协会正式将肥胖视作一种疾病[2]。过度肥胖会导致许多相关疾病,如Ⅱ型糖尿病、心血管疾病、胆囊疾病、骨关节炎、阻塞性睡眠呼吸暂停以及癌症[3]。
胰脂肪酶(pancreatic lipase,PL)是由胰腺合成并分泌,是水解膳食脂肪最主要的酶,它负责50%~70%膳食脂肪的分解和消化[4],食物中的脂肪被PL水解为单酰甘油和游离脂肪酸后,在肠道被吸收,然后在体内重新合成脂肪,造成脂肪堆积,最终可导致肥胖[5]。如果有有效物质阻断PL对脂肪的分解,机体对脂肪的吸收就会减少,从而可以预防肥胖或减轻肥胖患者体重。近年来,由于天然产物具有来源广、成本低、副作用小等特点,得到人们越来越多的关注。对天然产物中PL抑制剂的研究也甚为广泛,如荷叶[6]、黄芩[7]、荞麦[8]等。
连翘(Forsythiasuspensa(Thunb.) Vahl)为木犀科连翘属植物,分布于中国、韩国和日本等国[9]。我国山西、河南、陕西、河北等地均有分布。在民间,人们常采集连翘嫩叶加工为保健茶饮用。连翘果实为一年一结,易受气候等因素影响,而连翘叶资源丰富,且受气候等条件影响较小,因而越来越多的学者开始注重连翘叶研究。连翘叶主要成分与连翘相似,都包含苷类、黄酮类、苯乙醇类、木脂素类等[10],具有保肝、护心、抑菌、抗氧化及抗衰老等作用[9-14]。2004年,侯改霞等发现连翘叶提取物具有降血脂作用[11]。本实验室前期研究表明,连翘叶中含有多种抑制PL活性成分,具有减肥可能性[15]。
中草药通过炮制可消除或降低药物毒副作用、改变药性、提高疗效。连翘叶进行炮制,可使连翘叶中植物酶失活,使其有效成分不被水解,从而大大提高其药用价值,但何种炮制方法可使连翘叶抑制PL活性更高呢?本实验采用4种不同方法对连翘叶进行炮制,然后经40%乙醇提取后比较粗提物抑制PL活性大小,再经HPLC检测、混合标品比对、标准曲线绘制,对其粗提物进行定性和定量分析,并通过相关分析,最终确定不同连翘叶炮制品抑酶活性差异产生原因。
1 实验材料与仪器
连翘叶,采于山西大学校园内,经鉴定为木樨科植物连翘的叶子;PL、三羟甲基氨基甲烷(Tris)购自北京Solarbio;2,4-二硝基苯酚丁酸酯(PNPB)购自Sigma-Aldrich;二甲基亚砜(DMSO)购于天津市富宇精细化工有限公司;标准品绿原酸、咖啡酸、连翘酯苷A、芦丁、橙皮苷、牛蒡子苷元、连翘苷、山柰酚3-O-芸香糖苷、连翘脂素均购自上海源叶生物科技有限公司;甲醇为色谱纯,水为纯净水,其他试剂均为分析纯。
GZX-9070 MBE数显鼓风干燥箱,上海博迅实业有限公司医疗设备厂;SENCO R50旋转蒸发仪,上海申生科技仪器有限公司;SHZ-C 型循环水式多用真空泵,巩义市英峪予华仪器厂;Scientz-12N 真空冷冻干燥机,宁波新芝生物科技股份有限公司;SpectraMax190 酶标仪,美国 Molecular Devices 公司;DELTA 320 pH 计,梅特勒-托利多仪器有限公司;Agilent 1200 型高效液相色谱仪,美国 Agilent 公司;C18 色谱柱(4.6mm×250mm, 5μm),Thermo Scientific 科技中国公司。
2 实验方法
2.1 四种连翘叶炮制品的制备
前期研究表明,连翘叶无水乙醇提取物抑制PL活性最高,但鉴于大规模生产时的成本,以及无水乙醇提取时相应叶绿素含量也增多,进而需用石油醚去除叶绿素等带来的繁琐工艺,本文选用体积分数40%乙醇进行提取。具体流程见下:

2.2 抑酶活性测定
2.2.1 Tris-HCl缓冲溶液的配制
精确称取6.057 g Tris-HCl,再用HCl将溶液调到pH=8.0,用蒸馏水定容至500 mL。
2.2.2 连翘叶粗提取物溶液的配制
准确称取干燥连翘叶提取物0.1 g于1.5 mL离心管中,溶于1 mL DMSO溶液中,充分溶解后得1 mL 0.1 g/mL连翘提取物的母液,实验时在反应体系中加入20μL连翘叶提取物溶液,得浓度为2 000 μg/mL粗提物溶液。
2.2.3 PL溶液的配制
准确称取5 mg PL,溶于10 mLTris-HCl(pH=8.0)缓冲液,振荡,充分溶解,即得0.5 mg/mL PL溶液。现配现用。
2.2.4 PNPB溶液的配制
准确移取PNPB 11 μL,加5 mL乙腈,即得浓度为12 mmol PNPB溶液,作为底物。
2.2.5 PL活力检测
准确移取100 μL PL溶液于1.5 mL离心管中,加入20 μL连翘叶粗提物溶液,用Tris-HCl缓冲液定容至900 μL,充分摇匀。反应体系中以不加入酶溶液作为空白,以不加入粗提物作为正常组。分别点入96孔板,每个溶液设4个复孔,37℃下孵育15 min,立即加入20 μL PNPB溶液,用酶标仪进行检测。检测波长为400 nm,每3 min 测定一个点,测定15 min,记录数据,计算吸光度随时间的变化率K。根据如下公式计算抑制率。每个反应重复三次。
抑制率(%)=(K正常组-K实验组)/K正常组×100%
2.2.6 各炮制品醇提物HPLC分析
取50 mg连翘叶粗提物于1.5 mL离心管中,加入1 mL 40% 乙醇溶液振荡混匀,用针筒式滤膜过滤器将溶液过滤到玻璃瓶中,进行HPLC分析。
HPLC检测条件:用C18色谱柱进行分离,检测波长270 nm柱温25℃,流速0.8 mL/min,流动相为甲醇(A)和0.3%醋酸水溶液(B),梯度洗脱:0~8 min,30%~33%A;8~24 min,33%~40% A;24~39 min,40%~48%A;3 955 min,48%~64% A。
3 结果与讨论
3.1 连翘叶不同炮制品重量变化与40%乙醇提取结果
结果见表1。从表中可看出,自然阴干后炮制品干重最大,这主要是由于阴干不会使任何成分丢失,而烘干可使叶表面蜡质受热而减少,叶内挥发性成分减少,煮和蒸时,由于叶与水接触,可使叶中部分成分流失(包括亲水性的次级代谢产物、蛋白及糖类等)。从表中还可看出,自然阴干炮制品提取率也最高,这主要是本实验提取时间较长,且提取两次,凡可提取出的成分大多已提取完毕,而煮、蒸和烘干在炮制过程中的成分损失,造成该三种炮制品在提取时提取率降低。

表1 连翘叶不同炮制品重量变化与40%乙醇提取结果Table 1 Weight changes of different processed F. suspensa leaves and results after 40% ethanol extraction
3.2 不同炮制品提取物抑制PL活性测定
结果见图1。可以看出,不同炮制品抑制PL活性从高到低依次为烘干炮制品、煮后阴干炮制品、蒸后阴干炮制品和自然阴干炮制品。这是由于烘干时植物酶完全失活,抑制PL活性成分不被分解,使得抑制PL活性最高。煮后阴干时,连翘叶受热均匀,植物酶也完全失活,有效成分未被降解,虽然有较多有效成分会随水分流失,但抑制PL活性仍较高。蒸后阴干时上、中和下层连翘叶受热不匀,连翘叶植物酶部分失活,进而造成抑制PL活性成分有所降解,同时还有少量有效成分会随水分流失,而阴干炮制品虽成分未流失,但由于植物酶完全未失活,有效成分降解较多,最终导致自然阴干和蒸后阴干生物活性接近,抑酶活性都较低。总之,植物酶失活与否影响最大,有效成分挥发或随水分流失影响次之。
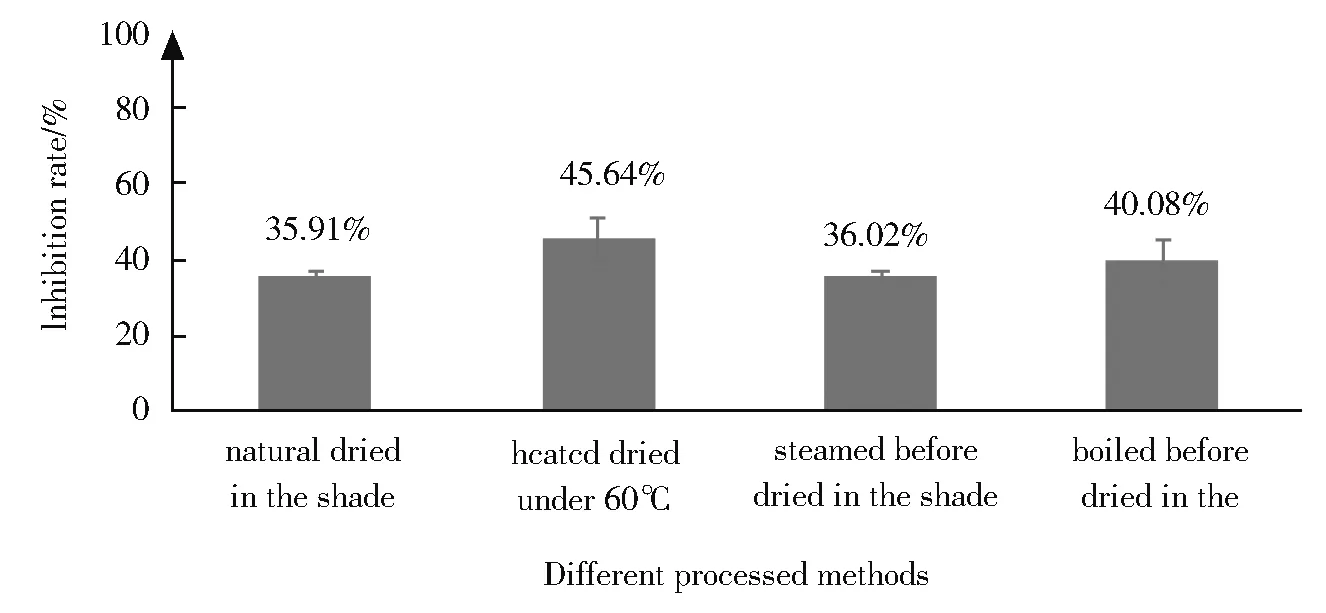
Fig.1 Comparison of inhibitive rateof alcohol extracts from different processed products of F. suspensa leaves on PL图1 连翘叶不同炮制品乙醇提取物抑制PL活性比较
3.3 各炮制品醇提物HPLC分析
3.3.1 HPLC定性分析
与混合标准品进行比对,不同炮制品醇提物中各成分指纹图谱见图2。
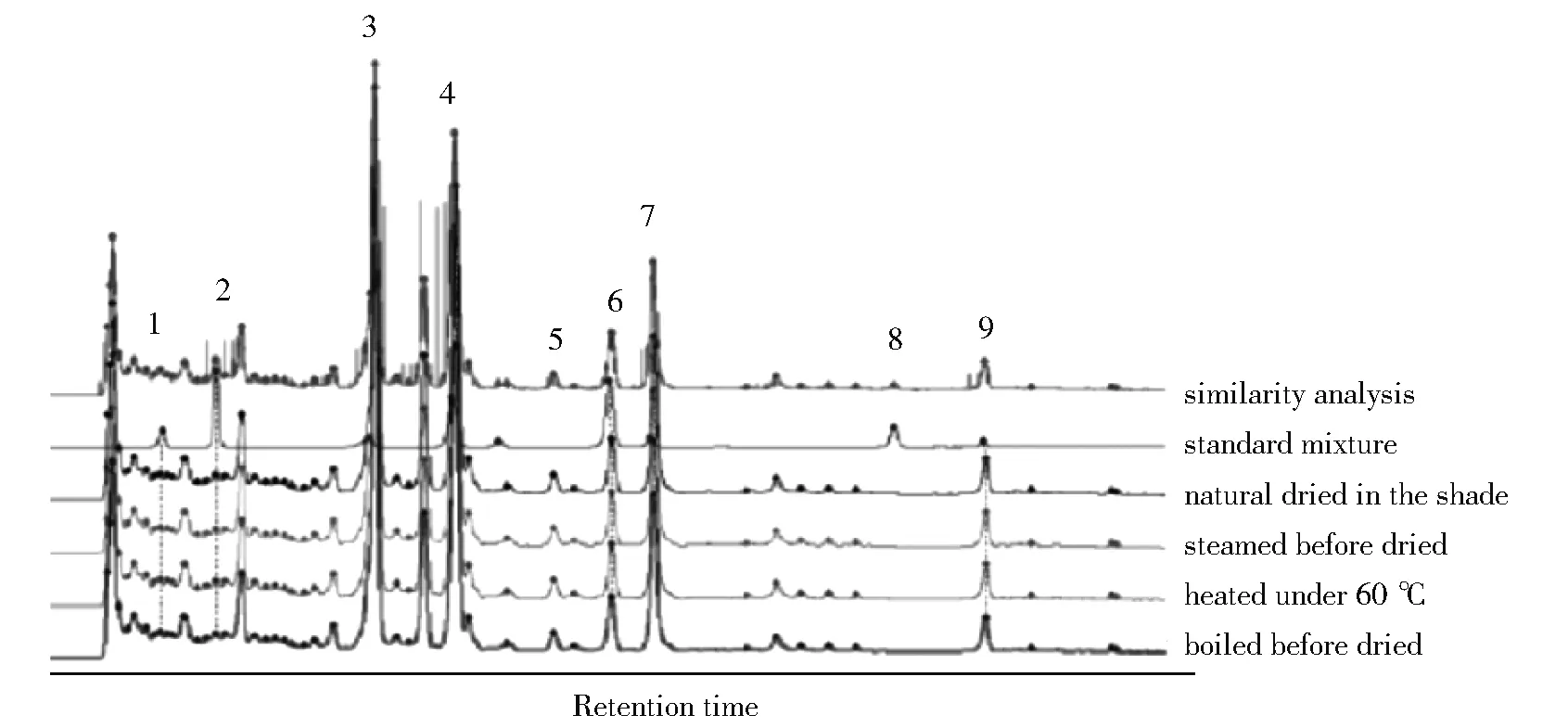
1.chlorogenic acid; 2. caffeic acid; 3. forsythiaside A; 4. rutin; 5. hesperidin;6. kaempferol-3-O-rutinoside; 7. phillyrin; 8. arctigenin; 9.phillygenin;Fig.2 HPLC chromatograms of different processed samples and standard mixture图2 不同炮制品醇提物以及混合标品指纹图谱
从图2可看出:连翘叶各炮制品中包含有绿原酸、咖啡酸、连翘酯苷A、卢丁、橙皮苷、山柰酚-3-O-芸香糖苷、连翘苷和连翘脂素,未检测到牛蒡子苷元。
3.3.2 HPLC定量分析
以各标准品浓度为横坐标,HPLC峰面积为纵坐标绘制标准曲线,如表2所示。
从表2可看出,各标准曲线线性良好。依据各标准品标准曲线,不同月份连翘叶中各成分含量见表3。
从表中可看出,四种炮制品中含量差异最大的为连翘苷和连翘酯素,连翘苷最高含量是最低含量的3.55倍,连翘酯素为3.81倍。这主要是由于连翘苷易被氧化[16],在采用电热鼓风烘箱烘干连翘叶时,连翘苷更是损失最大,而连翘苷对PL起促进作用,连翘苷的减少意味着烘干连翘叶炮制品抑制PL活性的增加。连翘酯素虽对PL活性几乎无影响,但含量变化原因有待于后续进一步研究。

表2 各标准品含量测定标准曲线Table 2 Standard curves of each standard substance
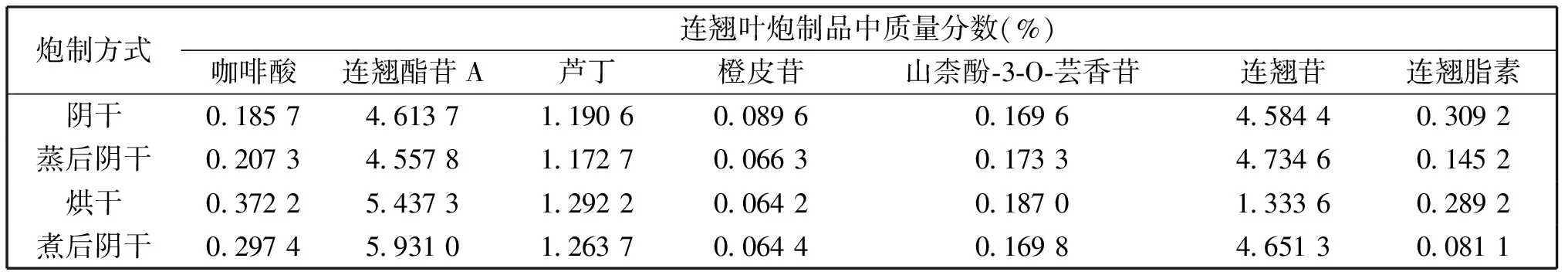
表3 连翘叶不同炮制品中各成分含量Table 3 Component contents of different processed products of F. suspensaleaves
3.4 各标准品对PL的IC50测定
各标准品IC50测定结果见图3。
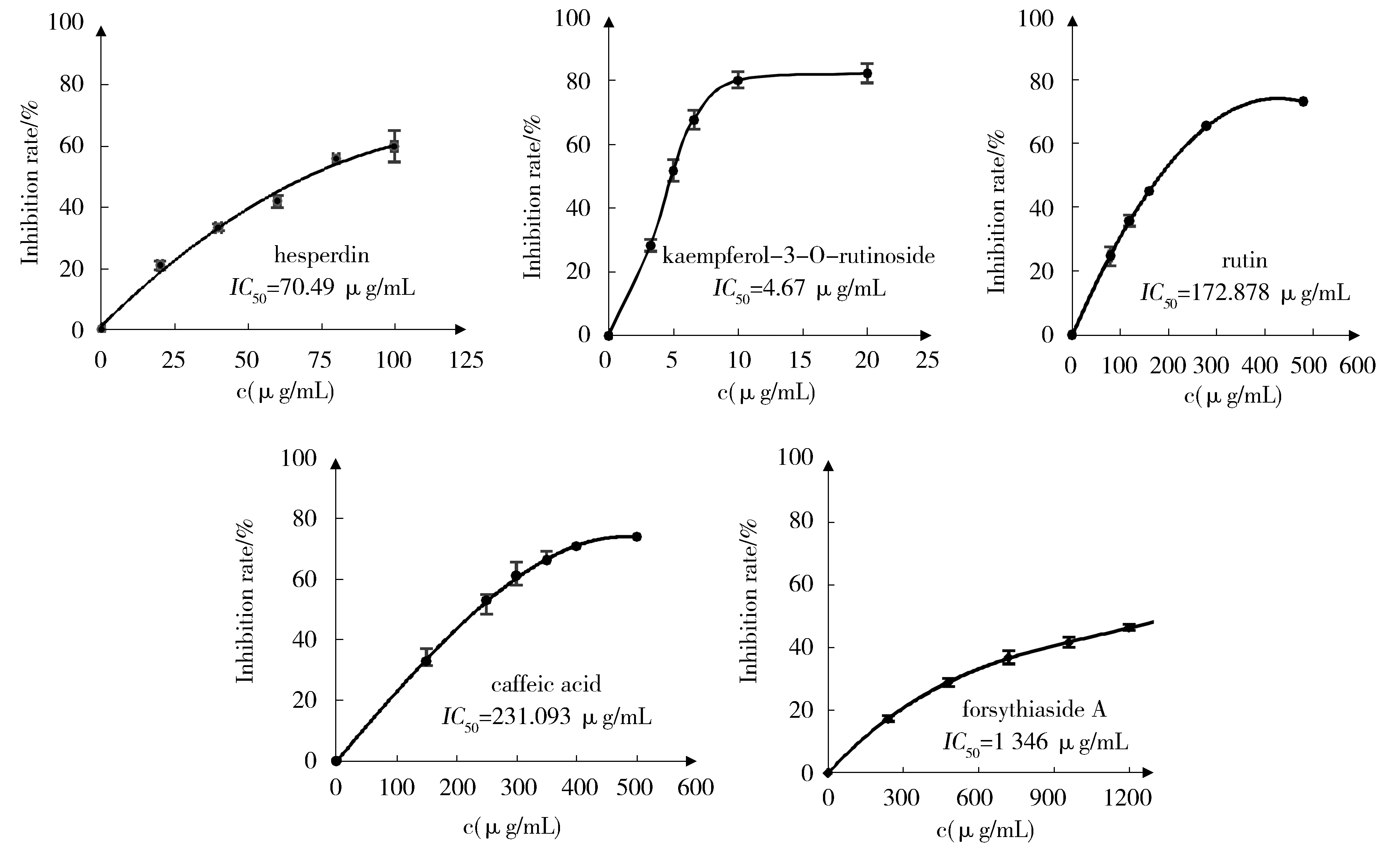
Fig.3 IC50 of five standard substances on pancreatic lipase图3 各标准品对PL抑制的IC50曲线
从图中可看出,各成分对PL抑制活性依次为:山柰酚-3-O-芸香糖苷>橙皮苷>芦丁>咖啡酸>连翘酯苷A。连翘苷对PL表现为促进作用,而连翘脂素对PL几乎没有抑制作用,图略。
各炮制品提取物抑酶活性与指认的各成分含量进行相关性分析,结果见表4。
从表中可看出,咖啡酸、芦丁和连翘苷含量与各炮制品醇提物抑制PL活性相关系数绝对值均在0.9以上,表明该三种成分的含量对连翘叶炮制品抑酶活性有较大影响。其中,咖啡酸和芦丁相关系数为正值,表明炮制品中咖啡酸和芦丁含量越大,炮制品抑酶活性越大;相反,连翘苷相关系数为负,表明炮制品中连翘苷含量越大,炮制品对PL抑制作用越小。连翘脂素相关系数最小,表明连翘脂素含量与炮制品抑酶活性无明显相关性,这与连翘脂素几乎没有抑制PL活性相吻合。
总之,炮制方式影响中草药各成分含量及药效机制非常复杂,本文综合上述各实验结果,浅析如下:阴干和蒸后阴干时,由于植物酶未失活或未完全失活,连翘叶中主要抑制PL活性成分咖啡酸和芦丁含量较低,而促进PL活性的连翘苷含量较高,因此,两种炮制品抑制PL活性均较低。煮后阴干连翘叶中由于连翘苷在高温时较稳定[16],其含量与前两种炮制品相近,但植物酶完全失活,咖啡酸和芦丁含量有所增多,因此该炮制品抑制PL活性较阴干和蒸后阴干炮制品有所升高。烘干炮制品中,植物酶完全失活,咖啡酸和芦丁含量较高,又由于促PL作用连翘苷易氧化,含量大幅降低,两因素共同导致烘干炮制品抑制PL活性最高。
4 结论
本论文以连翘叶为研究对象,经不同方法进行炮制后,比较其抑制PL活性,然后通过定性、定量和相关性分析分析产生差异的原因。
(1)各炮制品中,自然阴干干重最大,水煮后阴干干重最小。
(2)各炮制品中,阴干炮制品40%乙醇提取率最高,烘干最低。
(3)各炮制品中,烘干连翘叶抑制PL活性>煮后阴干>蒸后阴干>自然阴干。
(4)各炮制品中,都包含有绿原酸、咖啡酸、连翘酯苷A、芦丁、橙皮苷、山柰酚-3-O-芸香糖苷、连翘苷、连翘脂素八种成分。
(5)各炮制品中,连翘酯苷A和连翘苷含量最高,芦丁次之,咖啡酸、绿原酸、橙皮苷、山柰酚-3-O-芸香糖苷、连翘脂素含量相对较低。
(6)各成分中,山柰酚-3-O-芸香糖苷抑酶活性最高,连翘酯苷A活性最低,连翘脂素基本无抑酶活性,而连翘苷对PL有促进作用。
(7)连翘叶炮制品中,对其抑制PL活性影响最大成分为咖啡酸、芦丁和连翘苷。其中咖啡酸和芦丁含量与抑酶活性呈正相关,而连翘苷含量与抑酶活性呈负相关。
(8)总之,四种炮制品抑制PL活性差异是由植物酶失活与否和连翘苷氧化与否两因素共同决定。烘干时植物酶完全失活,该炮制品较其他三种炮制品,抑PL成分咖啡酸、芦丁含量较多,而促PL成分连翘苷60℃且鼓风烘干时易氧化而使含量显著降低,两因素共同导致烘干连翘叶炮制品具有最高抑酶活性。
参考文献:
[1] Wang Y C,Mcpherson K,Marsh T,etal.Health and Economic Burden of the Projected Obesity Trends in the USA and the UK[J].Lancet,2011,378(9793):815-825.DOI:10.1016/S0140-6736(11)60814-3.
[2] American Medical Association.AMA Adopts New Policies on Second Day of Voting at Annual Meetingeeting[EB/OL].(2013-06-18).http:∥www.ama-assn.org/ama/pub/news/news/2013/2013-06-18-new-ama-policies-annual-meeting.
[3] Haslam D W,James W P.Obesity[J].Lancet,2005,366:1197-1209.DOI:10.1016/S0140-6736(05)67483-1.
[4] 刘蕊,郑毅男.人参(西洋参)抑制胰脂肪酶活性及其抗肥胖作用[J].人参研究,2010,23(1):14-19.DOI:10.3969/j.issn.1671-1521.2010.01.004.
[5] Chiesi M,Huppertz C,Hofbauer K G.Pharmacotherapy of Obesity,Targets and Perspectives[J].TrendsinPharmacologicalSciences,2001,22:247-254.DOI:10.1016/S0165-6147(00)01664-3.
[6] 霍世欣,周陶忆,司晓晶,等.荷叶黄酮化合物对胰脂肪酶抑制的研究[J].天然产物研究与开发,2008,20:328-331.DOI:10.3969/j.issn.1001-6880.2008.02.034.
[7] 尹瑞卿,丁玉,陈明达,等.黄芩苷对胰脂肪酶的抑制机理研究[J].安徽农业科学,2009,37(24):11534-11536.DOI:10.3969/j.issn.0517-6611.2009.24.078.
[8] 霍世欣,周陶忆,司晓晶,等.荞麦黄铜和荞麦糖醇对胰脂肪酶的抑制作用[J].食品科学,2015,36(11):60-63.DOI:10.7506/spkx1002-6630-201511012.
[9] Lee S E,Lim C,Kim H,etal.A Study of the Anti-Inflammatory Effects of the Ethyl Acetate Fraction of the Methanol Extract of ForsythiaeFructus[J].AfricanJournalofTraditionalComplementary&AlternativeMedicinesAjtcam,2016,13(5):102-113.DOI:10.21010/aitcam.v13i5.14.
[10] Jia J P,Zhang F S,Li Z Y,etal.Comparison of Fruits of Forsythia suspensaat Two Different Maturation Stages by NMR Based Metabolomics[J].Molecules,2015,20:10065-10091.DOI:10.3390/molecules200610065.
[11] 侯改霞.连翘叶提取物的降血脂和抗疲劳作用研究[D].西安:陕西师范大学,2004.
[12] 杨建雄,刘静.连翘叶茶保肝作用的实验研究[J].陕西师范大学学报,2005,33(3):82-85.DOI:10.15983/j.cnki.jsnu.2005.03.024.
[13] 牛新华,邱世翠,邸大琳,等.连翘体外抑菌作用的研究[J].时珍国医国药,2002,13(6):342-343.DOI:10.3969/j.issn.1008-0805.2002.06.010.
[14] 杨建雄,杨晨,邱娟,等.连翘叶黄酮的体外抗氧化作用[J].天然产物研究与开发,2007,19:97-100.DOI:10.3969/j.issn.1001-6880.2007.01.025.
[15] Chen T G,Li Y Y,Zhang L W.Nine Different Chemical Species and ActionMechanisms of Pancreatic Lipase Ligands Screened Out from Forsythia suspensa Leaves All at One Time[J].Molecules,2017,22(5):795:1-11.DOI:10.3390/molecules22050795.
[16] 刘许媛,寇立超,寇随林,等.感冒退热颗粒中连翘苷稳定性的研究[J].中成药,2010,32(1):149-151.DOI:10.3969/j.issn.1001-1528.2010.01.048.
