芦竹根总生物碱提取工艺优选的正交试验设计△
2018-05-21李文超梁启超巩丽虹倪丹蓉汪洋冯林旭张朝立高长久
李文超,梁启超,巩丽虹,倪丹蓉,汪洋,冯林旭,张朝立,高长久*
(1.牡丹江医学院 药学院,黑龙江 牡丹江 157011;2.焦作市人民医院,河南 焦作 454150)
芦竹根Arundo Donax Rhizoma[1],又名芦荻头、楼梯杆,为禾本科芦竹属植物芦竹ArundodonaxL.的新鲜或干燥根茎,其入药首载于《岭南采药录》。芦竹为芦竹根的原植物,又名荻芦竹(《本草汇言》)、绿竹(《分类草药性》),是一种全球分布较广的植物,其资源丰富,广泛分布于亚洲、欧洲南部、非洲北部以及中东地区。我国主要分布于西南、华南及江苏、浙江、湖南等地。我国芦竹多用于造纸工业[2]。芦竹在欧洲与印度等地被用作结瘢剂、止血药、回乳剂、止泻药、利尿药,或用于治疗牙疼、支气管炎等[3-6],药用价值显著。
芦竹根微苦、味甘,性寒,具有清热泻火、止呕生津、利尿通淋的功能[7],主治热病发狂、虚劳骨蒸、小便不利、淋病、风火牙痛等症。临床上主要用于治疗小儿上呼吸道感染引起的高热症,疗效确切,为中药制剂芦黄冲剂和去感热注射液的主要原料药材。芦竹根主要化学成分为多种吲哚类生物碱,有降压解痉作用,能拮抗组织胺、5-羟色胺、乙酰胆碱引起的痉挛[8-9]。因此,芦竹根有较好的药用开发价值。目前,国内外主要报道了芦竹根中生物碱的提取分离、结构分析[10-12]等研究。K.A.Ubaidullaev等[13]对塔吉克斯坦的Shaartuz地区的芦竹根地上部分采用三氯甲烷进行提取,反复氧化铝柱层析分离得到3种吲哚类生物碱donaxine、donaxaridine和donaxarine,经红外光谱法、紫外光谱、质谱和核磁共振法对donaxaridine和donaxarine结构进行确定。V.U.Khuzhaev等[14]对乌兹别克斯坦首都塔什干科学院植物园内的芦竹根采用三氯甲烷提取,同样氧化铝柱层析发现了之前得到的双吲哚生物碱arundine(donaxine),并采用红外光谱法、紫外光谱、质谱和核磁共振法对其结构进行确定,同时对其进行了合成。我国对芦竹根的药用研究一直滞后于国外,急需对其进行系统而深入的研究。2016年,刘清茹等[15]对芦竹根的化学成分进行系统研究,采用不同色谱技术和重结晶等方法分离纯化湖南浏阳产芦竹根化学成分,并通过理化性质和波谱数据鉴定化合物结构。从其70%乙醇提取物中分离得到23个化合物。本实验研究芦竹根总生物碱的提取工艺,以期提高实际生产中的产率问题,为其市场开发创造条件。
1 仪器与材料
1.1 仪器
Cary100双光束紫外-可见分光光度仪(美国瓦里安公司);AX200型电子天平(日本岛津);R205型旋转蒸发仪(上海申胜生物科技有限公司)。
1.2 材料
芦竹根药材购自四川省成都市,经牡丹江市牡丹江医学院药学院高长久老师鉴定为芦竹的根。
芦竹碱对照品(沃凯,纯度>97%,国药集团化学试剂有限公司,批号:20130419);乙醇、三氯甲烷、氢氧化钠、盐酸、浓氨水(均市售分析纯)。
2 方法与结果
2.1 芦竹根药材中总生物碱的含量测定
2.1.1 对照品储备液的制备 取芦竹碱对照品约50 mg,精密称定,置250 mL量瓶中,加入乙醇至刻度,摇匀,得到质量浓度为0.198 mg·mL-1对照品储备液。
2.1.2 测定波长的选择 以乙醇为空白对照,将对照品溶液、样品供试液和空白对照液在200~700 nm波长范围内进行扫描。结果显示,前两者在210 nm和280 nm左右均有最大吸收,且在280 nm处吸收峰峰形较好,空白对照液在280 nm处几乎没有吸收,故本实验选择280 nm为测定波长,结果见图1。
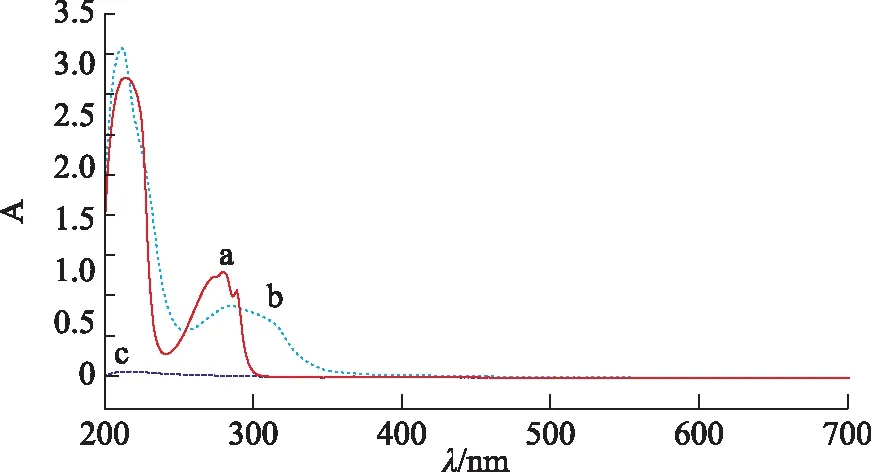
注:a.芦竹碱对照品;b.供试品;c.空白溶液。图1 波长扫描图
2.1.3 标准曲线的制备 分别精密量取对照品储备液0.1、0.2、0.4、0.6、0.8、1.0、1.2、1.4 mL于10 mL容量瓶,乙醇定容至刻度。以乙醇为空白于280 nm测定吸光度值。以芦竹碱对照品浓度为横坐标,吸光度值为纵坐标,计算得回归方程:Y=0.002 66+36.147 72X,r=0.999 9(n=8),芦竹碱在0.02~0.28 mg·mL-1与吸光度值呈良好的线性关系。
2.2 总生物碱的提取
将芦竹根药材粗粉100 g,加水浸泡2 h,煎煮1 h,纱布过滤,药渣再煎煮一次。合并水煎液并浓缩,用乙醇调至含醇80%进行醇沉,静置,过夜。抽滤,滤液浓缩以回收乙醇。醇浸膏用浓氨水碱化至pH 10以上,用三氯甲烷萃取2~3次。合并三氯甲烷层并将三氯甲烷层移入250 mL容量瓶中,加三氯甲烷至刻度,摇匀,即得供试液。吸取供试液5.0 mL于干燥的250 mL容量瓶中,加无水乙醇至刻度,摇匀,以无水乙醇为参比,在280 nm处测定吸光度。
2.3 总生物碱含量的测定
精密量取不同批次芦竹根总生物碱提取物3份,按2.1.1的方法制备样品溶液和空白对照液,在280 nm处分别测定吸光度并计算其总生物碱平均含量。
2.4 总生物碱提取的单因素试验考察
2.4.1 含醇量的确定 称取100 g粗粉,每次煎煮1 h,7倍液量,煎煮2次,过滤,收集滤液。将总滤液分成6等份浓缩,分别使溶液含醇量至90%、80%、70%、60%、40%、30%,制得供试品溶液。定容25 mL容量瓶中,精密量取0.15 mL样品溶液,移至25 mL比色管中,无水乙醇定容,摇匀。在280 nm波长处测定吸光度值。
2.4.2 提取时间的确定 称取100 g粗粉6份,煎煮2次,7倍液量,含醇量80%,分别煎煮0.5、1.0、1.5、2.0、2.5、3.0 h共制得供试品溶液6份。定容25 mL容量瓶中,精密量取0.15 mL样品溶液,移至25 mL比色管中,无水乙醇定容,摇匀。在280 nm波长处测定吸光度值。
2.4.3 提取次数的确定 称取100 g粗粉,每次煎煮1 h,7倍液量,含醇量80%,煎煮1次后,连续煎煮上次滤渣,煎煮4次,制得供试品溶液。定容25 mL容量瓶中,精密量取0.15 mL样品溶液,移至25 mL比色管中,无水乙醇定容,摇匀。在280 nm波长处测定吸光度值。
2.4.4 提取液体积的确定 称取100 g粗粉5份,每次煎煮1 h,煎煮2次,含醇量80%,分别在提取液体积5倍、6倍、7倍、8倍、9倍(如500 mL一定浓度的乙醇每100 g药材)条件下,制得样品溶液。定容25 mL容量瓶中,精密量取0.15 mL样品溶液,移至25 mL比色管中,无水乙醇定容,摇匀。在280 nm波长处测定吸光度值。
2.5 正交试验设计优选
在单因素试验的基础上,为了确定芦竹根总生物碱的最佳提取工艺,根据以上单因素试验结果选取液料比(A)、煎煮次数(B)、煎煮时间(C)、含醇量(D)为考察因素,以总生物碱含量为考察指标,采取L9(34)正交表试验探索最佳试验条件。各因素水平见表1。

表1 正交试验因素水平
3 结果
3.1 单因素试验考察结果与分析
3.1.1 含醇量的确定 由图1可知,芦竹根总生物碱测定的吸光度值与含醇量的高低有着密切关系。当含醇量增大时,总生物碱提取率随之提高,当含醇量高于80%提取率趋于平缓,实际操作过程中在含醇量80%左右时,易于萃取,分离层明显。

图2 不同醇沉含醇量提取比较
3.1.2 提取时间的确定 由图2可知,芦竹根总生物碱测定的吸光度值与煎煮时间的长短有关系。芦竹根总生物碱提取率随着时间延长而增大,当煎煮时间在1.5 h后,曲线上升趋于平缓。因此煎煮时间1.5~3.0 h在实验时间内。

图3 不同煎煮时间提取比较
3.1.3 提取次数的确定 由图3可知,芦竹根总生物碱测定的吸光度值与提取次数有关系。在4次提取过程中,吸光度值随着次数的增加而减少,在第三、第四次提取时,吸光度值变化很小,说明总生物碱已完全提取出来。

图4 煎煮次数对含量的影响
3.1.4 提取液体积的确定 由图4可知,芦竹根总生物碱测定的吸光度值与液料比有关系。芦竹根总生物碱的提取率随着提取液的增加而增加,当液料比6以上时,液料比对提取芦竹根总生物碱的影响较小,在一定体积的溶剂已将有效成分基本溶出完全。

图5 提取液体积对含量的影响
3.2 正交试验设计结果与分析
3.2.1 正交试验设计方案及试验结果 为了确定芦竹根总生物碱的最佳提取工艺,根据以上单因素试验结果选取料液比(A)、煎煮次数(B)、煎煮时间(C)、醇沉含醇量(D)为考察因素,以总生物碱含量为考察指标,采取L9(34)正交表探索最佳试验条件。芦竹根总生物碱提取工艺条件的正交试验设计及其结果见表2。

表2 芦竹根总生物碱提取工艺条件的正交试验设计及其结果
由直观分析可知,以芦竹根总生物碱的提取含量为考察指标,表2中R值可以看出,各因素对试验结果的影响大小顺序为D>C>B>A,即醇沉含醇量>煎煮时间>煎煮次数>液料比,A最佳条件为A2,即液料比为7∶1。以影响最小的液料比为误差项,进行三因素方差分析,分析结果见表3。

表3 芦竹根总生物碱提取率方差分析
注:F0.10(2,2)=9.00。
3.2.2 正交试验方差分析及其结果 由表3正交试验方差分析结果得出,D因素的影响有显著性意义,B和C因素则无显著性影响。D最佳条件为D1(90%含醇量)。结合直观分析和方差分析结果,确定芦竹根最佳提取工艺为A2B2C2D1,即液料比为7∶1;煎煮次数为3次;煎煮时间2 h;含醇量为90%。从极差、方差和实际操作过程中含醇量80%时,萃取效果最好,分层明显,乳化现象少,且可以节省很多乙醇,为实际的工业生产节约成本。煎煮2次即可达到目的,减少能源消耗。综合分析结果可以得出,最佳提取工艺为液料比7∶1、含醇量80%、煎煮时间2 h、煎煮次数2次。
3.2.3 验证实验 分别取3份芦竹根100 g,按最佳工艺条件平行操作,液料比7∶1、含醇量80%、煎煮时间2 h、煎煮次数2次。合并提取液,过滤,浓缩,定容。测定并计算3份芦竹根中总生物碱的含量。结果见表4。

表4 最佳工艺条件验证结果
由表4得知,用最佳工艺条件提取,提取率高于正交试验中最高一组数据,所以这组最佳工艺条件合理。
4 讨论
芦竹根化学成分主要为多种吲哚类生物碱,有着较好的药物开发价值。本文采用正交试验设计优化水煎法提取芦竹根中总生物碱的工艺。通过正交试验直观分析得到各因素对芦竹根中总生物碱提取影响的大小顺序D>C>B>A,即含醇量>煎煮时间>煎煮次数>液料比。正交试验方差分析结果得出,D因素的影响有显著性意义,D最佳条件为D1。结合直观分析和方差分析结果,以及试验具体过程和节约生产成本考虑,确定芦竹根中总生物碱最佳提取工艺为A2B2C2D1,即液料比为7∶1;煎煮次数为3次;煎煮时间2 h;含醇量为80%。验证实验用最佳工艺条件提取,提取物得到的提取率高于正交试验中最高一组数据,所以这组最佳工艺条件合理。本试验所得到的工艺条件可行性强、工艺简单,能为其工业化生产提供理论基础,为芦竹资源进一步开发利用提供了理论依据。
[1] 江苏新医学院.中药大辞典[M].上海:上海科技出版社,1986:1077-1079.
[2] 马文奎.竹的栽培和综合利用[J].中国野生植物资源,2006,25(2):64-65.
[3] Motti R,Antignani V,Idolo M.Traditional plant use in the phlegraean fields regional park(Campania,Southern Italy)[J]. Hum Ecol,2009,37(6):775-782.
[4] Pieroni A,Quave C,Nebel S,et al.Ethnopharmacy of the ethnic Albanians(Arbereshe)of northern Basilicata,Italy[J].Fitoterapia,2002,73(3):217-241.
[5] Darias V,Bravo L,Rabanal R,et al.New contribution to the enthopharmacological study of the canary islands[J].J Ethnopharmacol,1989,25(1):77-92.
[6] Buragohain J.Folk medicinal plants used in gynecological disorders in Tinsukia district,Assam,India[J].Fitoterapia,2008,79(5):388-392.
[7] 孙琪华,白权.芦根与芦竹根的鉴别探讨[J].川北医学院学报,1994,9(4):38-39.
[8] Ghosal S,Bhattacharya S K.A rundo donax L.(Graminae).phytochemical and pharmacological evaluation[J].J Med Chem,1969,12(3):480-483.
[9] Zhalolov L,Khuzhaev V U.Alkaloids of Arudo donax1 Ⅷ.3-Alkylindole derivatives in A.donax[J].Chem Nat Comp,2000,36(5):528-530.
[10] Khuzhaev V U,Aripova S F., Abdullaev U A.Alkaloids of Arundo donax.IV.donaxaninea new pyrrolidine alkaloid from Arundo donax[J].Chemistry of Natural Compounds,1995,31(5):728-730.
[11] Khuzhaev V U,Zhalolov I Zh,Levkovich M G,et al.Alkaloids of Arundo donax L.15.A new dimeric indole alkaloid arundarine from the roots of Arundo donax L[J].Russian Chemical Bulletin,2004,53(8):1765-1767.
[12] Khuzhaev V U,Zhalolov I,Turgunov K K,et al.Alkaloids from Arundo donax.XVI.Structure of the New Dimeric Indole Alkaloid Arundavine[J].Chemistry of Natural Compounds,2004,40(3):261-265.
[13] Ubaidullaev K A,Shakirov R,Yu S,et al.Alkaloids of Arundo donax the structure of donaxaridine and donaxarine[J].Chemistry of natural compounds,1976,12(4):499-500.
[14] Khuzhaev B U,Aripova S F,Shakirov R Sh.Arundine-A new dimeric alkaloid from the roots of Arundo donax[J].Chemistry of Natural Compounds,1994,30(5):685-686.
[15] 刘清茹,李娟,赵小芳,等.芦竹根化学成分的研究[J].中草药,2016,47(7):1084-1089.