山羊BST-2基因的表达及其亚细胞定位
2018-05-21缪秋红唐井玉董丹丹陈宗艳王桂军刘光清
张 莉,刘 腾,缪秋红,唐井玉,朱 杰,董丹丹,陈宗艳,王桂军,刘光清,*
(1.安徽农业大学 动物科技学院,安徽 合肥 230036; 2.中国农业科学院 上海兽医研究所,上海200241)
天然免疫是机体与生俱来的对病原微生物的天然抵抗力,在天然免疫中存在着由宿主细胞产生并能抑制或干扰病毒生命活动的因子,这些因子被称为天然免疫限制因子。目前,已被发现的天然免疫限制因子有APOBEC3、TRIM5α、SAMHD1、MOV10和BST-2(bone marrow stromal cell antigen 2)。其中,BST-2是宿主细胞中最关键的防御因子之一,它能够抑制不同的囊膜病毒从宿主细胞上的释放及传播[1]。
BST-2又被称为CD317、HM1.24、Tetherin,最早发现于终末分化的B细胞表面,在肿瘤细胞、骨髓基质细胞、单核巨噬细胞、树突状浆细胞中都有表达。2008年,研究人员首次证明BST-2的抗病毒活性,BST-2能够抑制HIV-1(human immunodeficiency virus type 1)病毒粒子的释放[2]。随后,研究发现,BST-2对其他一些囊膜病毒也存在一定的限制作用,这其中包括埃博拉病毒[3]、马尔堡病毒[4]、甲型流感病毒[5-7]、仙台病毒[8-9]、拉沙热病毒[10]、丙型肝炎病毒[11]等。
目前,对BST-2的研究主要集中在灵长类动物上,而对羊源BST-2的研究较少。已有研究证实,绵羊BST-2对囊膜病毒出芽存在限制作用,因此推测山羊BST-2也有此作用。本研究对山羊BST-2基因进行了克隆,并利用原核表达系统成功表达并纯化了羊源BST-2蛋白,在此基础上探讨了BST-2蛋白在Vero细胞上的亚细胞定位情况。本研究对进一步研究山羊BST-2蛋白的生物学功能及其对羊源囊膜病毒的抗病毒功能提供了一定基础材料。
1 材料与方法
1.1 主要试剂
ExTaqDNA聚合酶、SolutionⅠ购自TaKaRa公司。Trans2k plusⅡDNA Marker购自北京全式金生物技术有限公司。质粒小提试剂盒、凝胶回收试剂盒购自Axygen生物技术有限公司。去内毒素质粒中提试剂盒购自上海普洛麦格生物产品有限公司。限制性内切酶HindⅢ、XbaⅠ、BamHⅠ、EcoRⅠ均购自于NEB公司。脂质体转染试剂Lipfectamine 2000购自Invitrogen公司。DMEM、胎牛血清、PBS均购自于Hyclone公司。Opti-MEM购自Gibco公司。抗Flag标签小鼠单克隆抗体、抗GST标签鼠源单克隆抗体、HRP标记山羊抗鼠IgG、FITC标记的山羊抗鼠IgG购自Santa Cruz公司。ECL显色试剂盒购自赛默飞公司。
1.2 细胞及质粒
E.coliTrans 5α、E.coliBL21(DE3)感受态细胞购自北京全式金生物技术有限公司。Vero细胞系、p3×Flag-CMV-14、pGEX-4T-1、pUC-BST-2质粒均由笔者所在实验室保存。
1.3 重组质粒pGEX-BST-2、p3×Flag-BST-2的构建
根据GenBank中的预测山羊BST-2基因CDS区序列(XM_018051380.1),利用Primer Premier 5.0 软件分别设计2对扩增BST-2基因的特异性引物,预期扩增片段大小为495 bp。引物序列如下:BST-2-Flag-F,5’-CCCAAGCTTATGATGGACAAATTGGAAGGATCT-3’(下划线处为HindⅢ酶切位点);BST-2-Flag-R,5’-GCTCTAGATTTCTTCAGACACTTGCGGGT-3’(下划线处为XbaⅠ酶切位点); BST-2-GST-F,5’-CGCGGATCCATGATGGACAAATTG GAAGGA-3’(下划线处为BamHⅠ酶切位点);BST-2-GST-R,5’-CCGGAATTCATTTCTTCAGACACTTGCG-3’(下划线处为EcoRⅠ酶切位点)。引物由上海杰李生物技术有限公司合成。
以pUC-BST-2重组质粒为模板,进行目的基因的扩增。利用凝胶回收试剂盒回收目的片段,分别用BamHⅠ和EcoRⅠ、HindⅢ和XbaⅠ进行双酶切,然后分别与用BamHⅠ和EcoRⅠ双酶切的载体pGEX-4T-1及HindⅢ和XbaⅠ双酶切的载体p3×Flag-CMV-14进行连接。连接产物转化E.coliTrans 5α感受态细胞,37 ℃过夜培养后挑取单菌落进行菌液PCR鉴定,鉴定正确提取重组质粒分别进行酶切鉴定。酶切鉴定正确的重组质粒送至上海华津生物技术有限公司进行测序。
1.4 重组蛋白的表达及纯化
将重组质粒pGEX-BST-2转化至E.coliBL21(DE3)感受态细胞,挑取单菌落,接种于含氨苄青霉素的LB液体培养基,37 ℃、220 r·min-1振荡培养。待D600达到0.6~0.8后,加入1 mmol·L-1IPTG于16 ℃进行诱导表达。确认目的蛋白表达后,再进行蛋白的大量诱导表达,4 ℃离心收集菌体,经过溶菌酶、反复冻融、超声波处理后,离心获得上清,按照GST-Sefinose resin GST试剂盒说明书进行目的蛋白的纯化。
1.5 Western blot鉴定重组蛋白
重组蛋白BST-2经SDS-PAGE电泳后,半干法转印至NC膜上,使用含5%脱脂乳的TBST 4 ℃封闭过夜。加入1∶1 000稀释的抗GST标签的鼠源单克隆抗体4 ℃孵育过夜。清洗后加入1∶5 000稀释的HRP标记的羊抗鼠IgG 37 ℃孵育1 h,使用ECL显色试剂盒显色。
1.6 Vero细胞的转染
采用含有10% FBS的DMEM培养Vero细胞,并置于37 ℃、5%CO2培养箱中进行培养。当细胞达到80%~90%融合时,在无血清条件下,参照Lipofectamine 2000试剂盒说明书进行转染,同时设置阴性对照组。转染24 h后,进行间接免疫荧光试验,激光共聚焦显微镜下观察BST-2蛋白的表达。转染24 h后,进行Western blot鉴定BST-2的表达。
2 结果与分析
2.1 重组质粒pGEX-BST-2、p3×Flag-BST-2的鉴定
PCR扩增产物经2%的琼脂糖凝胶电泳显示,扩增片段大小约在495 bp(图1),与预期大小一致。重组质粒pGEX-BST-2、p3×Flag-BST-2分别经BamHⅠ和EcoRⅠ及HindⅢ和XbaⅠ双酶切,得到与预期大小一致的载体片段及目的基因片段。测序结果表明,目的基因BST-2已被插入pGEX-4T-1和p3×Flag-CMV-14质粒中。
2.2 重组蛋白的表达
将重组质粒pGEX-BST-2转化至E.coliBL21(DE3)感受态细胞,经1 mmol·L-1IPTG于16 ℃诱导表达。SDS-PAGE分析结果,诱导后出现分子质量约为42 ku的特异性蛋白,与预期大小一致(图2)。未诱导的空载体和重组表达载体的菌株未表达目的条带。本研究中原核表达的重组BST-2蛋白含有GST标签,使用抗GST标签的特异性抗体对目的蛋白进行Western blot鉴定,发现目的蛋白主要在表达菌上清(图3)。
2.3 Western blot鉴定真核表达BST-2蛋白
真核表达质粒p3×Flag-BST-2转染Vero细胞24 h后,提取细胞总蛋白,Western blot鉴定BST-2蛋白的表达。本研究中真核表达重组蛋白含有Flag标签,使用抗Flag的鼠源单克隆抗体作为一抗,Western blot结果显示,融合蛋白BST-2已成功表达,大小约为21 ku,与预期目的蛋白大小一致。

M,蛋白分子质量标准;1,pGEX-BST-2未经IPTG诱导;2~6,pGEX-BST-2在16、20、24、28、32 h内诱导表达产物;7,空载体未经诱导;8,空载体诱导;9,纯化的重组蛋白。M,Protein molecular weight marker; 1,Before induced pGEX-BST-2; 2-6,The plasmid pGEX-BST-2 induced in 16,20,24,28,32 h; 7,pGEX-4T-1 without induction; 8,pGEX-4T-1induced with IPTG; 9,Purified recombinant protein.图2 重组蛋白的SDS-PAGE分析Fig.2 Analysis of recombinant protein by SDS-PAGE
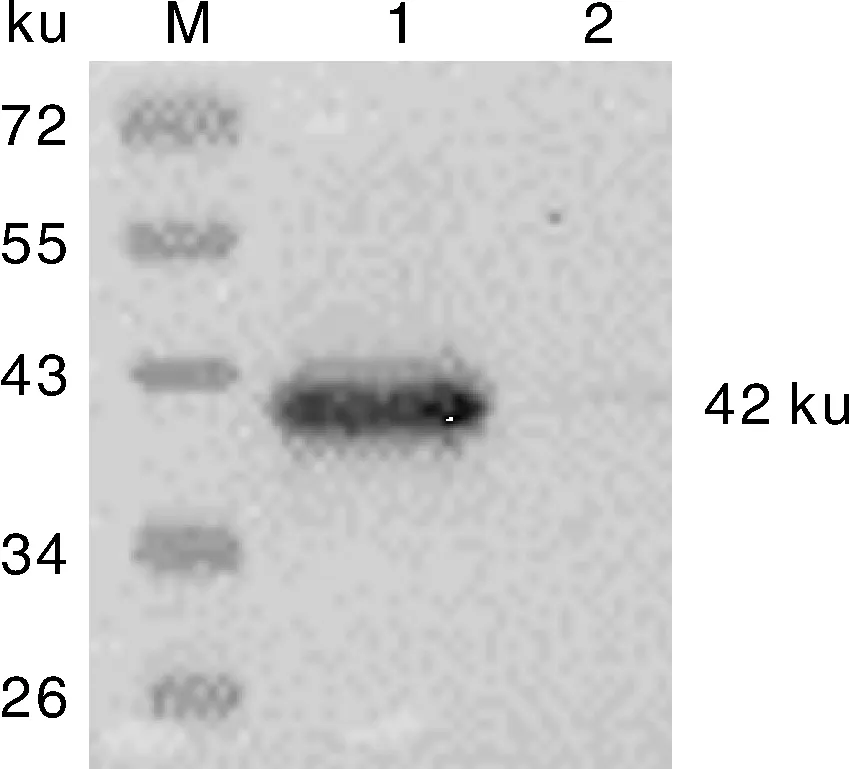
M,蛋白分子质量标准;1,pGEX-BST-2诱导上清;2,pGEX-BST-2诱导沉淀。M,Protein molecular weight marker; 1,Supernatant of induced pGEX-BST-2; 2,Sediment of induced pGEX-BST-2.图3 Western blot鉴定原核表达BST-2蛋白Fig.3 Identification of the prokaryotic expression BST-2 protein by Western blot
2.4 BST-2蛋白的亚细胞定位
真核表达质粒p3×Flag-BST-2转染Vero细胞24 h后进行间接免疫荧光试验(IFA),激光共聚焦显微镜下观察BST-2蛋白的亚细胞定位情况。IFA结果显示,转染的重组质粒p3×Flag-BST-2在Vero细胞中,绿色荧光主要在细胞膜上,细胞质内也有绿色荧光,而细胞核中没有绿色荧光显现,阴性对照组未见绿色荧光。结果表明,BST-2蛋白主要在Vero细胞膜表达。
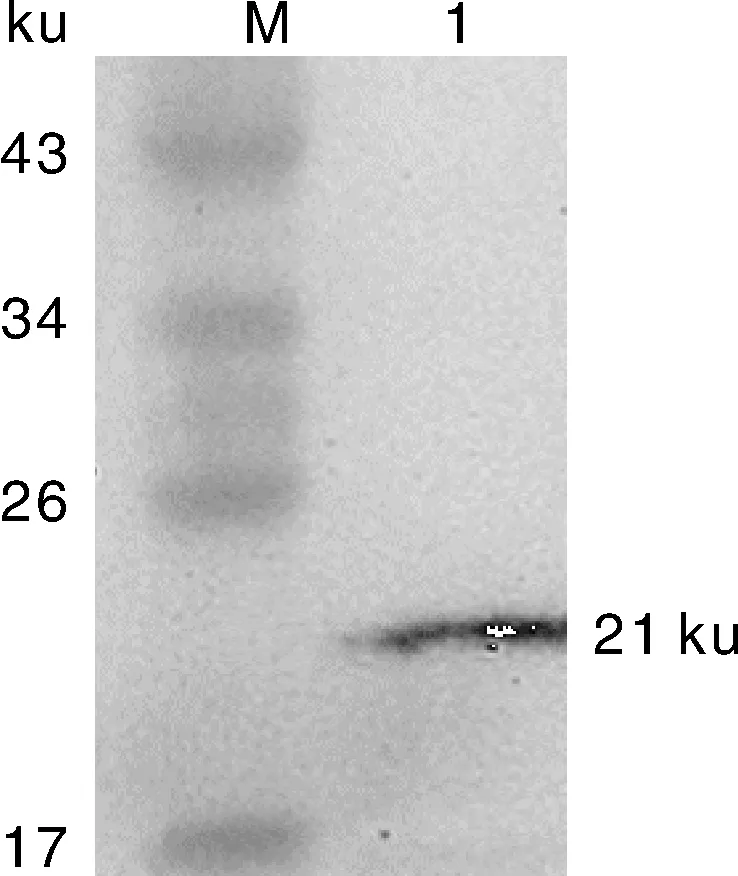
M,蛋白分子质量标准;1,真核表达BST-2蛋白。M,Protein molecular weight marker; 1,The eukaryotic expression BST-2 protein.图4 Western blot鉴定真核表达蛋白Fig.4 Identification of the eukaryotic expression BST-2 protein by Western blot

A,转染p3×Flag-BST-2的Vero细胞(40×);B,阴性对照(40×)。A,Vero cells transfected with p3×Flag-BST-2(40×);B,Negative control(40×).图5 BST-2蛋白在Vero细胞中的亚细胞定位Fig.5 Subcellular localization of BST-2 protein in Vero cells
3 讨论
BST-2是一种能够被Ⅰ型干扰素诱导表达的跨膜蛋白,包含4个区域,分别是N端胞质尾区(CT)、跨膜区(TM)、胞外螺旋区和C端糖基磷脂酰肌醇锚定位点(GPI)。BST-2的跨膜区和GPI形成了其特殊的拓扑结构,这与它的抗病毒活性密切相关。BST-2能够抑制多种囊膜病毒的出芽及释放,同时也发现了一些病毒粒子具有拮抗BST-2功能的蛋白,例如HIV-1的Vpu蛋白能通过不同的策略拮抗BST-2的抗病毒活性[2],SIV的Nef蛋白下调细胞表面的BST-2表达量来发挥拮抗作用[12],EIAV的Env蛋白能够拮抗马BST-2的抗病毒活性且呈现种属特异性[13]。
本研究克隆了羊源BST-2基因,并成功用原核表达系统表达了融合GST标签的BST-2蛋白。此外,将含有BST-2基因的真核表达载体p3×Flag-BST-2转染Vero细胞,对其在细胞中的表达定位进行了初步分析,结果显示,该蛋白主要表达于细胞膜上,这可能与其具有跨膜蛋白的结构特征有关,这也决定了BST-2具有在细胞膜上限制病毒释放的生物学功能。虽然大量研究表明,BST-2能够发挥抗病毒功能,但非灵长类动物BST-2的抗病毒活性以及病毒拮抗BST-2研究较少,本研究获得了原核表达的BST-2蛋白,为制备抗BST-2的多克隆抗体提供了前期准备,成功构建真核表达BST-2蛋白的载体能研究其与羊源囊膜病毒各个蛋白的相互作用,这些都为深入探究山羊BST-2抗病毒机制奠定了基础。
参考文献(References):
[1] NEIL S J. The antiviral activities of tetherin[J].CurrentTopicsinMicrobiologyandImmunology,2013,371:67-104.
[2] NEIL S J,ZANG T,BIENIASZ P D. Tetherin inhibits retrovirus release and is antagonized by HIV-1 Vpu[J].Nature,2008,451(7177):425-430.
[3] KALETSKY R L,FRANCICA J R,AGRAWAL-GAMSE C,et al. Tetherin-mediated restriction of filovirus budding is antagonized by the Ebola glycoprotein[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica,2009,106(8):2886-2891.
[4] FEAGINS A R,BASLER C F. The VP40 protein of Marburg virus exhibits impaired budding and increased sensitivity to human tetherin following mouse adaptation[J].JournalofVirology,2014,88(24):14440-14450.
[5] WATANABE R,LESER G P,LAMB R A. Influenza virus is not restricted by tetherin whereas influenza VLP production is restricted by tetherin[J].Virology,2011,417(1):50-56.
[6] MANGEAT B,CAVAGLIOTTI L,LEHMANN M,et al. Influenza virus partially counteracts restriction imposed by tetherin/BST-2[J].JournalofBiologicalChemistry,2012,287(26):22015-22029.
[7] YONDOLA M A,FERNANDES F,BELICHA-VILLANUEVA A,et al. Budding capability of the influenza virus neuraminidase can be modulated by tetherin[J].JournalofVirology,2011,85(6):2480-2491.
[8] KONG W S,IRIE T,YOSHIDA A,et al. Inhibition of virus-like particle release of Sendai virus and Nipah virus,but not that of mumps virus,by tetherin/CD317/BST-2[J].HiroshimaJournalofMedicalSciences,2012,61(3):59-61.
[9] BAMPI C,RASGA L,ROUX L. Antagonism to human BST-2/tetherin by Sendai virus glycoproteins[J].JournalofGeneralVirology,2013,94(Pt6):1211-1219.
[10] SAKUMA T,NODA T,URATA S,et al. Inhibition of Lassa and Marburg virus production by tetherin[J].JournalofVirology,2009,83(5):2382-2385.
[11] PAN X B,QU X W,JIANG D,et al. BST2/Tetherin inhibits hepatitis C virus production in human hepatoma cells[J].AntiviralResearch,2013,98(1):54-60.
[12] ZHANG F,LANDFORD W N,NG M,et al. SIV Nef proteins recruit the AP-2 complex to antagonize Tetherin and facilitate virion release[J].PLoSPathogens,2011,7(5):e1002039.
[13] YIN X,HU Z,GU Q,et al. Equine tetherin blocks retrovirus release and its activity is antagonized by equine infectious anemia virus envelope protein[J].JournalofVirology,2014,88(2):1259-1270.
