熄风胶囊对难治性癫痫大鼠海马Ⅰ型钠通道 α 亚基蛋白及 m RNA表达的影响*
2018-05-16房艳艳李新民路岩莉韩耀巍
房艳艳 ,李新民,路岩莉 ,韩耀巍 ,聂 坤,吴 超
1天津中医药大学,天津 300193;2天津中医药大学第一附属医院
难治性癫痫是指频繁的癫痫发作至少每月4次以上,应用适当的一线抗癫痫药物(AEDs)正规治疗,药物稳态血浓度在有效治疗范围内,无严重的药物副反应;至少观察2年,发作仍不能控制,影响日常生活;无进行性中枢神经系统疾病或占位性病变[1]。电压门控钠通道基因突变与癫痫的发生密切相关,涉及到编码电压门控性钠通道亚型Na1.1的基因SCNIA突变最为重要。基因突变可改变钠离子通道电生理功能,如电流-电压曲线的移动、电流幅度增加、失活减慢等,使得神经元的兴奋性增加,造成神经元高频高幅的异常放电波,进而导致遗传性癫痫伴热性惊厥附加症、Dravet综合征、颞叶癫痫等多种癫痫病理类型。本实验将以IE难治性癫痫耐药机制形成为切入点,从电压门控性钠通道的基因表达入手,系统观察熄风胶囊对IE的治疗效果,阐明其治疗IE的可能作用机制,为临床应用和进一步研究提供理论和实验依据。
1 材料与方法
1.1 动物 SPF级健康雄性SD大鼠,平均体质量(45±10)g,由中国人民解放军军事医学科学院实验动物中心提供[许可证号:SCXK(军)2012-0004]。
1.2 实验药品 氯化锂(100 g/瓶,美国Sigma公司,批号:115K1308)、阿托品(5 mg/mL,天津金耀氨基酸有限公司,批号:H12020384)、盐酸匹罗卡品(5 g/瓶,美国Sigma公司,批号:066k1730)、地西泮注射液(5 mg/mL,天津金耀氨基酸有限公司,批号:0804032)、熄风胶囊[院内制剂,药物组成:紫河车12 g,石菖蒲12 g,天麻8 g,僵蚕4 g,郁金8 g,全蝎4 g,姜半夏8 g。0.33 g/粒,天津中医药大学第一附属医院杏林药厂,津药制字(2001)Z第0252号]、卡马西平(200 mg/片,北京诺华制药公司,批号:H11022279)。
1.3 试剂及仪器 SCN1A抗体,牛血清-干燥血清,宁波新芝分子杂交炉,LF-III显微镜奥林巴斯 BX43,Image-Pro Plus(IPP6.0)软件等;组织蛋白抽提试剂盒(CWbio.Co.Ltd Cat.No CW08911。2)SCN1A antibody(Biorbyt#orb13681),SW-CJ-1D型超净台(江苏通净),QL-902型涡旋振荡仪(海门市其林贝尔仪器制造有限公司),离心机(Eppendorf,Centrifuge 5415D),酶标仪(Thermo,MultiSkan3),电泳槽(Cavoy,Mini P-4)、电泳仪(Bio-Rad)、半干转槽(Bio-Rad)等;无RNA酶的EPpendorf管,液氮,-80℃冰箱,超纯RNA提取试剂盒,HiFi-MMLV cDNA第一链合成试剂盒,UltraSYBR Mixture,DNase I均购自CWbio公司,荧光定量PCR仪(Bio-rad IQ5)。
1.4 方法
1.4.1 造模基本步骤 参照Honchar[2]和余倩[3]的方法:采用锂-匹鲁卡品注射方法,制备难治性癫痫大鼠模型。将150只大鼠随机分成2组,正常对照组13只,其余137只用于模型的建立。氯化锂按127 mg/kg剂量进行腹腔注射,18小时后硫酸阿托品1 mg/kg腹腔注射以减少外周胆碱能作用,30分钟后匹罗卡品30 mg/kg(浓度1%,首次20 mg/kg,30分钟后10 mg/kg)腹腔注射,大鼠出现癫痫持续状态1小时后,再给予腹腔注射地西泮10mg/kg解除抽搐,如痫性发作不能缓解,可重复注射地西泮1~2次,直到痫性发作被解除。
1.4.2 模型评价惊厥评分采用Racine评分法 惊厥评分采用Racine评分法[4]:痫性发作达到Ⅳ级及以上,持续时间超过30分钟,解除痫性发作后状态良好的大鼠为合格的模型。本实验造模前大鼠共150只,其中24只出现0-Ⅲ级发作,表现为无反应、耳面部抽搐、肌阵挛伴或不伴直立位等,为点燃不成功大鼠,予以剔除。造模后达到Ⅳ级及以上的大鼠共113只,在造模过程中由于癫痫频繁发作死亡16只,在接下来的一周,大鼠的主要表现为精神萎靡、进食活动少、消瘦,暂不给予药物及生理盐水等灌胃处理,予葡萄糖盐水及水果碎片饲养加强营养支持。期间6只大鼠相继死去,对剩余存活且精神状态良好的91只大鼠,每组13只分为7组,加空白组13只,共8组。
1.4.3 动物分组及灌胃计量 将造模成功的91只大鼠随机分为7组,分别为模型对照组(模型组)、熄风胶囊低剂量组(熄低组)、熄风胶囊中剂量组(熄中组)、熄风胶囊高剂量组(熄高组)、卡马西平治疗组(CBZ组)、熄风胶囊中剂量+卡马西平组(熄卡组)、熄风胶囊中剂量+1/2卡马西平组(熄卡低组),每组大鼠13只。造模前随机选取13只大鼠,作为正常对照组(空白组)。其中熄低组:熄风胶囊0.33 g,浓缩剂2 mL;熄中组:熄风胶囊0.66 g,浓缩剂 2 mL;熄高组:熄风胶囊 0.99 g,浓缩剂 2 mL;CBZ 治疗组:CBZ 20 mg/kg;熄卡组:熄风胶囊0.66 g,浓缩剂2 mL和CBZ 20 mg/kg;熄卡低组:熄风胶囊0.66 g,浓缩剂2 mL和CBZ 10mg/kg;空白组和模型组给予生理盐水2 mL。每天上午灌胃1次,共持续60天。
1.4.4 标本制备及检测方法
1.4.4.1 免疫组化 各组随机选取2只大鼠,迅速断头取脑,置于冰盘上4%戊二醛固定液中剥离脑组织,将含有双侧海马的脑组织放入4%多聚甲醛缓冲液中固定,并标记;免疫组化染色法染色:组织脱蜡、组织复水、组织抗原修复、去除组织内的内源性过氧化物酶、血清封闭组织切片、血清封闭组织切片、二抗孵育、DAB显色、组织脱水、透明;采用Image-Pro Plus(IPP6.0)软件对图像进行分析,计算平均阳性光密度。
1.4.4.2 Western-blot 各组随机选取4只大鼠,迅速断头取脑,冰盘上迅速剥离出双侧海马及皮层置于无RNA酶的EPpendorf管中,标记后放入液氮罐之内暂存,随后保存于-80℃冰箱中,备用于RNA的提取;Western-blot:抽提蛋白后BCA法蛋白定量,对蛋白浓度调整,然后进行目的蛋白、内参蛋白WB实验;将光片采用 Bio-Rad2000型凝胶成像系统扫描后,应用QUANTITYONE软件进行吸光度分析,测定灰度值,代表蛋白的表达量(Pgp/β-actin)。
1.4.4.3 Real-time RT-PCR 各组随机选取4只大鼠,将大鼠迅速断头,剪开颅顶部皮肤,剥除颅骨,用高温高压消毒过的器械将鼠脑剜出,置于无菌冰盘,迅速剥离出双侧海马及皮层置于无RNA酶的EP pendorf管中,标记后放入液氮罐之内暂
存。随后保存于-80℃冰箱。采用超纯RNA提取试剂盒提取总RNA:于样品中加入1 mL上样缓冲液,溶解后的RNA进行1.0%琼脂糖凝胶电泳,待溴酚蓝迁移至凝胶长度2/3时停止电泳,取出凝胶在紫外透射仪上观察5、18和28 s条带并摄影记录。用HiFi-MMLVcDNA第一链合成试剂盒进行反转录,总反应体系20 μL。反转录条件是:37℃孵育40分钟,反应结束后85℃保温5分钟。反转录产物-20℃保存备用。采用荧光定量PCR仪,用2-△△CT法进行数据的相对定量分析。
1.5 统计学方法 采用SPSS 19.0软件对实验数据进行统计学处理。计量资料采用(±s)表示,多组比较采用one-way ANOVA分析,两两比较用q检验;设置双侧检验水准α=0.05。
2 结果
2.1 免疫组化
2.1.1 空白组可见少量细胞表达SCN1A 神经元细胞阳性染色显示胞体形状多呈棱椎形。神经胶质细胞染色显示胞体多为三角形、椭圆形或多边不规则形。SCN1A免疫阳性颗粒主要分布在细胞的胞膜和胞浆。模型组主要表现为大量神经元细胞空泡样变性、坏死,神经胶质细胞数量增加。治疗组可以见到大量胞浆呈黄色、胞核较大的神经细胞和胞浆呈黄色的毛细血管内皮细胞,和部分胞浆呈黄色、胞核较小、致密的神经胶质细胞,呈阳性表达。见图1。

图1 Ⅰ型钠通道α亚基蛋白的表达情况(X200)
2.1.2熄风胶囊对IE大鼠海马SCN1A分布范围的影响 对所得数据进行分析发现,与空白组比较,模型组SCN1A的表达水平上调(P<0.05);与模型组比较,各治疗组的SCN1A的表达水平均下调(P<0.05);与CBZ组相比,熄卡组SCN1A的表达水平低于CBZ组(P<0.05);中药组各组之间均没有显著差异(P>0.05),见表1。
表1 熄风胶囊对IE大鼠海马SCN1A分布范围的影响(±s)

表1 熄风胶囊对IE大鼠海马SCN1A分布范围的影响(±s)
注:与空白组比较,◆表示P<0.05;与模型组比较,■表示P<0.05;与CBZ组比较,▲表示P<0.05
?
2.2 Western-blot
2.2.1 BCA定量检测结果 BCA定量检测标准检测结果及其标准曲线,见表2,图2。
2.2.2 SCNIA目的条带及内容条带结果 样品检测上样顺序、蛋白浓度及条带图像,见图3。
2.2.3 熄风胶囊对IE大鼠海马SCN1A表达程度的影响 对所得数据进行分析发现,与空白组比较,模型组SCN1A的表达高于空白组(P<0.05);与模型组比较,各治疗组SCN1A的表达均低于模型组(P<0.05);与CBZ组比较,熄卡低组SCN1A的表达低于CBZ组(P<0.05);中药组各组之间均没有显著差异(P>0.05)。见表3。

表2 BCA定量检测标准品检测结果

图2 BCA定量检测标准曲线

图3 SCN1A目的条带及内参条带结果
表3 熄风胶囊IE大鼠海马SCN1A表达程度的影响(±s)

表3 熄风胶囊IE大鼠海马SCN1A表达程度的影响(±s)
注:与空白组比较,◆表示P<0.05;与模型组比较,■表示P<0.05;与CBZ组比较,表示P>0.05
?
2.3 Real-time RT-PCR
2.3.1 各基因扩增的标准曲线 选取样本cDNA进行5倍梯度稀释,稀释后样品各取2 μL作模板,分别用目的基因引物和内参基因引物进行扩增,同时在60~95℃进行融解曲线分析。从图4可见,标准曲线的R2均达到0.99,说明线性相光度很高,而且扩增效率均在90%以上,因此可以采用这种方法和上述引物对后续样本进行扩增分析,见图4。
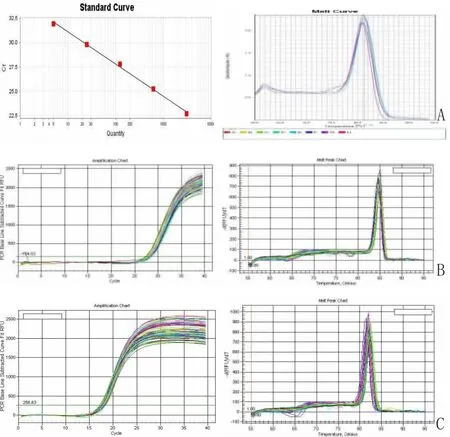
图4 SCN1A基因标准曲线图及产物溶解曲线图
2.3.2 熄风胶囊对IE大鼠海马SCN1AmRNA表达水平的影响 对所得数据进行分析发现,空白组为模型组的0.85倍,说明模型组SCN1A mRNA的表达较空白组表达上调;CBZ组SCN1A mRNA的表达较模型组上调,为模型组的1.15倍;中药组中熄高组、熄中组、熄低组SCN1A mRNA的表达较模型组下调,分别为模型组的0.86倍、0.82倍、0.93倍;联合组中熄卡组SCN1A mRNA的表达较模型组下调,为模型组的0.88倍,熄卡低组SCN1A mRNA的表达较模型组上调,为模型组的1.16倍。本实验结果提示熄高组、熄中组、熄低组、熄卡组对SCN1A mRNA表达有抑制作用,而卡马组、熄卡低组对SCN1AmRNA表达有促进作用。见表4。
3 讨论
电压门控性钠通道是细胞动作电位产生的结构基础,钠电流可引起细胞的去极化和传导兴奋,与神经元持续反复性放电的发生有关。海马的功能通过各种离子通道完成,其中钠离子通道开放引起的去极化内向电流是兴奋性细胞产生动作电位的关键[5-6]。电压依赖性钠通道在神经元兴奋中起的重要作用,决定神经元放电的持续时间和频率,其活性的改变是许多神经元兴奋性异常相关疾病(癫痫、缺血性脑损伤等)的病理基础[7-8]。
VGSCsI型α亚基基因(SCN1A)在中枢神经系统中主要表达于胞体和树突上,也表达于某些中间神经元的轴突起始段[9]。位于2号染色体长臂2区4带,大小为81 kb,由26个外显子编码。在所有编码NaV的基因中,编码Na1.1的基因SCNIA与癫痫有关的基因突变的数量是最多的,同时SCN1A也被认为是与癫痫的关系最为密切的一个。研究发现SCN1A的突变与癫痫的几个表现型也是有因果关系的,例如遗传性癫痫伴热性惊厥附加症(GEFS+)、Dravet综
合征(DS)和颞叶癫痫(TLE)[10]。
Yu等[11]通过定向敲除小鼠SCN1A基因构建了SMEI小鼠模型。结果显示在纯和Scn1a-/-小鼠海马锥体细胞记录到正常水平钠电流,这可能与Nav1.1在此种神经元中分布较少有关。与此相反,海马GABA能抑制性中间神经元(如双极细胞)钠电流显著减少。此外,小脑GABA能浦肯野细胞也表现出峰电流、持续和复活钠电流都显著减少,这是小鼠表现出严重共济失调的原因[12]。有学者通过将R1648H突变导入同源小鼠基因中构建了GEFS+基因敲入小鼠模型。实验发现R1648H基因突变小鼠纯合突变体(Scn1aRH/RH)具有自发的全面性发作,然而杂合突变体(Scn1aRH/+)自发性全面性发作、高温诱导癫痫和三氟乙醚诱导癫痫发作阈值降低。在兴奋性锥体细胞中仅表现出轻度加速那通道复活的作用,而在双极神经元中,钠电流的幅值却明显降低。以上研究结果表明,Nav1.1在GABA能神经元的表达高于兴奋性神经元(如锥体细胞)的表达。SCN1A基因突变选择性影响高表达Nav1.1的GABA能神经元,使其钠电流密度减小、爆发高频动作电位的能力下降。而抑制性GABA能中间神经元兴奋性降低,会导致GABA能神经元抑制作用减弱,从而引起大脑内兴奋和抑制作用失衡,引发癫痫。
马融教授根据IE反复发作、病程缠绵、迁延不愈的特点,根据肾-精-髓-脑的密切关系,及“久病必虚”“久病必瘀”“久病入络”的中医理论,提出IE病机关键在于肾精亏虚,痰瘀阻络,应治以益肾填精、豁痰熄风、化瘀通络,并在此基础上研制出中药复方熄风胶囊,标本兼顾,扶正祛邪以进行治疗。在临床研究上,马融等[13]通过观察提出熄风胶囊是一种治疗小儿癫痫强直-阵挛性发作的有效中药。路岩莉等[14]通过观察癫痫患儿右熄风胶囊治疗后脑电图痫样放电频率在清醒、慢波睡眠和快波睡眠阶段较治疗前明显减少。表明熄风胶囊在临床上治疗癫痫是有效的。
本实验通过免疫组化、Western-blot、Real-Time PCR法检测到IE大鼠海马SCN1A在蛋白与mRNA两个层面均表达上调。通过与正常大鼠比较,大鼠海马SCN1A蛋白表达显著增高;另外,IE大鼠海马各个部位,均可见SCN1A蛋白表达阳性细胞,包括CAI、CA3和齿状回区。研究已经证实海马的锥体神经元可以产生异常电活动和动作电位的簇发,进而可以导致癫痫样活动的产生。第二,中药复方熄风胶囊单药及联合卡马西平用药干预后IE大鼠海马SCN1A在蛋白与mRNA两个层面均表达下调。提示中药复方熄风胶囊可能通过抑制IE大鼠钠通道的基因表达而发挥治疗作用。
参考文献
[1]沈鼎烈,王学峰.临床癫痫学[M].上海:上海科学技术出版社,2007:403.
[2]Honchar MP,Olney JW,Sherman WR.Systemic cholinergic agents induce seizures and brain damage in lithiumtreated rats[J].Science,1983,220(45):323-325.
[3]余倩.小剂量反复注射匹罗卡品建立颞叶癫痫大鼠模型的研究[J].贵州医药,2012,36(2):162-163.
[4]Racine RJ.Modification of seizure activity by electrical stimulation Ⅱ Motor Seizure,Electroencephalogr[J].Clin Neurophysiol,1972,32:281-294.
[5]Horn EM,Waldrop TG.HyPoxic augmentation of fas tinactivating and Persistent sodium currents in rat caudal hypothalamic neurons[J].J Neurophysiol,2000,84(5):2572-2581.
[6]Carter AJ,Grauert M,Pschorn U,et al.Potent blockade of sodium channels and protection of brain tissue from ischemia by BIII 890 CL[J].Proc Natl Acad Sci USA,2000:97(9):4944-4949.
[7]Avanzini G,Franceschetti S.Cellular biology of epileptogenesis[J].Lancet Neurol,2003,2(1):33-42.
[8]Kohling R.Voltage-gated sodium channels in epilepsy[J].Epilepsia,2002,43(11):1278-1295.
[9]Ogiwara I,Miyamoto H,Morita N,et al.Nav1.1 localizes to axons of parvalbumin-positive inhibitory interneurons:a circuit basis for epileptic seizures in mice carrying an scn1a gene mutation[J].Journal of Neuroscience the official Journal of the society for Neuroscience,2007,27(22):5903-5914.
[10]Yoshitomi S,Takahashi Y,Ishizuka M,et al.Three patients manifesting early infantile epileptic spasms associated with F2q24.3 microduplications[J].Brain Dev,2015,37(9):874-879.
[11]Yu FH,Mantegazza M,Westenbroek RE,et al.Reduced sodium current in GABAergic interneurons in a mouse model of severe myoclonic epilepsy in infancy[J].Nat Neurosci,2006,9(9):1142-1149.
[12]Oakley JC,Kalume F,Yu FH,et al.Temperature-and agedependent seizures in a mouse model of severe myoclonic epilepsy in infancy [J].Proc Natl Acad Sci USA,2009,106(10):3994-3999.
[13]马融,张喜莲.熄风胶囊治疗小儿癫痫强直-阵挛性发作200例临床观察[J].中医杂志,2004,45(5):363-364.
[14]路岩莉,晋黎,孙丹.熄风胶囊治疗小儿良性癫痫19例观察[J].中医杂志,2013,54(2):121-123.
