低温胁迫对高山杜鹃生理特性影响的研究
2018-05-16李小玲华智锐贺广祥
李小玲,华智锐,祝 颖,贺广祥
(商洛学院 生物医药与食品工程学院,陕西 商洛 726000)
高山杜鹃(Rhododendrondelavayi)是杜鹃花科杜鹃花属植物的总称。它既是世界三大高山花卉之一,也是中国十大名花之一[1]。高山杜鹃原种的70%早在100多年前从中国引入欧洲,欧洲人经过上百年的研究,培育出了中国杜鹃品种与欧美杜鹃品种的杂交种[2]。高山杜鹃耐寒,喜阴凉和湿润的环境,多生长在海拔1000 m以上的高山、草甸、林缘地区[3]。陕西秦岭野生杜鹃花属植物以其丰富的种类、鲜艳多姿的花型、四季常青的特点博得了人们的喜爱,它不仅具有一定的观赏价值,而且其枝叶可以用来入药,因此具有较高的开发利用价值[4]。镇安木王国家森林公园,地处陕西省商洛市镇安县杨泗乡,享有“千山杜鹃”、“杜鹃故里”的美誉。该地区杜鹃花种类主要包括秀雅杜鹃、美容杜鹃、头花杜鹃、照山白等,其中分布数量最大,面积最广的为美容杜鹃[5]。
温度是植物正常生理代谢的主要生态因子之一,极端温度不仅会影响植物的正常生长发育、引起植物代谢紊乱,而且严重时还会造成植株的死亡。低温是植物生长发育过程中经常遭受的非生物胁迫因子之一[6],低温可作为环境信号启动细胞内信号转导途径,引起植物体内酶活性的改变及基因表达,进而影响植物重要的生理生化反应[7-8]。
本研究以秦岭高山杜鹃幼苗为材料,通过探讨低温胁迫对高山杜鹃丙二醛(MDA)含量、相对电导率、游离脯氨酸含量、可溶性蛋白含量、超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性、过氧化氢酶(CAT)活性的影响,从理论上揭示高山杜鹃对低温胁迫的生理生态适应机制,为高山杜鹃休眠状态的解除和抗寒性品种的选育提供理论依据和实验指导。
1 材料与方法
1.1 试验材料
试验所用高山杜鹃幼苗于2017年4月上旬采自商洛市镇安县木王国家森林公园海拔1500 m左右的茨沟杜鹃花景区。
1.2 试验方法
1.2.1 材料预培养 将采集的株高10 cm的高山杜鹃幼苗移栽到直径为15 cm的花盆中,每盆种植1株,盆栽基质为腐叶土∶松针土=1∶2。培养期间于每天傍晚喷洒0.1%~0.5%的硫酸亚铁水溶液以保持盆土湿润。低温胁迫前将所栽的高山杜鹃幼苗先放入常温下连续培养10 d,然后选取生长一致的幼苗用于试验。
1.2.2 试验设计 本试验分别设置0、5、10、25 ℃这4个温度梯度处理高山杜鹃幼苗,其中以25 ℃作为对照温度。然后将试验材料分别放入设有不同温度的人工气候箱内,相对湿度为72%,每天光照处理12 h,光照强度约为1000 lx,黑暗处理12 h,连续培养6 d。经过低温胁迫后,分别采第1天、第2天、第3天、第4天、第5天的高山杜鹃叶片并进行处理,每个处理温度称取1.5~3.0 g除去主脉、健康生长无病害的叶片,分别测定高山杜鹃相关的生理指标,每次试验重复3次。
1.2.3 各项生理指标的测定 相对电导率测定参照陈建勋等[9]的电导仪法;游离脯氨酸含量测定参照许维岸[10]的茚三酮法;MDA含量的测定参照张志安等[11]的硫代巴比妥酸法;SOD活性的测定参照李合生[12]的氮蓝四唑(NBT)光还原法;POD活性的测定参照郝再彬等[13]的愈创木酚显色法;CAT活性的测定参照高俊凤[14]的紫外光谱法;可溶性蛋白含量的测定参照高俊凤[14]的考马斯亮蓝G-250法。
1.3 数据处理
所有处理每次测定重复3次,取3次测定值的平均值,用Excel 2010进行数据统计,用SPSS Statistics 17.0软件进行数据分析。
2 结果与分析
2.1 低温胁迫对高山杜鹃相对电导率的影响
由图1可知,与对照温度相比,其它温度处理下相对电导率均明显高于对照组,且温度越低增加幅度越大。而不同温度处理下,除对照组温度条件下电导率相对平稳外,随着时间延长相对电导率均呈现上升趋势,到处理第5天时,0、5、10 ℃下电导率与对照组25 ℃时相比,增加幅度分别达到90.11%、49.79%和27.07%,差异达显著水平(P<0.05)。
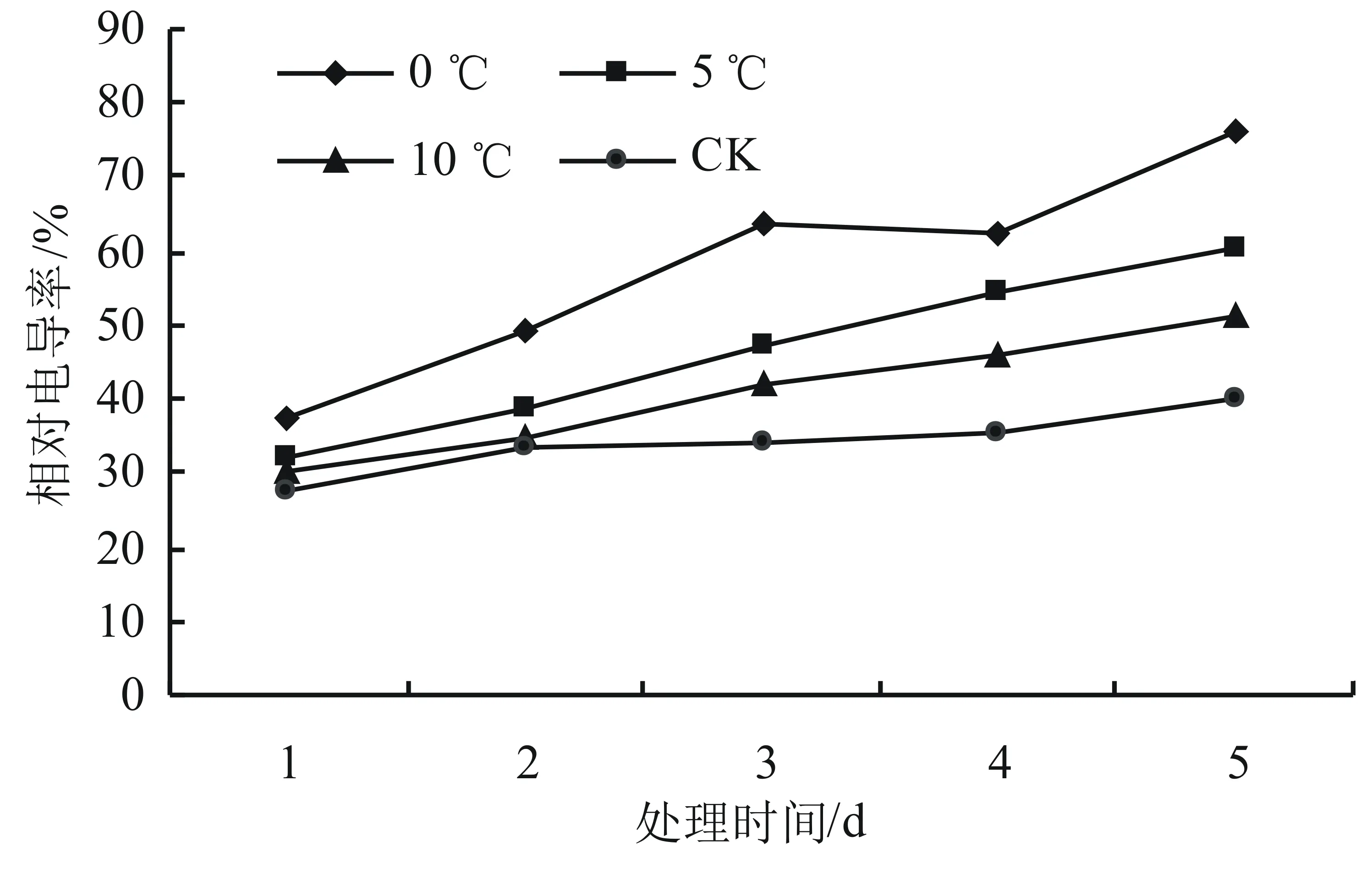
图1 低温胁迫对高山杜鹃相对电导率的影响
2.2 低温胁迫对高山杜鹃MDA含量的影响
由图2可知,高山杜鹃幼苗的MDA含量在相同温度下随着时间的增加而增加。而在同一时间的不同温度下,温度越低,MDA含量越高。0 ℃时MDA含量的变化最大,上升最快。与对照温度处理下的MDA含量相比,10 ℃处理下的MDA含量变化不显著(P>0.05);5 ℃处理下的MDA含量则显著增加(P<0.05),比对照增长了68.32%;而0 ℃处理下的MDA含量差异最为显著(P<0.05),与对照相比增加幅度为88.12%。
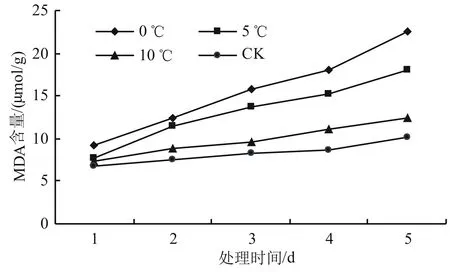
图2 低温胁迫对高山杜鹃MDA含量的影响
2.3 低温胁迫对高山杜鹃SOD、POD和CAT活性的影响
由图3可以看出,随着低温胁迫时间的延长,SOD的活性呈先升后降再上升的趋势,总体上呈现上升的趋势。在相同时间内,随着温度的降低,高山杜鹃幼苗叶片的SOD活性上升,第5天时0、5、10 ℃处理下杜鹃幼苗叶片的SOD活性显著高于室温处理下的SOD活性(P<0.05),与对照相比增加幅度分别为84.87%、54.38%和35.35%。由图4可以看出,POD活性总体呈上升趋势。对照温度下POD活性在第1天最高,0 ℃最低。而在第2天时,0 ℃时的POD活性增长最快,比第1天增长了43.21%,达到同一天不同温度处理下POD活性的最高值。总体上,在试验期间0 ℃时POD活性增长最快,比第一天增长了86.73%,差异显著(P<0.05);5 ℃和10 ℃下POD活性的增长趋势较为接近,对照温度下POD活性总体趋于稳定。由图5可以看出,随着温度的降低,CAT的活性增加,对照温度CAT活性变化比较稳定,在10 ℃时CAT活性的增加量较少,从第2天开始总体趋于稳定。0 ℃和5 ℃下CAT活性的变化趋势比较明显,增长较快,在第5天时比第1天时分别增长了78.45%和86.23%。

图3 低温胁迫对高山杜鹃SOD活性的影响
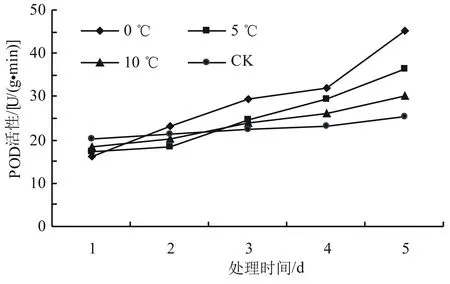
图4 低温胁迫对高山杜鹃POD活性的影响
2.4 低温胁迫对高山杜鹃可溶性蛋白含量的影响
由图6可知,在低温胁迫下,随着时间的延长,高山杜鹃幼苗的可溶性蛋白含量呈现上升趋势。就同一天来说,随着温度的降低,可溶性蛋白含量呈现上升的趋势,其中,低温0 ℃处理下效果最为显著(P<0.05),比对照增长了89.43%,在第2天至第3天上升最快,第3天时相对于对照组升高幅度最大,达86.51%。在10 ℃以下时,可溶性蛋白含量显著上升(P<0.05),5 ℃和0 ℃分别比对照增长了84.40%和89.43%。在对照温度下可溶性蛋白含量趋于稳定。

图5 低温胁迫对高山杜鹃CAT活性的影响
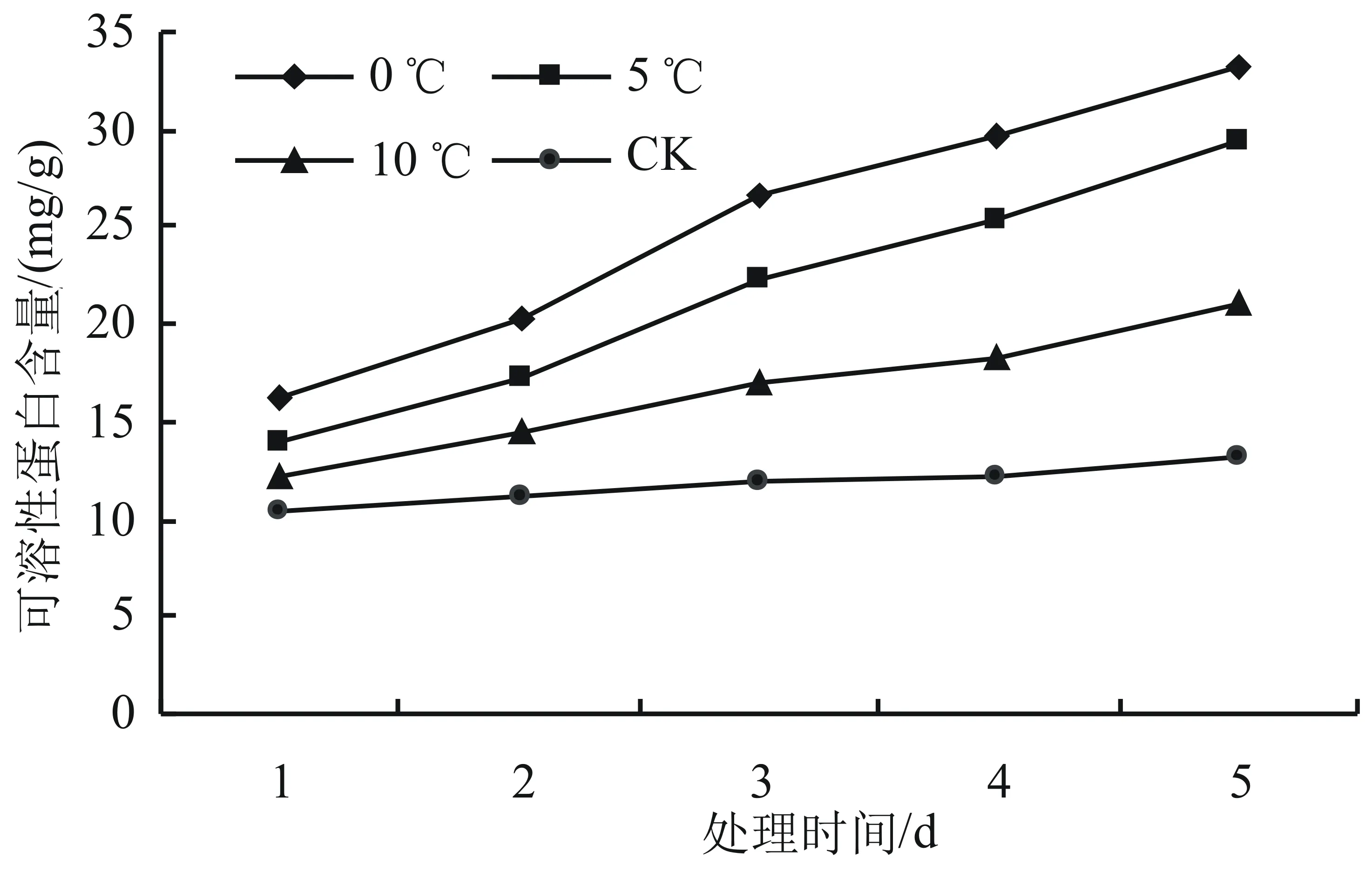
图6 低温胁迫对高山杜鹃可溶性蛋白含量的影响
2.5 低温胁迫对高山杜鹃游离脯氨酸含量的影响
由图7可知,低温胁迫下,游离脯氨酸含量总体呈现上升的趋势,但各温度下存在一定的差异。随着胁迫温度的降低,高山杜鹃幼苗游离脯氨酸含量增加,但增加量不显著。在相同温度下,随着胁迫时间的延长,游离脯氨酸含量缓慢增加,变化不明显。低温胁迫起始时,各低温处理与对照组的游离脯氨酸含量水平较低,5 d后0、5、10 ℃处理组的游离脯氨酸含量分别上升至190.1、170.8、153.4 μg/g,与对照相比增加幅度分别为50.51%、35.23%和21.46%,其中0 ℃效果最明显,与对照组差异最显著(P<0.05)。
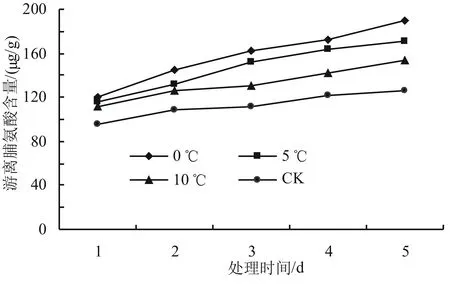
图7 低温胁迫对高山杜鹃游离脯氨酸含量的影响
3 讨论
低温作为植物生长发育的非生物胁迫因子之一,严重影响着植物体内的一系列生理生化过程,而植物则通过产生相应的抗逆性和耐逆性来适应外界环境的变化[15]。众多植物抗寒研究报道指出,在低温胁迫下,植物体内的可溶性蛋白含量、游离脯氨酸含量、保护酶活性等变化与植物抗寒性密切相关[16-18]。
细胞质膜是细胞最外面的一层界膜,对植物起到一定的保护作用,可以防止外界不良环境对植物组织结构的损伤。在低温胁迫下,植物细胞膜的选择透性遭到破坏,细胞内液外渗,进而导致相对电导率增大,且相对电导率值的大小与低温胁迫程度呈正相关,与植物抗寒能力的强弱呈负相关[19],本试验也进一步证实了此结论。高山杜鹃在对照温度(25 ℃)时相对电导率变化较为稳定,随着温度的降低,相对电导率变化程度增大。本试验中,在0 ℃时高山杜鹃相对电导率增长速度最快,同时也达到了最大值,原因是0 ℃低温造成了高山杜鹃幼苗细胞膜和原生质体的损伤,而且其损伤程度会随低温胁迫时间的延长而加重,进而造成高山杜鹃膜结构的破坏及膜功能的丧失。
丙二醛(MDA)是膜脂过氧化作用的主要产物之一。植物体内MDA含量的大小可作为判断膜系统损伤程度和植物抗逆性强弱的重要指标[20]。本试验中,随着低温胁迫温度的降低,高山杜鹃体内MDA含量呈上升趋势,在0 ℃时MDA含量增加幅度最大;在相同处理温度下随着时间的延长MDA含量升高,在第5天时高山杜鹃MDA含量达到最大值,与前人的研究结果[21]一致。MDA的含量在低温处理前两天增长比较缓慢,与对照相差不大,但是随着时间的延长,细胞膜脂质过氧化程度加深,导致膜结构和膜脂功能的损伤加剧,高山杜鹃体内MDA含量快速增长。
低温胁迫下,植物体内会积累过多的超氧自由基,从而造成植物体内膜脂过氧化作用增强、生物膜透性增加等伤害。植物体内的天然超氧自由基清除剂,主要包括超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT),它们可以清除逆境下植物体内积累的自由基,从而维持自由基的动态平衡[22]。总体来说,高山杜鹃体内SOD活性表现为先上升后降低再上升的趋势,低温胁迫初期,高山杜鹃体内SOD活性显著升高,随着胁迫程度的加强,SOD活性开始逐渐下降,而在第4、5天时SOD活性又继续上升。在整个试验过程中,SOD活性随着时间的延长而增加,在第5天时达到最大值。SOD活性随着温度的降低而升高,在0 ℃时增加幅度最大。过氧化物酶(POD)和过氧化氢酶(CAT)能够提高植物对低温环境的抗逆性,是因为POD和CAT能够催化过氧化物分解,降低对细胞膜的伤害作用。随着低温胁迫时间的延长,高山杜鹃体内POD和CAT的活性总体上呈现出逐渐上升的趋势。温度越低,POD和CAT活性越高,在0 ℃处理下,虽然高山杜鹃体内SOD、POD和CAT活性都有了较为明显的提高,但MDA含量的急剧上升仍会对高山杜鹃的正常生理代谢活动产生不良影响。而在5 ℃和10 ℃处理下,随着低温胁迫时间的延长,高山杜鹃体内MDA含量上升幅度较小,因此对植株的正常生长发育产生的伤害也较小。
可溶性蛋白在植物体内起着维持渗透调节及防止原生质体脱水的作用。在不同低温胁迫条件下,植物体内可溶性蛋白含量的高低与植物的抗逆性强弱呈正比[23]。本试验中,随着低温胁迫时间的延长高山杜鹃体内可溶性蛋白含量总体呈现上升趋势,10 ℃时可溶性蛋白含量随胁迫时间的延长增幅较小,0 ℃和5 ℃增幅较大,与熊燕等[23]的研究结果一致。
游离脯氨酸是植物体内重要的渗透调节物质之一。低温胁迫导致了植物原生质体脱水从而引发游离脯氨酸的累积,游离脯氨酸含量的升高可降低冰点,有效防止细胞脱水,稳定原生质体及组织内的代谢过程,从而保护植物细胞免受低温的伤害[24]。本试验中,随着低温胁迫时间的延长,高山杜鹃体内游离脯氨酸含量逐渐升高;随着胁迫温度的降低,高山杜鹃体内游离脯氨酸含量升高,在0 ℃时达到最大值,但是总体变化不大。
综上所述,秦岭高山杜鹃幼苗在不同低温胁迫条件下体内各项重要生理指标的变化结果表明,在5 ℃和10 ℃条件下其生长受到了不同程度的抑制,但仍具有一定抗性;0 ℃低温条件下生长受到严重影响,不利于植株正常生长发育;在25 ℃下生长较好,但具体适于高山杜鹃生长的温度还有待于进一步研究。
参考文献:
[1] 李璟琦,苏真,张晓静.秦岭杜鹃花属植物资源及其利用研究[J].中国农学通报,2012,28(22):303-307.
[2] 鲜小林,陈睿.温度与光强对高山杜鹃催花期间花芽营养物质积累的影响[J].西北植物学报,2015,35(5):991-997.
[3] 汪源,鞠波.中国野生杜鹃资源开发利用探讨[J].生物学杂志,2006,23(1):43-44.
[4] 江福英,李延,翁伯琦.植物低温胁迫及其抗性生理[J].福建农业学报,2002,17(3):190-195.
[5] 赵冰,杜宇科,付玉梅,等.镇安木王国家森林公园野生杜鹃花资源调查[J]. Journal of Landscape Research, 2010, 2(1): 54-56,61.
[6] 李淑顺,李倩中,唐玲,等.低温对高山杜鹃内源营养动态变化及休眠解除的影响[J].江苏农业学报,2011,27(4):853-857.
[7] 华智锐,李小玲.盐旱交叉胁迫对小麦种子萌发及幼苗保护酶活性的影响[J].江西农业学报,2017,29(2):18-23.
[8] Mohamed H B, Vadel A M, Geuns J M C, et al. Biochemical changes in dormant grapevine shoot tissues in response to chilling: possible role in dormancy release[J]. Scientia Horticulturae(Amsterdam), 2010, 124(4): 440-447.
[9] 陈建勋,王晓峰.植物生理试验指导[M].广州:华南理工出版社,2013:78-80.
[10] 许维岸.生物学综合实验指导[M].苏州:苏州大学出版社,2010:115-116.
[11] 张治安.植物生理学实验技术[M].长春:吉林大学出版社,2008:192-193.
[12] 李合生.植物生理生化实验原理与技术[M].北京:高等教育出版社,2000:167-169.
[13] 郝再彬,苍晶.植物生理实验[M].哈尔滨:哈尔滨工业大学出版社,2004:110-112.
[14] 高俊凤.植物生理学实验指导[M].北京:高等教育出版社,2006:228-231.
[15] 杨东,张红,陈丽萍,等.温度胁迫对10种菊科杂草丙二醛和可溶性糖的影响[J].四川师范大学学报:自然科学版,2007,30(3):391-394.
[16] 李叶云,庞磊,陈启文,等.低温胁迫对茶树叶片生理特性的影响[J].西北农林科技大学学报:自然科学版,2012,40(4):134-138,145.
[17] 张静,朱为民.低温胁迫下番茄细胞膜保护酶活性的变化[J].江苏农业科学,2012,40(6):121-124.
[18] 许桂芳,张朝阳,向佐湘,等.利用隶属函数法对4种珍珠菜属植物的抗寒性综合评价[J].西北林学院学报,2009,24(3):24-26.
[19] 田丹青,葛亚英,潘刚敏,等.低温胁迫对3个红掌品种叶片形态和生理特性的影响[J].园艺学报,2011,38(6):1173-1179.
[20] 吴海宁,罗兴录,樊吴静.低温胁迫对不同木薯品种幼苗生理特性的影响[J].南方农业学报,2013,44(11):1791-1799.
[21] 余丽玲,何天友,陈凌艳,等.人工低温胁迫下西洋杜鹃生理生化指标的变化[J].农学学报,2014,4(1):48-53.
[22] 马兰涛,陈双林,李迎春.低温胁迫对Guaduaamplexfolia抗寒性生理指标的影响[J].林业科学研究,2008(2):235-238.
[23] 熊燕,曲彦婷,唐焕伟,等.低温胁迫及不同基质对高山杜鹃生理和根系活力的影响[J].东北农业大学学报,2013,44(10):117-121.
[24] Siddig K, Ebert G, Ladders P. Tamarind (TamarindusindicaL.): A review on a multipurpose tree with promising future in the Sudan[J]. Angewandte Botanik, 2012, 73(5/6): 202-205.
