培土生金法对肺脾两虚型慢性阻塞性肺疾病模型大鼠血清Ghrelin、Obestatin及相关指标的影响
2018-05-09孙杰桑凯王东晓张旭辉马泉柳志清
孙杰 ,桑凯 ,王东晓 ,张旭辉 ,马泉 ,柳志清
1.甘肃中医药大学,甘肃 兰州 730000;2.甘肃中医药大学附属医院,甘肃 兰州 730020
慢性阻塞性肺疾病(Chronic obstructive pulmonary disease,COPD)是一种可以预防和治疗的疾病,与气道和肺组织对烟草烟雾等有害气体或有害颗粒的慢性炎性反应增强有关,其特征是持续存在呈进行性发展的气流受限。据全球疾病负担研究项目组估计,2020年COPD将位居全球死亡原因的第3位[1]。生长激素释放肽(Ghrelin)与肥胖抑制素(Obestatin)是新近发现的脑肠肽,是由胃分泌的重要食欲和能量调节肽,参与机体代谢调节[2]。研究显示 Ghrelin、Obestatin与COPD合并营养不良关系密切[3~4],其与系统炎症及细胞因子之间相互作用参与COPD合并营养不良的发病。研究发现培土生金法配合常规西药治疗可进一步提高肺脾气虚型COPD患者的中医证候疗效及降低生活质量评分,改善患者肺功能及营养状态[5],但其作用机制尚未阐明。本实验参照文献[6~7]制作肺脾两虚型COPD大鼠模型,用ELISA法检测参苓白术散不同时间干预下对肺脾两虚型COPD模型大鼠血清Ghrelin、Obestatin、瘦素及炎症因子的含量变化,观察培土生金法防治COPD的时空效应,并进一步探讨其对COPD的防治机理。
1 材料与方法
1.1 实验动物 SPF级Wistar大鼠60只,雌雄各半,体质量(200±20)g,由甘肃中医药大学科研实验中心提供,实验动物质量合格证编号SCXK(甘)2015-0002,动物实验设施使用证编号:SYXK(甘)2015-0005,实验动物生产批号:No.62001000000270。动物饲养于甘肃中医药大学SPF级实验室,环境温度(23±3)℃,相对湿度30%~40%。
1.2 主要试剂与仪器 脂多糖(美国Sigma公司);兰州牌香烟(甘肃烟草工业有限责任公司,焦油量14 mg,烟气烟碱量1.1 mg,烟气一氧化碳量14 mg);血清Ghrelin检测试剂盒(上海源叶生物科技有限公司);血清Obestatin检测试剂盒、血清瘦素检测试剂盒、血清TNF-α检测试剂盒、血清IL-1检测试剂盒均购自上海源叶生物科技有限公司;酶标仪(BIO-RAD公司,型号:iMark 1509);Hallowell EMC气管插管工具盒(美国Braintree Scientific公司);HCT气溶胶烟雾染毒系统(美国CH Technologies公司,型号:GYD-CHT);生物信号采集系统(法国EMKA公司)。
1.3 实验药物 番泻叶浸液:番泻叶购于甘肃中医药大学附属医院门诊中药房,浸泡12 h,绞汁过滤,装入烧杯,置于40℃恒温水浴箱,浓缩至含生药1 g/mL,4℃冰箱保存。参苓白术散(人参、茯苓、白术、山药、甘草各20 g,莲子、砂仁、薏苡仁、桔梗各12 g,白扁豆15 g),按原方比例配伍组成,实验选用广东一方制药有限公司生产的免煎颗粒剂(批号:0503014)。
1.4 分组及造模 60只大鼠适应性喂养7天后,随机分为5组:空白组、模型组、药物干预组(根据药物干预时间不同,分为参苓白术散28天、35天、42天组),每组12只。参照宋一平等[6~7]动物模型复制法建立肺脾两虚型COPD大鼠模型。第1天、14天,经口、气管滴注脂多糖(LPS),将麻醉后大鼠四肢、头部呈仰卧位固定于鼠板,将大鼠上门齿向后牵拉固定,使气管伸直,暴露口腔,将喉镜插入大鼠口腔,于吸气相迅速将气管插管插入气道。在1 mL针管内先抽入相应量溶于生理盐水的LPS(1 mg/mL),于大鼠吸气瞬间迅速推注LPS(大鼠用量1 mg/kg)。再向气管内迅速推注0.5 mL气体1~2次以使LPS充分分布于肺组织内。拔出针管,轻拍大鼠胸背部,并轻轻抖动,使药物均匀分布于肺内。第2~28天、35天、42天,每天上午将大鼠放于气溶胶染毒系统内烟熏30 min,2次(滴注LPS当天不烟熏,空白组呼吸空气)。自造模第7天起在熏烟前0.5 h给予浓度1 g/mL冰冷番泻叶浸液,按10 mL/kg剂量,连续灌胃至28天、35天、42天。参苓白术散与番泻叶灌胃时间间隔>4 h,为避免药物间药效相干扰,时间间隔应超过大鼠胃排空时间。
1.5 干预方法 实验药物用量按体表面积比率换算,参苓白术散大鼠用量为14.67 g/(kg·d),空白组及模型组给予等容量生理盐水灌胃。每天1次,连续灌胃干预至28天、35天、42天。
1.6 标本采集与处理 实验过程中观察大鼠活动度、毛发光泽、体质量、摄食量、呼吸、咳喘、大便等情况。分别于第28天、35天、42天对相应组大鼠麻醉后取血。打开腹腔,暴露腹主动脉,经腹主动脉采血4~6 mL,20℃、3 000 r/min,离心15 min,制备血清,分装于EP管中,待做ELISA检测。具体步骤按试剂盒说明书进行。
1.7 指标检测 观察各组大鼠一般状态(皮毛光泽度、饮食情况、体质量变化、活动度、精神状态、粪便)及大鼠气管和呼吸道分泌物等情况。取大鼠左肺及胃组织在常规多聚甲醛溶液中固定,脱水,石蜡包埋,切片,HE染色,观察肺组织病理形态学改变。分别于实验第28天、35天、42天对各组大鼠进行肺功能测定。腹腔注射10%水合氯醛(3 mL/kg)麻醉大鼠,将麻醉后大鼠固定于鼠板上,用大鼠喉镜经口-气管插管法,插入气管插管并固定置于体描箱中,将插管一端连接生物信号采集系统传感器,与之配套的计算机软件相应功能区自动描记呼吸曲线,测定大鼠呼吸频率F(每只观测3 min,F取其平均值)、肺容量指标TV、流量指标EF50、肺动态顺应性Cdyn。采用ELISA法检测大鼠血清中Ghrelin、Obestatin、瘦素、IL-1、TNF-α的含量。
1.8 统计学方法 采用SPSS19.0统计软件处理,符合正态分布且方差齐性的计量资料以(x±s)表示,组间比较采用单因素方差分析,方差齐用LSD法检验,方差不齐用Dunnett法,进行均数间两两比较。
2 结果
2.1 各组大鼠一般情况比较 见表1。在造模过程中模型组、参苓白术散42天组大鼠各死亡2只,参苓白术散28天组、参苓白术散35天组大鼠各死亡1只。空白组大鼠发育良好,反应灵敏,精神状况好,皮毛亮泽,纳食正常,体质量渐增;模型组大鼠形体消瘦,皮毛枯槁无泽或有脱落、可见竖毛,精神不振,反应迟钝,少食,扎堆蜷缩拱背,呼吸急促,咳嗽,偶可闻及气道痰鸣音,口鼻分泌物增多,体质量明显下降,腹泻便溏,粪质稀薄。与模型组比较,各药物干预组大鼠症状不同程度减轻,精神状况较好,皮毛欠润泽,口鼻分泌物减少,活动尚灵活,摄食量尚可,呼吸稍平稳,偶有咳喘。与空白组比较,模型组大鼠体质量减轻,差异有统计学意义(P<0.05);与模型组比较,参苓白术散35天组和参苓白术散42天组大鼠体质量均有升高,差异均有统计学意义(P<0.05)。

图1 各组大鼠肺组织病理形态观察(×200)

表1 各组大鼠体质量比较(x±s) g
2.2 各组大鼠肺、胃组织病理形态学改变 见图1,见图2。空白组大鼠支气管管壁及肺泡结构完整,肺泡腔及支气管腔内无渗出物,间质未见炎性细胞浸润。模型组大鼠肺组织支气管壁及附近炎性细胞广泛浸润,气管壁结构损伤,肺泡结构紊乱或断裂融合成大气腔。与模型组比较,参苓白术散28天组大鼠支气管黏膜充血、水肿情况较轻,炎性浸润改善,肺泡腔扩张和肺泡壁断裂、融合的范围和程度均较轻,其病理状况改善明显;参苓白术散35天组大鼠肺间质炎性浸润明显减轻,杯状细胞较少见;参苓白术散42天组大鼠肺间质炎性浸润显著改善,管壁增厚减轻,肺泡数目增加,结构相对完整,提示经药物干预可显著减轻大鼠肺组织病理改变程度,延缓COPD病程。空白组大鼠胃黏膜层结构完整,模型组大鼠出现黏膜充血与水肿,固有层与黏膜下层可见炎性细胞浸润,各药物干预组可见胃黏膜充血水肿不同程度减轻,炎性浸润改善明显。

图2 各组大鼠胃组织病理形态观察(×400)
2.3 各组大鼠肺功能比较 见表2。与空白组比较,模型组大鼠呼吸频率F升高,TV、EF50、Cdyn均明显降低,差异均有统计学意义(P<0.05)。与模型组比较,参苓白术散28天、35天、42天组大鼠呼吸频率F下降,TV、EF50、Cdyn不同程度升高,差异均有统计学意义(P<0.05)。与参苓白术散28天组比较,参苓白术散42天组大鼠F值下降,Cdyn升高,差异有统计学意义(P<0.05)。

表2 各组大鼠肺功能比较(x±s)
2.4 各组大鼠血清Obestatin、Ghrelin、瘦素含量比较 见表3。与空白组比较,模型组大鼠血清中Obestatin、Ghrelin含量明显减少,瘦素含量明显升高,差异均有统计学意义(P<0.05)。与模型组比较,参苓白术散28天、35天、42天组大鼠血清中Obestatin、Ghrelin含量不同程度升高,瘦素含量不同程度下降,差异均有统计学意义(P<0.05)。与参苓白术散28天组比较,参苓白术散42天组Obestatin含量升高,差异有统计学意义(P<0.05)。

表3 各组大鼠血清Obestatin、Ghrelin、瘦素含量比较(x±s)pg/mL
2.5 各组大鼠血清IL-1、TNF-α含量比较 见表4。与空白组比较,模型组大鼠血清IL-1、TNF-α水平明显升高,差异有统计学意义(P<0.05)。与模型组比较,参苓白术散28天、35天、42天组大鼠血清TNF-α、IL-1含量均有不同程度的降低,差异有统计学意义(P<0.05)。与参苓白术散28天组比较,参苓白术散42天组大鼠TNF-α含量降低,差异有统计学意义(P<0.05)。
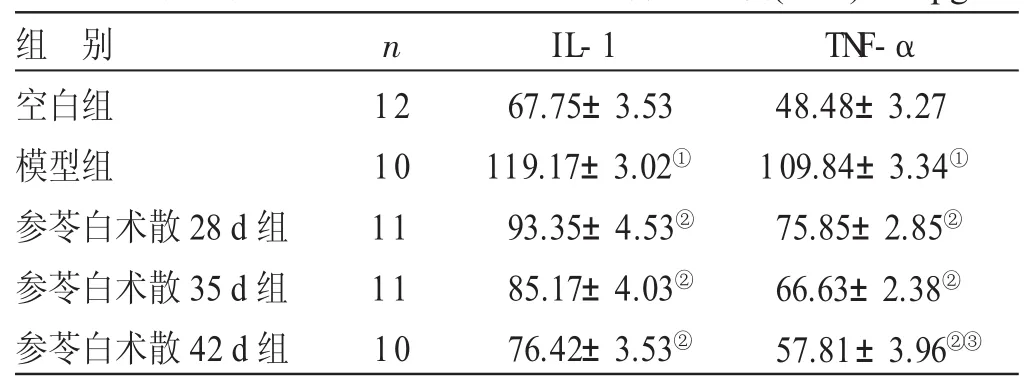
表4 各组大鼠血清IL-1、TNF-α含量比较(x±s) pg/mL
3 讨论
Ghrelin是一种新型的脑肠肽,主要由胃底部黏膜处泌酸腺细胞X/A合成并分泌,为生长激素促分泌物受体(GHSR)的内源性配体。它在人体的胃、十二指肠、结肠和大脑皮层都有表达,且部分产生于下丘脑弓状核、垂体、肾脏、胎盘等组织[8],其在下丘脑和胃底部的表达量最多[9]。Ghrelin是一种胃源性促食激素,分泌到血液中,通过激活下丘脑亚科核中的NPY/AgRP神经元启动摄入食物,可以起到刺激饮食、增加体质量、维持机体能量稳态的作用[10]。Obestatin是一种多效肽,其通过抑制胃肠道的运动,调节胰岛素的分泌,减少炎症和凋亡以及促进增殖,对Ghrelin起拮抗作用[11],广泛分布于大肠、小肠、胃、脾和大脑皮层[12],其中胃组织含量最高。瘦素作为脂肪组织分泌的最相关的因子,具有调节食欲和食物摄取、基础代谢、生殖功能和胰岛素分泌等功能[13],研究显示瘦素的高水平表达可抑制Ghrelin释放[14]。本实验中模型组大鼠血清中Ghrelin表达下降,或许是由两方面造成的,一方面,胃黏膜充血水肿,炎性细胞浸润,使得Ghrelin分泌不足;另一方面,COPD本身存在的全身炎症反应及高瘦素水平抑制了Ghrelin的表达,而Obestatin作为其拮抗肽,也相应减少。
中医学中并没有COPD的病名,但从其临床表现及病变过程来看,属于中医咳嗽、喘证及肺胀等范畴。笔者认为以培土生金法治疗COPD具有坚实的中医藏象理论和脏腑病机理论依据。治疗过程中见肺之病先实脾,脾气健,则宗气生化有源。参苓白术散是体现“培土生金”治法的代表方,方中以四君子汤为基础,用人参大补元气,补肺益脾;白术补气健脾;山药益气养阴,肺脾肾同补;茯苓、扁豆、莲肉补脾渗湿;砂仁醒脾;桔梗升清,宣肺利气。综观全方,补肺气,健脾气,培土生金,兼以渗湿浊,行气滞。笔者临床观察发现,稳定期COPD营养不良患者多表现为咳嗽、喘息、气短等肺气虚证候,兼有神疲食少、胃脘痞满、便溏纳呆等脾虚证候,中医辨证属肺脾两虚证,故以此方治疗COPD,契合病机。本实验显示在参苓白术散的干预下,COPD大鼠体质量增加明显,肺功能改善,肺组织及胃组织病理变化减轻,并且随着干预时间的增加,其症状改善明显;同时,干预组大鼠血清瘦素明显下降,炎症因子IL-1、TNF-α含量减少,这提示在胃组织病理变化改善的基础上,参苓白术散可抑制血清瘦素的表达,从而使Ghrelin及Obestatin含量增加,从这点解释,培土生金法可改善模型组大鼠一般状况及营养状况,很有可能是通过调节血清中Ghrelin及Obestatin水平,保持能量平衡而实现的。其调节Ghrelin及Obestatin的机制,则是胃黏膜的修复及血清中瘦素与炎症因子的降低。同时,本实验结果显示,在各药物干预组中,随着时间的增加,COPD大鼠的症状改善越明显,且有统计学意义(P<0.05),这表明培土生金法的早期应用对COPD大鼠有保护作用,并且在COPD发生后的发展过程中也能起到重要作用,进一步提示了培土生金法对COPD的防治作用。
综上所述,培土生金法代表方参苓白术散可增加肺脾两虚型COPD模型大鼠体质量,改善其肺功能,减轻肺组织病理损伤,改善其营养状态,机制可能是上调肺脾两虚型COPD大鼠血清Ghrelin、Obestatin的表达及下调血清中瘦素及炎症因子的表达。
[参考文献]
[1]中华医学会呼吸病学分会慢性阻塞性肺疾病学组.慢性阻塞性肺疾病诊治指南(2013年修订版)[J].中国医学前沿杂志:电子版,2014,6(2):67-80.
[2]Emami A,Nazem R,Hedayati M.Is association between thyroid hormones and gut peptides,Ghrelin and Obestatin,able to suggest new regulatory relation between the HPT axis and gut?[J].Regulatory Peptides,2014,189:17-21.
[3]徐志松,包子予,王志英,等.慢性阻塞性肺疾病患者生长激素释放肽、生长激素、生长激素释放激素的变化及其临床意义[J].中华内科杂志,2012,51(7):536-539.
[4]Yi Lei,Yasha Liang,Yifan Chen,et al.Increased circulating Obestatin in patients with chronic obstructive pulmonary disease[J].Multidiscip Respir Med,2014,9(1):5.
[5]李航,黄慧婷,詹少锋,等.培土生金法治疗慢性阻塞性肺疾病稳定期疗效的Meta分析[J].广州中医药大学学报,2017,34(1):132-139.
[6]宋一平,崔德健,茅培英,等.慢性阻塞性肺疾病大鼠模型的建立及药物干预的影响[J].中华内科杂志,2000,139(8):556-557.
[7]张伟,宫静,张靖轩,等.一种肺脾两虚型慢阻肺动物模型的建立[J].辽宁中医杂志,2009,36(1):142-143.
[8]Inhff T,Mönnikes H,Noetzel S,et al.Desacyl Ghrelin inhibits the orexigenic effect of peripherally injected Ghrelin in rats[J].Peptides,2008,29(12):2159-2168.
[9]付荣国,袁浩铮,王莉,等.慢性肾功能不全大鼠下丘脑、胃肠道Ghrelin及其受体表达变化[J].南方医科大学报,2011,31(1):96-99.
[10]Andrews ZB.Central mechanisms involved in the orexigenic actions of Ghrelin[J].Peptides,2011,32(11):2248-2255.
[11]Xing YX,Yang L,Kuang HY,et al.Function of Obestatin in the digestive system[J].Nutrition,2017,34:21-28.
[12]Asakawa A, Inui A, Ksga T, et al.Ghrelin is appetite stimulatory signal from stomach with structural resemblance to motilin[J].Gastroenterology,2001,120:337-345.
[13]Pérez-Pérez A,Vilariño-García T,Fernández-Riejos P,et al.Role of leptin as a link between metabolism and the immune system[J].Cytokine&Growth Factor Reviews,2017,35:71-84.
[14]Briggs DI, Lockie SH, Benzler J, et al.Evidence that diet-induced hyperleptinemia,but not haypothalamic gliosis,causes Ghrelin resistance in NPY/AgRP neurons ofmale mice[J].Endocrinology,2014,155(7):2411-2422.
