水杨酸诱导苹果采后灰霉病抗性研究
2018-05-08石亚莉周会玲唐永萍贺军花马利菁
石亚莉,周会玲,唐永萍,贺军花,马利菁
(西北农林科技大学 园艺学院,陕西 杨凌 712100)
苹果口感爽脆,酸甜可口,果实中含有丰富的碳水化合物、维生素和微量元素,具有较高的营养价值[1]。苹果贮藏和运输过程中易受到病原菌浸染,导致果实腐烂,造成严重的经济损失。其中灰霉病是常见的侵染性病害,其致病菌灰葡萄孢以分生孢子和菌核随病残体越冬,次年分生孢子借气流传播,病原菌经昆虫及机械操作造成的伤口或采后果实伤口侵入,还可在苹果早期生长季侵染花萼,病害潜伏至贮藏期开始发病[2-3]。由于灰葡萄孢耐低温能力强,在冷藏条件下仍可缓慢扩展,因此较难得到有效防治。
随着对采后病害控制由浅到深的研究,在物理治疗[4-7]、化学杀菌剂[8-9]、植物提取物[10-11]、拮抗剂[12]等防治方法中,诱导植物增强抗病性逐渐成为研究重点。水杨酸(Salicylic acid,SA)是一种简单的酚类化合物,普遍存在于植物体内,可作为激活系统获得抗病性(SAR)的内源信号分子,增强植物防御保护机制,在植物抗病反应中起着重要的诱导作用。Zhu等[13]研究发现,SA通过诱导H2O2和防御相关代谢物的合成积累,抑制病原菌扩展,显著降低采后柑橘果实腐烂率。采前用SA喷施处理杏果实,可显著降低果实黑斑病的发病率,同时果实中苯丙烷代谢关键酶活性升高,从而增强杏果对采后黑斑病的抗性[14]。也有研究发现,SA结合超声波处理,可提高芒果果肉组织中PAL、POD、CHI和GLU活性,促进总酚积累,有效抑制芒果采后炭疽病[15]。Rocha等[16]研究发现,外源SA显著抑制常温和低温贮藏苹果青霉菌扩展,减少失重率,保持果实可溶性固形物和可滴定酸含量,增强果实保鲜效果。
目前关于SA对苹果采后灰霉病抑制作用鲜有报道,对其作用机理还有待进一步研究。为此,本研究以红富士苹果为材料,研究SA处理后灰霉病发生情况及抗病性相关指标的变化,探讨SA对苹果采后灰霉病抗性的诱导机理,为SA在苹果采后病害防治方面的应用提供理论依据。
1 材料与方法
1.1 供试材料及处理
供试红富士(Maluspumilacv.‘Fuji’)苹果采自西北农林科技大学白水苹果试验站,挑选大小均匀、成熟度一致、无病害浸染、无机械损伤的果实,用发泡膜包裹后放入纸箱,当天运回实验室。根据前期预试验结果采用150 mg/L SA溶液(含体积分数0.05% Tween 20)浸泡果实,20 min后取出在20 ℃室温下放置2 d后进行灰霉病菌接种,以清水(含体积分数0.05% Tween 20)处理作为对照。
灰葡萄孢(BotrytiscinereaPers)由西北农林科技大学植物保护学院提供,在马铃薯培养基上25 ℃恒温培养10 d,然后用含体积分数0.05% Tween 80的无菌水冲洗,采用血球计数板法将其孢子悬浮液的浓度配制成2×106mL-1。
1.2 主要仪器与试剂
BCD-236DT型冰箱,青岛海尔股份有限公司;KQ-500DB数控超声波清洗器,昆山市超声仪;3K15型高速冷冻离心机,美国Sigma公司; UV-1800型紫外-可见分光光度计,科大中佳公司;AUY220分析天平,日本岛津公司。
水杨酸、十二水合磷酸氢二钠、二水合磷酸二氢钠、聚乙烯吡咯酮(PVP)、聚乙二醇辛基苯基醚(TritonX-100)、邻苯二酚、愈创木酚、30%过氧化氢、冰醋酸、无水乙酸钠、柠檬酸、L-蛋氨酸(MET)、氮蓝四唑(NBT)、三氯乙酸(TCA)、2-硫代巴比妥酸(TBA)、几丁质(Sigma产品)、脱盐蜗牛酶、对二甲氨基苯甲醛(DMAB)、N-乙酰葡萄糖胺、抗坏血酸、昆布多糖、葡萄糖均为分析纯。
1.3 试验方法
先用体积分数75%酒精擦拭果实表面,然后用直径3 mm已灭菌的不锈钢钉沿果实赤道刺入3个伤口(3 mm× 3 mm),分别接种20 μL 2×106mL-1灰霉病菌灰葡萄孢的孢子悬浮液。稍干后常温条件下放置,果蒂朝上,果实之间留3~4 mm距离以防交叉感染。每天统计果实发病率,测量病斑直径,采集病斑周围1 cm左右健康果肉,经液氮迅速冷冻后用锡箔纸包裹,保存于-80 ℃超低温冰箱中,用于抗病指标测定。每处理用果80个,重复3次。
1.4 测定指标及方法
1.4.1 发病率 接种处病斑直径扩展0.5 mm则视为发病,发病率=发病伤口数/总接种伤口数×100%。
1.4.2 病斑直径 采用十字交叉法测定病斑,游标卡尺测量病斑直径,取每个处理发病伤口的病斑直径平均值。
1.4.3 过氧化物酶(POD)和多酚氧化酶(PPO)活性 POD活性测定采用愈创木酚法[17],取1.0 g左右果肉样品置于研钵中,加入5 mL pH 7.8的50 mmol/L磷酸缓冲液,冰浴条件下充分研磨成匀浆,于4 ℃、12 000g下离心30 min,离心上清液作为反应体系的粗酶提取液。然后取3 mL 25 mmol/L愈创木酚加入200 μL 0.5 mol/L H2O2,再加入0.5 mL粗酶提取液,将反应体系混匀后在470 nm下测定吸光度值(OD值)(单波长动力曲线,反应延迟15 s,反应时间为195 s),POD活性(U/(g·min))=ΔOD/t,其中ΔOD代表吸光度值的变化,t代表反应时间(min),重复测定3次。
PPO活性测定采用邻苯二酚法[17],粗酶提取液的方法与POD相同,50 mmol/L邻苯二酚用pH 5.0的磷酸柠檬酸缓冲液配制,反应体系为2.9 mL邻苯二酚加200 μL粗酶提取液,混匀后在420 nm下测定OD值(单波长动力曲线,反应延迟15 s,反应时间为195 s),PPO活性(U/(g·min))=ΔOD/t,其中ΔOD代表吸光度值的变化,t代表反应时间(min),重复测定3次。
1.4.4 苯丙氨酸解氨酶(PAL)活性 参考周晓婉等[18]的方法,略有改动。称取1.0 g左右果肉,加入5.0 mL 0.1 mol/L pH 8.8的硼酸缓冲液,冰浴条件下研磨成匀浆,于4 ℃、12 000g下离心30 min,上清液即为粗酶提取液。以每小时每克果肉组织酶促反应体系吸光度值增加0.01为1个PAL活性单位(U),重复测定3次。
1.4.5 几丁质酶(CHI)活性 参考姜微波等[17]的方法,略有改动。取2.0 g左右果肉,加入2.0 mL预冷的0.1 mol/L pH 5.2乙酸-乙酸钠缓冲液(含1 mmol/L EDTA和5 mmol/L β-巯基乙醇)冰浴条件下研磨至匀浆,然后于4 ℃、12 000g下离心30 min,取上清液作为CHI活性测定的粗提取液。以每秒每克果肉样品中酶分解胶状几丁质产生1×10-9mol N-乙酰葡萄糖胺为1个几丁质酶活性单位(U),重复测定3次。
1.4.6 β-1,3-葡聚糖酶(GLU)活性 参考Cao[19]的方法,略有改动。称取1.0 g左右果肉,加入1.0 mL经4 ℃预冷的0.1 mol/L pH 5.2乙酸缓冲液(含1 g/L抗坏血酸、1 mmol/L EDTA和5 mmol/L β-巯基乙醇)冰浴下研磨至匀浆,然后于4 ℃、12 000g离心30 min,其上清液作为酶活性测定的提取液。以每秒每克果肉中酶分解昆布多糖产生1×1-9mol葡萄糖为1个β-1,3-葡聚糖酶活性单位(U),重复测定3次。
1.4.7 总酚和类黄酮含量 参考张晓晓等[20]的方法,分别测定总酚和类黄酮在280,320 nm处的吸光度值,计算总酚和类黄酮含量。
1.4.8 丙二醛(MDA)含量 参考高俊凤[21]的方法测定,略有改动。称取1.0 g果肉粉末样品,加入5.0 mL 200 g/L三氯乙酸(TCA)溶液,在冰浴条件下研磨,于4 ℃、12 000g离心30 min,取上清液1 mL加入4 mL体积分数0.5%硫代巴比妥酸混匀,沸水浴中加热20 min,取出立即置于冰水中冷却,再于4 ℃、10 000g离心10 min。测定上清液在532,600和450 nm处的吸光度值,以体积分数0.5%硫代巴比妥酸作为空白调零,重复测定3次。
1.5 数据处理
采用Excel 2007软件进行数据处理和做图,数据方差分析应用SPSS 17.0软件,邓肯氏多重比较法分析差异显著性。
2 结果与分析
2.1 SA处理对苹果采后灰霉病的抑制效果
发病率和病斑直径是体现果实病害发展程度的重要指标。采后SA处理对苹果灰霉病发病率的影响如图1所示。由图1可知,接种灰霉病菌后,对照和SA处理均在第1天发病,但对照发病率显著高于SA处理,此时对照发病率为40.34%,而SA处理仅为23.68%;之后对照发病率迅速增加,至第3天发病率达到100%,SA处理果实的发病率在第4天达到最大(100%)。接种后3 d内,对照果实发病率均显著高于SA处理(P<0.05)。
采后SA处理对苹果灰霉病病斑直径的影响如图2所示。图2显示,随着接种后时间的延长,病害逐渐加重,病斑直径不断增大。SA处理果实病斑直径显著低于对照。感病前期(0~3 d),病斑直径增加幅度较小;感病3 d后病斑直径迅速扩大。常温放置9 d,对照病斑直径达到41.03 mm,SA处理仅为35.11 mm,且二者差异显著(P<0.05)。综合图1和图2可知,SA处理能够降低接种前期苹果果实的发病率,并抑制感染灰霉病果实的病斑扩展,明显增强红富士苹果对灰霉病的抗性。

图柱上标不同小写字母表示在同一接种时间下 不同处理间差异显著(P<0.05) Different lowercase letters mean significant difference between treatments at same inoculation time (P<0.05)
2.2 SA处理对接种灰霉病菌苹果果实PPO、POD和PAL活性的影响
PPO能催化植物体内酚类物质氧化,起毒害病原菌的作用,并能控制病原微生物的繁殖和侵染。如图3所示,接种灰霉病菌后苹果PPO活性均呈先升高后降低的趋势。随着病害发展,接种后SA处理果实PPO活性迅速增加,于第4天出现峰值,此时SA处理PPO活性是对照的1.24倍(P<0.05)。与SA处理相比,对照PPO活性高峰延后2 d,且峰值显著低于SA处理。观察发现接种后第6天两者PPO活性都开始降低,但SA处理PPO活性始终高于对照。这说明SA处理显著增强苹果果实PPO活性。
果蔬体内许多防御酶如PAL、PPO、POD等都有参与或催化抗性物质合成的作用。采后SA处理对接种灰霉病菌苹果果实POD活性的影响见图4。

图3 采后SA处理对接种灰霉病菌苹果 果实PPO活性的影响Fig.3 Effect of postharvest SA treatment on PPO activity of apple fruit inoculated with Botrytis cinerea
由图4可知,接种灰霉病菌后苹果果实中POD活性总体呈先上升后缓慢下降的趋势。接种1 d后,SA处理POD活性迅速升高,并在第3天达到最大值,此时POD活性是对照的1.46倍;之后POD活性开始缓慢降低。接种后0~3 d,SA处理POD活性显著高于对照;接种后4~9 d,对照与SA处理POD活性差异不显著(P>0.05)。在整个观察周期内,对照POD活性变化不大,但SA处理始终高于对照,说明SA可诱导苹果果实POD活性提高。
PAL作为果蔬丙烷类代谢途径的关键酶和限速酶,与果蔬抗性密切相关。采后SA处理对接种灰霉病菌苹果果实PAL活性的影响见图5。

图5 采后SA处理对接种灰霉病菌苹果 果实PAL活性的影响Fig.5 Effect of postharvest SA treatment on the activity of PAL of apple fruit inoculated with Botrytis cinerea
由图5可知,接种后1~3 d,对照和SA处理苹果果实PAL活性均呈升高趋势,其中SA处理和对照PAL活性高峰均在第3天出现,且SA处理较对照PAL活性提高了43.48%;接种后3~7 d,对照和SA处理PAL活性呈下降后上升趋势,且在第7天两者PAL活性又出现了小高峰;之后SA处理PAL酶活性一直降低,而对照PAL活性则先降后升。在
整个观察周期内,SA处理PAL活性一直高于对照,表明SA可增强苹果果实的PAL活性。
2.3 SA处理对接种灰霉病菌苹果果实CHI、GLU活性的影响
在植物抗病防御体系中,2种与病程相关的蛋白CHI和GLU起着重要的作用,其中CHI是一种水解酶,可通过破坏真菌菌丝尖端新合成的几丁质而抑制病原菌生长。SA处理对接种灰霉病菌苹果果实CHI、GLU活性的影响如图6和图7所示。由图6可知,果实中CHI活性整体上呈先迅速升高后缓慢下降的趋势。接种灰霉病菌后,果实中CHI活性迅速上升,且对照和SA处理CHI活性都在接种后第3天达到峰值,此时SA处理为对照的1.42倍;此后SA处理CHI活性开始下降,而对照接种第5天之后CHI活性变化不大。在整个观察周期内, SA处理CHI活性始终高于对照,且二者差异显著(P<0.05)。
GLU不但能抑制真菌菌丝生长,而且还可作为释放真菌细胞壁的诱导物,从而间接促进寄主体内植保素累积,增强植物体的抗病能力[22]。由图7可知,接种灰霉病菌后SA处理GLU活性均迅速增加,在第4天达到第1个峰值,相比对照提高了24.40%,第5天下降,之后GLU活性升高,并于第6天达到第2个峰值,且高于第1个峰值;随后GLU活性呈迅速下降趋势。对照GLU活性呈波浪式变化,出现了3个峰值。接种后1~9 d,对照GLU活性均低于SA处理。

图6 采后SA处理对接种灰霉病菌苹果 果实CHI活性的影响Fig.6 Effect of SA treatment on CHI activity of apple fruit inoculated with Botrytis cinerea
2.4 SA处理对接种灰霉病菌苹果果实总酚、类黄酮含量的影响
SA处理对接种灰霉病菌苹果果实总酚、类黄酮含量的影响如图8和图9所示。由图8可知,接种前期,SA处理和对照的总酚含量均呈增加趋势,分别在接种后第4天和5天达到最大值;随后两者总酚含量总体呈下降的趋势。在接种后1~9 d,SA处理的总酚含量高于对照,其中接种后第3~9 天,SA处理果实总酚含量显著高于对照(P<0.05)。
类黄酮是苹果果实中主要的多酚类物质,可作为抗氧化剂和自由基清除剂参与植物抗性反应[23]。如图9所示,接种后SA处理和对照类黄酮含量呈增加趋势,其中SA处理第4天出现最大峰值,而对照则推迟1 d达到最大;之后SA处理和对照类黄酮含量总体下降。接种1~9 d,SA处理类黄酮含量均高于对照,这说明SA处理可诱导促进苹果果实中类黄酮的合成。
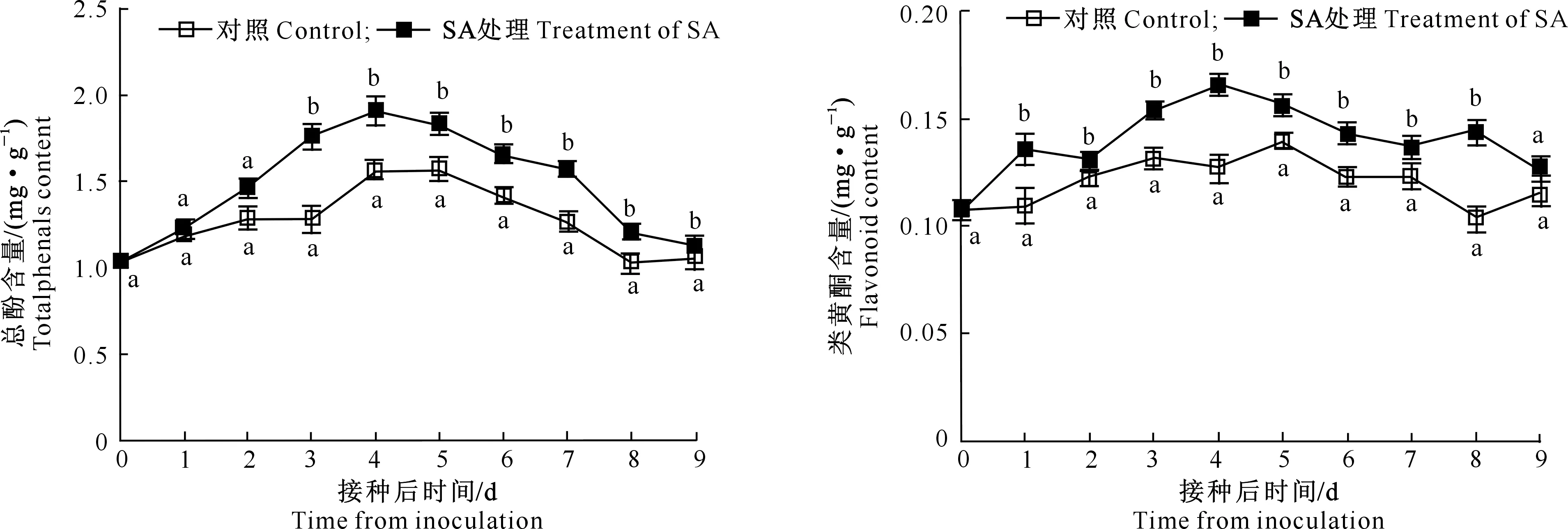
图8 采后SA 处理对接种灰霉病菌苹果 果实总酚含量的影响Fig.8 Effect of postharvest SA treatment on the content of total phenols of apple fruit inoculated with Botrytis cinerea
2.5 SA处理对苹果MDA含量的影响
逆境条件下果蔬组织遭受伤害,自由基代谢失调导致膜脂发生过氧化作用,而MDA是膜脂过氧化的重要产物。采后SA处理对接种灰霉病菌苹果果实MDA含量的影响见图10。

图10 采后SA处理对接种灰霉病菌苹果 果实MDA含量的影响Fig.10 Effect of postharvest SA treatment on MDA content of apple fruit inoculated with Botrytis cinerea
如图10所示,接种后SA处理和对照果实中MDA含量总体呈持续上升的变化趋势,其中接种后1~5 d,SA处理果实中MDA合成速率较为缓慢,而对照MDA含量迅速累积,且第5天时SA处理相对于对照降低了22.56%;而接种后5~9 d,SA处理和对照MDA增幅较大。接种后第4~9天SA处理MDA含量显著低于对照(P<0.05)。表明SA处理有效抑制了感病后果实MDA含量的积累,降低了MDA对细胞膜的伤害。
3 讨 论
果蔬受到病原微生物浸染后产生一系列防卫方应,而外源SA处理可增强其抵御病原菌的能力,从而减少果蔬腐烂及采后损失。Qin等[24]研究发现,SA能显著减少甜樱桃青霉病和黑斑病的发病率,诱导其对病原体抗性的增强。Rochaneta等[25]研究表明,SA处理损伤苹果果实后,青霉菌孢子繁殖受到抑制,发病率显著降低。本试验中,SA处理抑制了苹果采后灰霉病的发展,有效降低了果实损伤接种后第1~3天的发病率(P<0.05),4 d后对照和SA处理果实发病率都达到100%,但SA处理果实病斑直径与对照相比明显减小,且二者差异显著(P<0.05),表明SA处理诱导苹果果实对采后病害产生了抗性。
PPO、POD、PAL是植物体内的抗病防御相关酶,在果蔬病害抗性诱导机制中发挥着重要作用。PAL是苯丙烷代谢途径的关键酶,也可催化植物体内L-苯丙氨酸转化为类黄酮、木质素、总酚等与抗病相关的次生代谢产物。PPO、POD也是此代谢途径的末端酶,PPO能使酚类氧化成相应的醌类物质,控制病原微生物的浸染;而POD能催化松柏醇聚合成抗菌物质,进一步阻止病原菌扩展。Zeng等[26]研究发现,SA浸泡后芒果果实PAL、POD和PPO活性显著增强,在整个贮藏期内(16 d)PPO活性较对照提高1倍,4 d时PAL活性较对照提高了5倍,采后进行SA处理增强了芒果果实对炭疽病的抗性。本试验中,苹果损伤接种灰霉病菌后第1~3天,SA处理显著增强苹果POD活性;同时在整个病害试验观察期内,SA诱导果实PAL、PPO活性显著增加(P<0.05)。由此可知,SA处理诱导接种后苹果中防御酶活性升高,提高了苹果对采后病害的抗性。SA在桃[27]、芒果[28]等病害的防治上也有相似结果。
果蔬受病菌浸染后组织中总酚、类黄酮含量增加,能够抑制病原菌扩展。本试验结果显示,SA处理有效增加果实中总酚和类黄酮含量的合成与累积,加快抗病相关物质的合成,增强苹果果实对病原菌的抵抗力。Siboza等[29]研究发现,SA处理后柠檬果实PAL活性升高、总酚含量增加,对冷害的抗性增加,柠檬果实货架期延长。
植物体内MDA的合成与积累不仅会加剧细胞膜损伤程度,破坏细胞膜的结构和功能,而且还会引起蛋白质、核酸等生物大分子的交联聚合,影响正常生命活动的进行。通过测定MDA含量,可以间接了解膜脂过氧化的程度以及植物的抗逆性。用0.01 g/L的 SA浸泡处理杏果实后,可显著控制杏果实中MDA含量增加,延缓果实硬度下降,提高果实抗冷性[30]。本试验结果表明,SA处理有效抑制MDA含量增加,从而延缓果实细胞膜损伤,减轻膜脂过氧化程度,提高果实的抗病能力。
在抵御病原菌浸染的防卫方应中,CHI和GLU具有直接杀死病原真菌的潜在能力,同时在降解真菌细胞壁反应中具有协同作用。正常情况下,果实中CHI和GLU活性很低,但病原菌浸染后会造成细胞膜损伤,诱导GLU和CHI活性升高[31]。Cao等[32]研究了枣采后黑斑病,认为SA处理后会诱导果实中GLU和CHI活性提高,果实采后抗病能力增强,这在其他果蔬上[33-34]也有相似报道。本试验采用SA浸泡处理苹果,接种灰霉病菌后果实中GLU和CHI活性迅速增加。在病害观察前期SA处理苹果果实发病率和病斑直径明显低于对照,由于CHI和GLU不仅可抑制病原菌的浸染,同时也能激发植物潜在防御反应,说明GLU和CHI活性上升与SA诱导采后苹果抗病性有密切的相关性。关于GLU和CHI在分子水平上如何诱导苹果产生抗病能力的机制还有待进一步研究。
4 结 论
150 mg/L SA处理能够控制苹果采后灰霉病的发生和发展,试验观察前期SA能有效降低发病率,显著抑制病斑直径的扩展。SA处理通过促进PPO、POD、PAL抗病相关酶活性提高,诱导2种与病程相关蛋白CHI、GLU活性升高,增加总酚、类黄酮的含量,并减少MDA的产生,从而诱导苹果果实对灰霉病抗性增强。
[参考文献]
[1] 王 皎,李赫宇,刘岱琳,等.苹果的营养成分及保健功效研究进展 [J].食品研究与开发,2011,32(1):164-168.
Wang J,Li H Y,Liu D L,et al.Research progress of apple nutrition components and health function [J].Food Research and Developent,2011,32(1):164-168.
[2] Berrie A M,Xu X M,Johnson D.Lower temperatures more effective than atmosphere modification in controllingBotrytisandNectriarots in stored apples [J].Journal of Phytopathology,2011,159(2):73-79.
[3] Zhao H,Kim Y K,Huang L,et al.Resistance to thiabendazole and baseline sensitivity to fludioxonil and pyrimethanil inBotrytiscinereapopulations from apple and pear in Washington State [J].Postharvest Biology and Technology,2010,56(1):12-18.
[4] Tzortzakis N,Taybi T,Antony E,et al.Profiling shifts in protein complement in tomato fruit induced by atmospheric ozone-enrichment and/or wound-inoculation withBotrytiscinerea[J].Postharvest Biology and Technology,2013,78:67-75.
[5] Ruiz V E,Interdonato R,Cerioni L,et al.Short-term UV-B exposure induces metabolic and anatomical changes in peel of harvested lemons contributing in fruit protection against green mold [J].Journal of Photochemistry & Photobiology,B:Biology,2016,159:59-65.
[6] Li X P,Zhu X Y,Zhao N,et al.Effects of hot water treatment on anthracnose disease in papaya fruit and its possible mechanism [J].Postharvest Biology and Technology,2013,86:437-446.
[7] Yun Z,Gao H J,Liu P,et al.Comparative proteomic and metabolomic profiling of citrus fruit with enhancement of disease resistance by postharvest heat treatment [J].BMC Plant Biology,2013,13:44.
[8] Ngadze E,Coutinho T A,Icishahayo D,et al.Effect of calcium soil amendments on phenolic compounds and soft rot resistance in potato tubers [J].Crop Protection,2014,62(1):40-45.
[9] Ischibashi T,Ahao H,Kawabe K,et al.Blocking of monocyte chemoattractant protein-1 (MCP-1) activity attenuates the severity of acute pancreatitis in rats [J].Journal of Gastroenterology,2008,43(1):79-85.
[10] 袁仲玉,周会玲,田 蓉,等.芦荟粗提物对苹果采后灰霉病的防治效果与机理 [J].农业工程学报,2014,30(4):255-263.
Yuan Z Y,Zhou H L,Tian R,et al.Effect and mechanism of aloe vera extracts on control of botrytis in postharvest apples [J].Transaction of the Chinese Society of Agricultural Engineering,2014,30(4):255-263.
[11] Dantel C K,Lennoxa C L,Vries F A,et al.Invivoapplication of garlic extracts in combination with clove oil toprevent postharvest decay caused byBotrytiscinerea,PenicilliumexpansumandNeofabraeaalbaon apples [J].Postharvest Biology and Technology,2015,99:88-92.
[12] Navartal G,Calvo J,Posetto P,et al.Postharvest control of gray mold in apples with lyophilized formulations ofCryptococcuslaurentii:the effect of cold stress in the survival and effectiveness of the yeast [J].Food Bioprocess Technol,2014,7(10):2962-2968.
[13] Zhu F,Chen J,Xiao X,et al.Salicylic acid treatment reduces the rot of postharvest citrus fruit by inducing the accumulation of H2O2,primary metabolites and lipophilic polymethoxylated falvones [J].Food Chemistry,2016,207:68-74.
[14] 赵亚婷,朱 璇,马 玄,等.采前水杨酸处理对杏果实抗病性及苯丙烷代谢的诱导 [J].食品科学,2015,36(2):216-220.
Zhao Y T,Zhu X,Ma X,et al.Induction of disease resistance and phenylpropanoid metabolism in apricot fruits by pre-harvest salicylic acid treatment [J].Food Science,2015,36(2):216-220.
[15] 杨冬平,高兆银,李 敏,等.水杨酸结合超声波处理对芒果采后抗病性的影响 [J].热带作物学报,2014,35(5):974-979.
Yang D P,Gao Z Y,Li M,et al.Combination of salicylic acid and ultrasound to control postharvest anthracnose caused byColletotrichumgloeosporioidesPenz in mango fruit [J].Chinese Journal of Tropical Crops,2014,35(5):974-979.
[16] Rocha Neto da A C,Luiz C,Maraschin M,et al.Efficacy of salicylic acid to reducePenicilliumexpansuminoculum and preserve apple fruits [J].International Journal of Food Microbiology,2016,221:54-60.
[17] 姜微波,曹健康,赵玉梅.果蔬采后生理生化实验指导 [M].北京:中国轻工业出社,2007.
Jiang W B,Cao J K,Zhao Y M.Fruit and vegetables postharvest physiological and biochemical experiment instruction [J].Beijing:China Light Industry Press,2007.
[18] 周晓婉,唐永萍,周会玲,等.1-MCP对低温贮藏苹果灰霉病抗性的诱导 [J].食品科学,2016,37(12):254-260.
Zhou X W,Tang Y P,Zhou H L,et al.Mechanism of 1-MCP treatment in induced resistance to gray mould of apples during the low temperature storage [J].Food Science,2016,37(12):254-260.
[19] Cao S,Zheng Y.Effect of 1-methycyclopropens on anthracnose rot caused byColletotrichumacutatumand disease resistance in loquat fruit [J].Journal of the Science of Food and Agriculture,2010,90(13):2289-2294.
[20] 张晓晓,周会玲,田 蓉,等.短波紫外线照射对苹果采后灰霉病抗性诱导作用 [J].食品科学,2015,36(2):242-249.
Zhang X X,Zhou H L,Tian R,et al.Effects and mechanism of UC-V treatments on control ofBotrytiscinereain postharvest apples [J].Food Science,2015,36(2):242-249.
[21] 高俊凤.植物生理学实验指导 [M].北京:高等教育出版社,2006:210-211.
Gao J F.Experimental instruction of plant physiology [M].Beijing:Higher Education Press,2006:210-211.
[22] 李志文,张 平,刘 翔,等.纳他霉素采前处理对葡萄采后灰霉病的抑制效果 [J].农业工程学报,2014,30(9):262-271.
Li Z W,Zhang P,Liu X,et al.Inhibition efficiency of natamycin pretreatment before harvest on gray mold of post-harvest grapes [J].Transactions of the Chinese Society of Agricultural Engineering,2014,30(9):262-271.
[23] 聂继云,吕德国,李 静,等.苹果果实中类黄酮化合物的研究进展 [J].园艺学报,2009,36(9):1390-1397.
Nie J Y,Lü D G,Li J,et al.Advances in studies on flavonoids in apple fruit [J].Acta Horticulture Sinica,2009,36(9):1390-1397.
[24] Qin G Z,Tian S P,Xu Y,et al.Enhancement of biocontrol efficacy of antagonistic yeasts by salicylic acid in sweet cherry fruit [J].Physiological and Molecular Plant Pathology,2003,62(3):147-154.
[25] Rochaneta A C,Maraschin M,Dipireo R M.Antifungal activity of salicylic acid againstPenicilliumexpansumand its possible mechanisms of action [J].International Journal of Food Microbiology,2015,215:64-70.
[26] Zeng K F,Cao J K,Jiang W B.Enhancing disease resistance in harvested mango (MangiferaindicaL cv ‘Matisu’) fruit by salicylic acid [J].Science Food and Agriculture,2006,86(5):694-698.
[27] 马凌云,赵 亮.采后水杨酸处理对油桃果实抗病性的影响 [J].河南工业大学学报(自然科学版),2014,35(6):93-96.
Ma L Y,Zhao L.Effect of postharvest salicylic acid treatment on disease resistance of nectarine fruits [J].Journal of Henan University of Technology(Natural Science Edition),2014,35(6):93-96.
[28] 曾凯芳,姜微波.水杨酸处理对采后绿熟芒果炭疽病抗病性的诱导 [J].中国农业大学学报,2005,10(2):36-40.
Zeng K F,Jiang W B.Induced resistance to anthracnose (Colletotichumgloeosporiodies) in mango fruit by postharvest treatment with salicylic acid [J].Journal of China Agricultural University,2005,10(2):36-40.
[29] Siboza X I,Bertling I,Odindo A O.Salicylic acid and methyl jasmonate improve chilling tolerance in cold-stored lemon fruit (Citruslimon) [J].J Plant Physiol,2014,171(18):1722-1731.
[30] 袁 洁,朱 璇,逢焕明,等.外源水杨酸对采后杏果实抗冷性的影响 [J].食品工业科技,2013,24(34),339-343.
Yuan J,Zhu X,Feng H M,et al.Effect of exogenous salicylic acid on anti-chilling-injury of postharvest apricot fruit [J].Science and Technology of Food Industry,2013,24(34):339-343.
[31] Mauch F,Mauch-mani B,Boller T.Antifungal hydrolases in pea tissue:Ⅱ.inhibition of fungal growth by combinations of chitinase and β-1,3-glucanase [J].Plant Physiol,1988,88(3):936-942.
[32] Cao J K,Yan J Q,Zhao Y M,et al.Effects of postharvest salicylic acid dipping onAlternariarot and disease resistance of jujube fruit during storage [J].Society of Chemical Industry,2013,93:3252-3258.
[33] Yao H J,Tian S P.Effects of pre- and post-harvest application of salicylic acid or methyl jasmonate on inducing disease resistance of sweet cherry fruit in storage [J].Postharvest Biology and Technology,2005,35(3):253-262.
[34] Xu X B,Chan Z L,Xu Y,et al.Effect ofPichiamembranaefacienscombined with salicylic acid on controlling brown rot in peach fruit and the mechanisms involved [J].Science Food and Agriculture,2008,88(10):1786-1793.
