秋海棠中植物促生菌的筛选及其促生效果研究
2018-05-08邓振山段阳阳
邓振山,段阳阳
(延安大学 生命科学学院,陕西 延安 716000)
植物促生菌(plant growth-promoting bacteria,PGPB)是指从植物根系表面或者植物体内分离出来的、可促进植物生长及其对矿物质营养的吸收和利用,并能抑制有害生物的一类有益菌株。植物促生菌对植物的促生作用是通过多种机制和途径实现的,主要包括:(1)产生调节植物生长的信号物质,如吲哚乙酸、赤霉素、细胞分裂素和乙烯;(2)非共生固氮;(3)抵抗病原菌;(4)溶解磷矿物及其他养分;(5)产生铁载体;(6)产生1-氨基环丙烷-1-羧酸ACC脱氨酶[1]。此外,PGPB还能提高植物的抗逆性,如耐干旱、高盐、重金属毒害和农药,是防治植物病虫害和诱导抗病性的天然菌源,具有较高的理论价值和应用价值[2-6]。同时,PGPB也可以应用于微生物肥料的生产,是今后一段时期内农业生物技术发展的重要领域和方向之一[7]。
秋海棠(BegoniagrandisDry)属多年生草本植物,不仅是著名的观赏花卉,还可药用、食用,加工成饮料和饲料等[8]。现有的研究主要集中在农作物PGPB方面,而对花卉的PGPB研究较少。鉴于此,本研究以健康的秋海棠植株作为试验材料,从中分离出促生菌,通过解磷、固氮、产氨、产吲哚乙酸(indoleacetic acid,IAA)等生物学检测,筛选出具有良好促生防病作用的菌株,同时进行了盆栽试验和大田试验,以期为促生菌在实际生产中的应用提供理论依据。
1 材料与方法
1.1 材 料
1.1.1 供试植物种子及病原真菌 供试植物种子为大豆种子;供试指示病原真菌为番茄灰霉病菌(BotrytiscineraPers.)、西瓜枯萎病菌(Fusariumoxysporumf.sp.Niveum)、玉米大斑病菌(Setosphaeriaturcica)、棉花枯萎病菌(Fusariumoxysporumf.sp.vasinfectum),均由西北农林科技大学植物保护学院鉴定并惠赠。
1.1.2 盆栽试验基质 盆栽试验所用培养基质由珍珠岩和蛭石(质量比1∶2)组成,灭菌分装入一次性纸杯内备用。
1.1.3 供试培养基 (1)PDA培养基。马铃薯汁1 000 mL,葡萄糖(或蔗糖)20 g,琼脂18 g,pH值自然,121 ℃下灭菌30 min。
(2)牛肉膏蛋白胨培养基。牛肉膏3.0 g,蛋白胨10.0 g,NaCl 5.0 g,琼脂18 g,自来水1 000 mL,pH 7.2~7.4,121 ℃下灭菌30 min。
(3)YMA培养基。甘露醇10 g,NaCl 0.1 g,酵母膏1.0 g,K2HPO40.5 g,MgSO4·7H2O 0.2 g,CaCO33.0 g,琼脂18 g,蒸馏水 1 000 mL,pH 7.0~7.2,121 ℃下灭菌30 min。
(4)无机磷培养基。葡萄糖10 g,(NH4)2SO40.5 g,KCl 0.3 g,MgSO4·7H2O 0.3 g,FeSO4·7H2O 0.01 g,MnSO4·4H2O 0.02 g,Ca3(PO4)25 g,自来水1 000 mL,pH 7.0~7.2,121 ℃下灭菌30 min。
(5)无氮培养基。K2HPO40.5 g,Ca(PO4)22.0 g,MgSO4·7H2O 0.2 g,FeCl30.01 g,蒸馏水1 000 mL,pH 6.8~7.0,121 ℃下灭菌30 min。
(6)Kings B培养基。参考文献[9]的方法配制。
(7)产IAA培养基。参考文献[10]的方法配制。
1.2 方 法
1.2.1 样品采集 将健康的秋海棠植株整株挖出,采集健康部位的根部和茎部,放入灭菌的采集袋,做好标记并立即带回实验室进行促生菌的分离。
1.2.2 促生菌的分离与纯化 在超净工作台上,将采集的秋海棠根部和茎部,分别用清水洗净表面附着的杂质后,进行表面消毒(在体积分数75%乙醇溶液中浸泡1 min,用无菌水冲洗3次,再用质量分数0.1%升汞溶液浸泡2~3 min,无菌水冲洗5次)[11];用灭菌滤纸吸干多余水分后,再用无菌剪及灭菌刀将材料切割为6~8段(每段长度约0.5 cm),将表面消毒的材料段分别置于3种筛选培养基(PDA培养基、YMA培养基、牛肉膏蛋白胨培养基)中。将所有平板放置于(28±2) ℃培养箱中培养48 h,反复纯化直至获得单一菌株,斜面保存并编号备用。为了验证材料表面消毒是否彻底,以经表面消毒不做处理的材料在培养基上的组织印迹作为对照,检验消毒效果。
1.2.3 抑菌活性的测定 采用平板对峙法进行测定,以供试指示病原真菌为靶标,将病原真菌接种于PDA平板进行活化,于28 ℃下培养至病原菌长满平板。用打孔器将活化后的病原真菌菌落打成直径为4 mm的菌饼,置于PDA平板中央,用同样的方法在距其2 cm处接种已经分离纯化的促生菌,每个平板接4个菌饼,以只接指示病原真菌的平板作为对照,每处理3次重复,28 ℃恒温培养箱培养,待对照平板上长满菌丝时,采用十字交叉法测量对照组和处理组抑菌圈直径,并记录数据。
1.2.4 目标菌株促生能力的测定 (1)解磷能力。将待测菌株接种在液体无机磷培养基上,在摇床上于250 r/min、(28±2) ℃培养72 h后,取上清液涂布在固体无机磷培养基上,依据溶磷圈直径,初步确定该菌株的解磷能力[1]。
(2)固氮能力。将待测菌株接种在液体无氮培养基中,(28±2) ℃培养72 h后将菌悬液涂布在固体无氮培养基上,48 h后观察生长情况,测定变色圈直径。
(3)产IAA能力。 将待测菌株接种到Kings B培养基上,(28±2) ℃培养48 h后,每个平板滴加1 mL Salkowski试剂(每升10.8 mol/L H2SO4,含4.5 g FeCl3),室温暗处显色2 h后,根据显色深浅初步判断产IAA含量。另取待测菌株接种于液体产IAA培养基中,于250 r/min、(28±2) ℃培养5 d,取2 mL培养液,10 000 r/min 离心15 min,每1 mL上清液中滴加0.5 mL Salkowski 试剂,室温黑暗条件下显色2 h 后,于530 nm处测定吸光度值(OD值)。以空白培养基作为对照,并以标品IAA(上海蓝季科技发展有限公司生产)对应的OD值制作标准曲线,计算IAA产量(mg/L)。
1.2.5 盆栽试验 选择籽粒饱满大豆种子浸泡于质量分数0.1%的HgCl2溶液中5 min,无菌dH2O冲洗5次后并于室内晾干[12-13]。大豆催芽2 d后,取长势相同的豆芽植入纸杯中,每杯装基质70 g,每杯种植3株,并喷洒无菌水,各纸杯均放置于室外并在自然光照下培养,每天用无菌水喷洒1次。试验分别设接种单一促生菌株处理、接种菌株Y-01与Y-02混合菌液(两种菌株经培养后按照1∶1体积比混合而成)处理以及无菌水对照处理(CK)。取经培养且OD600 nm=2.0的菌悬液(含菌量2×109mL-1)离心,将获得的菌体细胞用生理盐水洗涤3次后备用。待豆苗长出2片真叶后,取配制好的各处理菌液0.2 mL,稀释至20 mL,进行灌根处理,常规管理,处理30 d,测量各处理大豆植株的各种形态学参数(包括株高、根长、茎长、茎直径、大豆果实鲜质量),并进行统计学分析。
1.2.6 大田试验 大田试验分别设接种单一促生菌株处理、接种菌株Y-01与Y-02混合菌液(两种菌株经培养后按照1∶1体积比混合而成)处理以及无菌水对照处理(CK),不同处理随机排列,每处理3次重复,每小区20 m2,共栽培番茄160株。取经培养且OD600 nm=2.0菌悬液(含菌量2×109mL-1)离心,将获得的菌体细胞用生理盐水洗涤3次,取配制好的各处理菌液1 mL,稀释至100 mL,对长出2片真叶的番茄进行灌根处理,CK用无菌水进行根灌。分别于接种后15 d测量茎长、叶长、叶绿素含量以及60 d茎长、叶绿素含量、果实数量[14-16],其中叶绿素含量用SPAD值表示。
1.3 数据处理
试验数据均采用Excel 2013进行统计学分析。
2 结果与分析
2.1 秋海棠促生菌菌株的筛选
用3种配方不同的培养基,从秋海棠根部和茎部共分离、纯化出22株菌株,从中筛选出11株具有解磷、产IAA、固氮等促生特性或抑制病原菌生长能力较强的菌株,这些菌株的编号及相关信息如表1所示。由表1可见,11株菌株中,有10株具有产IAA能力,占分离总菌株数的45.45%;2株解磷菌株;3株具有固氮活性;5株具有抑制指示病原菌活性。其中菌株Y-01和P-10兼具解磷、产IAA性能,菌株N-02兼具固氮、产IAA性能。
2.2 秋海棠促生菌的抑菌能力
由2.1节可知,筛选获得了5株具有抑制病原真菌能力的菌株,分别是P-03、P-06、P-09、P-15、P-16。采用平板对峙法测定以上5株促生菌体外抑菌情况,结果如表2所示。表2表明,这5株秋海棠促生菌对一种或多种指示菌具有抑菌活性,占分离菌株总数的45.5%。其中, P-16对4种供试病原真菌、P-15对3种供试病原真菌均表现出较广的抑菌谱,且仅菌株P-16对西瓜枯萎病菌具有抑菌活性。菌株P-15和P-16对番茄灰霉病菌均具有抑菌活性,但抑菌能力差异不显著。对玉米大斑病菌表现出抑菌活性的菌株分别是P-09、P-15和P-16,其中菌株P-15抑菌活性最高,抑菌圈直径达(4.10±0.26) cm,三者间差异显著。除菌株P-09外,其他测试菌株对棉花枯萎病菌均具有抑菌活性,其中P-06对棉花枯萎病菌的抑菌效果最强,其抑菌圈直径可达(6.40±0.16) cm,显著高于其他测试菌株。以上说明秋海棠促生菌中存在丰富的抗菌资源。

表1 11株秋海棠促生菌的主要特性Table 1 Characteristics of 11 growth promoting strains from Begonia grandis

表2 秋海棠促生菌的体外抑菌能力Table 2 Inhibitory activity of growth promoting strains in Begonia grandis cm
注:数据为“平均值±标准差”。ND表示未检测到抑菌活性。同列数据后标不同小写字母表示差异显著(P<0.05)。下表同。
Note:Data are mean±SE.ND indicates not determined.Different lowercase letters in same column indicate significant difference (P<0.05).The same below.
2.3 秋海棠促生菌的促生能力
11株菌株的促生能力测定结果(表3)表明,不同菌株的促生能力也有差异,其中Y-01的IAA产量最高,达到32.63 mg/L,这暗示Y-01的促生能力可能比较强。菌株间的拮抗预试验结果显示,Y-01和Y-02之间的拮抗性很小,故将菌株Y-01和Y-02按照1∶1体积比混合组成混合菌,进行盆栽和大田试验。

表3 11株秋海棠促生菌的体外促生能力Table 3 Plant growth promoting activities of 11 the growth promoting strains in Begonia grandis
注:“+”表示变色圈直径≤5 mm,“++”表示变色圈或溶磷圈直径为>5 mm~≤10 mm。
Note:+.Color halo diameter(d) was ≤5 mm;++.Color halo or P dissolve circle diameter was >5 mm-≤10 mm.
2.4 秋海棠促生菌的盆栽表现
大豆在室外培养30 d后的形态学参数见表4。表4表明,与CK相比,接种秋海棠促生菌对大豆植株具有一定促生作用。与CK相比,接种供试11株单一促生菌后,大豆株高均显著增加,增幅为13.4%~39.3%,其中以接种菌株P-06增幅最大。与CK相比,11株单一促生菌中,除菌株P-15对根长无促生作用,P-03、P-10、P-16和Y-02对根长促生作用不显著外,其他菌株促生作用显著,其中菌株P-12根长增幅最大,为21.0%。与CK相比,接种11株单一促生菌后,大豆茎长均明显增加,增幅为3.3%~39.5%,其中P-03增幅最大;除菌株P-01外,其他菌株均显著高于CK。11株单一促生菌中,除了P-10、P-15、N-02、Y-01外,其他菌株对大豆茎直径均无显著促生作用。11株单一促生菌对大豆果实鲜质量均有显著促生作用。总体而言,接种11株单一促生菌后,大豆株高、根长、茎长、茎直径和果实鲜质量的平均值均较CK明显增加,增幅分别为27.33%,15.84%,23.46%,13.20%和22.39%。接种Y-01+Y-02混合菌的促生效应明显优于单一促生菌,大豆株高、根长、茎长、茎直径、果实鲜质量较CK分别增加37.42%,25.65%,38.53%,16.42%和34.84%。

表4 不同秋海棠促生菌对大豆生长的影响Table 4 Effects of different growth promoting strains of Begonia grandis on growth of soybean
2.5 秋海棠促生菌的大田表现
促生菌对大田番茄生长影响的结果见表5及表6。表5表明同,灌根15 d后,与CK相比,接种11株单一促生菌后,番茄的茎长、叶长和叶绿素含量(除菌株P-01外)均增加。其中接种菌株P-16的番茄茎长和叶长增幅最大,分别为18.1%和35.6%;接种菌株P-12,番茄叶绿素含量增幅最大,为35.1%。Y-01+Y-02混合菌液对番茄植株茎长和叶长的促生效应优于CK和其他单一促生菌,茎长和叶长较CK分别增加了24.06%和37.10%;Y-01+Y-02混合菌液处理番茄的叶绿素含量较CK增加3.78%,除了P-01和P-06、P-09、Y-01之外,其他单一促生菌处理的叶绿素含量均显著高于Y-01+Y-02混合菌液,可见混合菌所有促生指标并非都比单一菌株好。
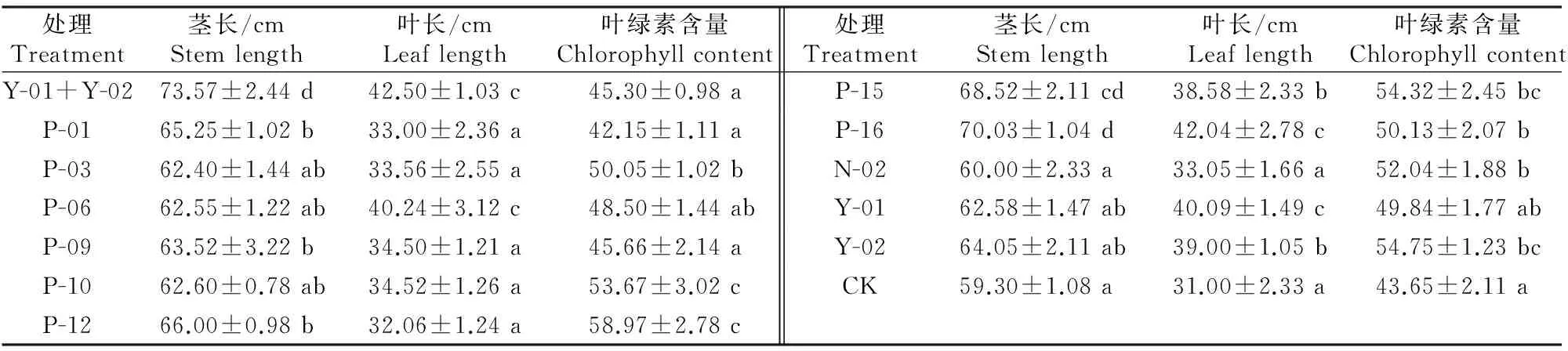
表5 灌根15 d后不同秋海棠促生菌对番茄生长的影响Table 5 Effects of different growth promoting strains of Begonia grandis on growth of tomato after 15 d root irrigation
表6表明,灌根60 d后,Y-01+Y-02混合菌液与11种单一促生菌对番茄茎长、叶绿素含量和果实数量的促生效果均高于CK。其中菌株P-09处理番茄茎长最高,为(206.30±1.47) cm,比CK增加了34.55%,叶绿素含量也最高,比CK增加了13.25%。此外,P-09处理番茄果实数量也较高。
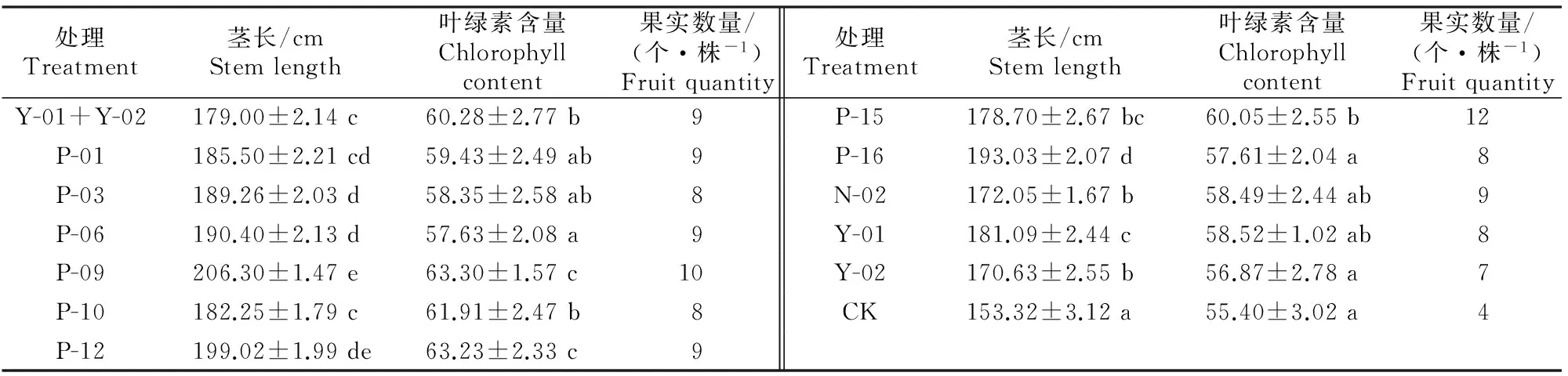
表6 灌根60 d后不同秋海棠促生菌对番茄生长的影响Table 6 Effects of different growth promoting strains of Begonia grondis on growth of tomato after 60 d root irrigation
3 结论与讨论
在植物根际促生菌促生效应的研究中,促生菌株的实际应用效果非常重要,这方面已有许多报道。如段秀梅等[17]从植物根际的土壤样品中分离筛选出2株高效解磷细菌P9和P28,研究表明,混合接种这2株解磷菌处理的玉米株高和干质量比CK分别增加了35.5%和28.9%。Zhao等[18]通过接种促生菌使得金银花鲜质量增加16.48%。姚拓[19]研究表明,大多数促生菌株可以促进燕麦的生长(株高、根长、根表面积和生物量),接种联合促生菌后,燕麦的株高和生物量分别增加35.40% 和33.70%。崔晓双等[20]利用玉米、黄瓜、番茄3种作物的根系分泌物作为初筛培养基的营养源,从相对应作物的根际土壤样品中分离筛选出了能利用根系分泌物快速生长的菌株,并通过盆栽试验评价其促生效果,结果表明,番茄接种促生菌后,地上鲜质量增加了38.58%~45.53%;黄瓜接种促生菌后,地上部鲜质量增加17.49%~29.44%,且与CK有显著差异。丁新景等[21]探讨了阿氏芽孢杆菌(Bacillusaryabhattai)、弯曲芽孢杆菌(Bacillusflexus)、藤黄微球菌(Micrococcusluteus)对雪莲生长的促生作用,结果表明,接种3种促生菌后,雪莲植株叶绿素含量、根系体积和鲜质量、地上部鲜质量均显著提高。本研究的盆栽试验结果表明,单一促生菌和Y-01+Y-02混合菌的促生效果有差异,接种单一促生菌的效果总体低于Y-01+Y-02混合菌,Y-01+Y-02混合菌处理大豆株高、根长、茎长、茎直径和鲜质量分别较CK增加了37.42%,25.65%,38.53%,16.42%和34.84%。这是因为促生菌Y-01与Y-02间具有协同效应,由于植物在幼苗初期自养能力较差,需要吸收大量营养物质,而促生菌可调节植物幼苗初期的自养能力,有利于营养物质的积累,可为育苗壮苗提供保障,并且随着植物促生菌的定殖,其促生作用明显增加。
本研究的大田试验中,Y-01+Y-02混合菌液对灌根15 d番茄植株茎长和叶长的促生效果明显,茎长和叶长较CK组分别增加了24.06%和37.10%;叶绿素含量较CK增加3.78%,但低于大部分单一促生菌。处理60 d后,P-09的茎长、叶绿素含量、果实数量均较高,促生作用优于Y-01+Y-02混合菌处理。可见在大田中某些单一促生菌的促生作用会优于多菌混合处理。
[参考文献]
[1] 邓振山,党军龙,张海州,等.植物根际促生菌的筛选及其对玉米的促生效应 [J].微生物学通报,2012,39(7):980-988.
Deng Z S,Dang J L,Zhang H Z,et al.Screening of plant growth-promoting rhizobacteria and their promoting effects on maize [J].Microbiology China,2012,39(7):980-988.
[2] 张美琴,马建华,赵月英,等.植物联合固氮菌及其促生作用研究进展 [J].内蒙古农业科技,2007(4):80-83.
Zhang M Q,Ma J H,Zhao Y Y,et al.Advances of associated nitrogen-fixation bacteria and its promotion to plant growth [J].Inner Mongolia Agricultural Science and Technology,2007(4):80-83.
[3] 邢永秀,莫 遥,罗丽静,等.接种固氮菌Klebsiellasp.120对甘蔗光合特性和主要矿质营养元素含量的影响 [J].植物营养与肥料学报,2015,21(2):467-474.
Xing Y X,Mo Y,Luo L J,et al.Effects of inoculating nitrogen fixing bacteriaKlebsiellasp.120 on photosynthetic characteristics and mineral nutrient contents of sugarcane [J].Journal of Plant Nutrition and Fertilizer,2015,21(2):467-474.
[4] 孙建光,胡海燕,刘 君,等.农田环境中固氮菌的促生潜能与分布特点 [J].中国农业科学,2012,45(8):1532-1544.
Sun J G,Hu H Y,Liu J,et al.Growth promotion potential and distribution features of nitrogen-fixing bacteria in field environments [J].Scientia Agricultura Sinica,2012,45(8):1532-1544.
[5] 李琼洁,程杰杰,孙帅欣,等.玉米联合固氮菌KosakoniaradicincitansGXGL-4A的分离鉴定与固氮特性研究 [J].微生物学通报,2016,43(11):2456-2463.
Li Q J,Cheng J J,Sun S X,et al.Isolation,identification and characterization of associative nitrogen-fixing endophy-tic bacteriumKosakoniaradicincitansGXGL-4A in maize [J].Microbiology China,2016,43(11):2456-2463.
[6] 门惠芹,王亚军,安 巍,等.固氮菌对枸杞生长发育的影响 [J].北方园艺,2015(15):150-152.
Men H Q,Wang Y J,An W,et al.Effect of azotobacter inoculating on the growth and developement of wolfberry [J].Northern Horticulture,2015(15):150-152.
[7] Gleika L O D,Souzaa,Silvia N,et al.Triple combinations with PGPB stimulate plant growth in micropropagated banana plantlets [J].Applied Soil Ecology,2016,103(7):31-35.
[8] 管开云,山口裕文,李景秀,等.中国秋海棠属植物的传统利用 [J].云南植物研究,2007,29(1):58-66.
Guan K Y,Yamaguchi H F,Li J X,et al.Traditional uses ofBegonias(Begoniaceae) in China [J].Acta Botanica Yunnanica,2007,29(1):58-66.
[9] Glickmann E,Dessaux Y.A critical examination of the specificity of the salkowski reagent for indolic compounds produced by phytopathogenic bacteria [J].Applied and Environment Microbiology,1995,61(2):793-796.
[10] 陈 博,朱 军,孙前光.一株抗香蕉枯萎病内生细菌的分离鉴定及其抗病促生作用 [J].微生物学通报,2011,38(2):199-205.
Chen B,Zhu J,Sun Q G.A bacterial endophyte from banana:its isolation,identification,activity to Fusarium Wilt and PGPR effect to banana seedlings [J].Microbiology China,2011,38(2):199-205.
[11] Jha P,Kumar A.Characterization of novel plant growth promoting endophy ticbacteriumAchromobacterxylosoxidansfrom wheat plant [J].Microbial Ecology,2009,58(1):179-188.
[12] Zemrany H E,Czarnes S,Hallett P D,et al.Early changes in root characteristics of maize (Zeamays)following seed inoculation with the PGPRAzospirllumlipoferumCRT1 [J].Plant and Soil,2007,291(1/2):109-118.
[13] Cassán F,Perrig D,Sgroy V,et al.AzospirillumbrasilenseAz39 and Bradyrhizobium japonicum E109,inoculated singly or in combination,promote seed germination and early seedling growth in corn (ZeamaysL.) and soybean (GlycinemaxL.) [J].European Journal of Soil Biology,2009,45(1):28-35.
[14] EI-Tarabily K A.Promotion of tomato (LycopersiconesculentumMill.)plant growth by rhizosphere competent 1-aminocyclopropane-1-carb-oxylic acid deaminase-producingStreptomyceteactinomycetes[J].Plant and Soil,2008,308:161-174.
[15] 刘秀花,梁 峰.小麦根际促生菌的筛选与促生作用研究 [J].安徽农业科学,2006,34(20):5300-5301.
Liu X H,Liang F.Screening and identification of plant growth promoting rhizobactetia of wheat [J].Journal of Journal of Anhui Agricultural Sciences,2006,34(20):5300-5301.
[16] 王美琴,卢海波,赵立娟,等.核桃内生菌HT3对番茄和黄瓜的促生作用 [J].山西农业科学,2013,41(2):130-139.
Wang M Q,Lu H B,Zhao L J,et al.Growth-promoting action on tomato and cucumber by walnut endophytic HT3 [J].Journal of Shanxi Agricultural Sciences,2013,41(2):130-139.
[17] 段秀梅,高晓蓉,吕 军,等.两株土壤分离菌的解磷能力及对玉米的促生作用 [J].中国土壤与肥料,2010(2):79-85.
Duan X M,Gao X R,Lü J,et al.Two phosphate solubilizing bacteria from Cacajreous soil soluilizing-phosphate capacity and promoting effect on corn seeding growth [J].Soil and Fertilizer Sciences in China,2010(2):79-85.
[18] Zhao L F,Xu Y J,Lai X H,et al.Screening and characterization of endophyticBacillusandPaenibacillusstrains from medicinal plantLonicerajaponicafor use as potential plant growth promoters [J].Braziilian Journal of Microbiology,2015,46(4):977-989.
[19] 姚 拓.高寒地区燕麦根际联合固氮菌研究:Ⅱ.固氮菌的溶磷性和分泌植物生长素特性测定 [J].草业学报,2004,41(2):130-139.
Yao T.Associative nitrogen-fixing bacteriaintherhizosphereofAvenasativain an alpineregion:Ⅱ.phosphate-solubilizing power and auxin production [J].Acta Pratacultural Science,2004,41(2):130-139.
[20] 崔晓双,王 伟,张 如,等.基于根际营养竞争的植物根际促生菌的筛选及促生效应研究 [J].南京农业大学学报,2015,38(6):958-966.
Cui X S,Wang W,Zhang R,et al.Screening of plant growth-promoting rhizobacteria based on rhizosphere nutrition competiveness and investigation of their promoting effects [J].Journal of Nanjing Agricultural University,2015,38(6):958-966.
[21] 丁新景,黄雅丽,马风云,等.根际促生菌对景天科多肉植物雪莲的促生作用 [J].东北林业大学学报,2016,44(12):26-30.
Ding X J,Huang Y L,Ma F Y,et al.Effect of plant growth promoting rhizobacteria (PGPR) on theEcheverialaui[J].Joural of Northeast Forestry University,2016,44(12):26-30.
