AIV、NDV和安卡拉病毒多重PCR检测方法的建立及应用
2018-05-08张曼,韩飞
张 曼,韩 飞
(杨凌职业技术学院 动物工程学院,陕西 杨凌 712100)
禽流感(avian influenza,AI)和新城疫(newcastle disease,ND)作为世界动物卫生组织认定的A类疾病,是对养禽业造成严重危害的两种传染病[1-2]。禽流感的病原禽流感病毒(avian influenza virus,AIV)为单股负链RNA病毒,由8个独立的RNA节段组成,AIV亚型众多,变异频繁,至今已有15个HA亚型和9个NA亚型[3-5]。新城疫的病原新城疫病毒(newcastle disease virus,NDV)由衣壳蛋白包裹单股负链RNA组成,外披脂蛋白囊膜[1,6]。近年来随着我国禽类养殖的迅速发展,AI和ND持续暴发,给禽类养殖业造成了巨大的经济损失,而且1997年香港禽流感感染人事件和2013年3月禽流感病毒新亚型H7N9的出现,引起严重的社会和公共卫生问题[2,4]。在我国ND虽得到了一定程度的控制,但非典型ND仍时有发生,由此引起的生产性能降低等问题日益凸显。NDV不同分离株的毒力差异很大,感染鸡群的发病率、死亡率、临床症状、病理变化也不尽相同,这给诊断工作带来新的挑战,目前AI和ND已经严重地影响了各国的禽类养殖及贸易[6-7]。
2015年6月以来,我国多数省份的鸡群爆发安卡拉病(angrara disease),临床症状为突然倒地,出现呼吸道症状,甩鼻、呼吸加快,排黄色稀粪,有神经症状,剖检可见心包积液、肝脏肿大。该病主要发生于20日龄的肉鸡,发病后1周左右为死亡高峰,死亡率可达20%~80%。安卡拉病有心包积液的特征,但同时也有法氏囊炎和包涵体肝炎所表现的临床症状[8-10]。禽腺病毒(fowl adenovirus,FAV)是一种无囊膜的双链DNA病毒,可分为Ⅰ、Ⅱ、Ⅲ群,其中Ⅰ群FAV中C种FAV-4是安卡拉病的病原,俗称安卡拉病毒(angrara disease virus)[11-12]。
禽流感、新城疫和安卡拉病发病急,死亡率高,危害大,且临床症状相似,都会出现呼吸道症状,因此对其病原AIV、NDV和FAV-4做出快速的鉴别检测,对养殖业和公共卫生都具有重要的意义[13-15]。对于病毒性疫病的诊断一般采用病原分离鉴定和血清学方法,但这些方法存在操作复杂、费时费力、敏感性较差等缺点,特别是当鸡群混合感染多种病原时,应用常规方法难以进行早期快速检测和鉴别诊断[1,16-17]。为此,本研究参考国内外AIV、NDV和FAV-4相关的PCR检测方法[2,6,9],根据高保守、高特异的AIV的M基因序列、NDV的F基因、FAV-4型腺病毒的Hexon基因序列设计引物,采用病毒基因组DNA/RNA提取试剂盒可一次性提取病毒的DNA和RNA混合物,进行反转录(对FAV-4 DNA无影响)和PCR,建立了AIV、NDV和FAV-4的多重PCR检测方法,旨在一次性检测出AIV、NDV和FAV-4,为禽流感、新城疫和安卡拉病的快速鉴别及诊断提供方法支持。
1 材料与方法
1.1 材 料
1.1.1 病毒、细菌和细胞株 鸡新城疫LoSata株、传染性支气管炎病毒(infectious bronchitis virus,IBV)H120株、传染性法氏囊病病毒(infectious bursal disease virus,IBDV)B87株以及鸡痘病毒(fowl pox virus,FPV)Quail Adapted株活疫苗,购自山东绿都生物科技有限公司;鸡马立克病病毒(marker’s disease virus,MDV)FC-126株活疫苗,购自哈药集团生物疫苗有限公司;H9N2亚型AIV和FAV-4尿囊液,由陕西杨凌职业技术学院动物工程学院实验室鉴定保存。
1.1.2 待检病料 67份病料采自某陕西省不同地区鸡场的疑似禽流感、新城疫和安卡拉病鸡,包括鼻黏液、肺脏、心脏、肝脏和淋巴结等。
1.1.3 主要试剂 DNA聚合酶混合物PremixTaqVersion 2.0、DL2 000 DNA Marker,购于大连宝生物有限公司;病毒基因组DNA/RNA提取试剂盒和Fast Quant RT kit试剂盒,购于天根生化科技(北京)有限公司;其他试剂均为国产分析纯。
1.2 方 法
1.2.1 引物的设计与合成 根据GenBank中登录的AIV的M基因(GenBank登录号:KC767262)、NDV的F基因(GenBank登录号:KT445901.1)和FAV-4型腺病毒的Hexon基因(GenBank登录号:AY581297.1)序列,参考国内外相关研究[2,6,9],应用引物设计软件Primer Premier 5.0设计3对引物(表1)。引物由Invitrogen公司合成,稀释至20 μmol/L备用。
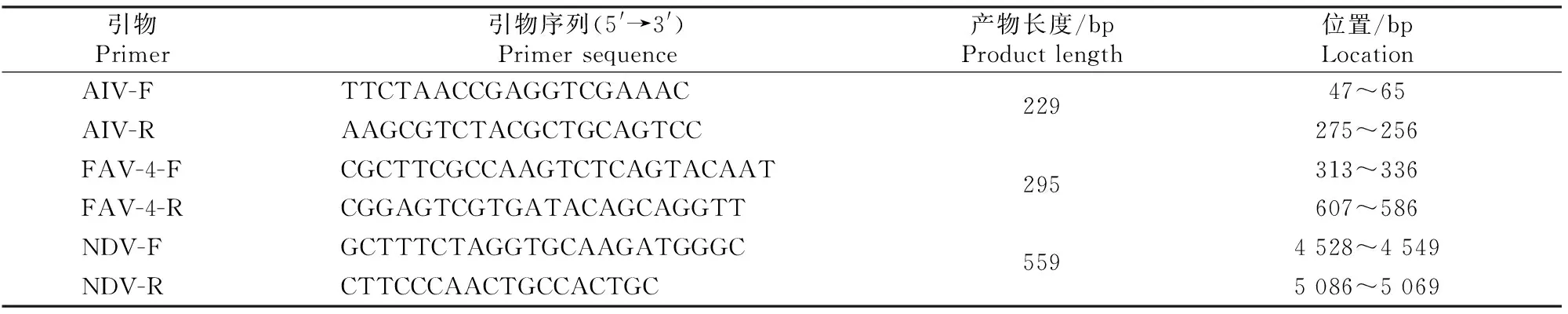
表1 PCR引物信息Table 1 Information of PCR primers
1.2.2 病毒DNA/RNA的提取和反转录 取3支1.5 mL离心管,分别加入3种病毒液200 μL,然后分别加20 μL Proteinase K,用病毒基因组DNA/RNA提取试剂盒提取AIV和NDV的RNA及FAV-4的DNA,备用。按照Fast Quant RT Kit试剂盒说明书,将AIV、NDV的RNA反转录为cDNA,反应体系为:核酸 2 μg,10×Fast RT Buffer 2 μL,RT Enzyme Mix 1 μL,FQ-RT Primer Mix 2 μL,RNase-Free ddH2O补至20 μL;反应条件:42 ℃孵育15 min,95 ℃孵育 3 min。得到的反转录产物于-20 ℃保存,备用。
1.2.3 单项PCR检测 分别以反转录合成的AIV、NDV的cDNA及FAV-4 DNA为模板,进行单重PCR扩增。PCR扩增体系为25 μL:Premix rTaqDNA聚合酶混合物12.5 μL,对应的上、下游引物各0.5 μL (20 μmol/L),cDNA 2 μL,去离子水9.5 μL。PCR程序:预变性94 ℃ 5 min;94 ℃ 30 s,50 ℃ 30 s,72 ℃ 25 s,25个循环;最后72 ℃再延伸10 min,对PCR产物进行1%核酸琼脂糖凝胶电泳,观察目的条带。
1.2.4 多重PCR反应条件的优化 用NanoDrop2000超微量分光光度计(赛默飞世尔科技公司)测定提取的NDV、FAV-4和AIV的核酸的质量浓度分别为76.1,95.0和87.5 ng/μL,将其统一稀释为50 μg/L备用。取3种病毒核酸各1 μL,混合后作为多重PCR模板,3种病毒的上、下游引物各取1 μL,Premix rTaqDNA聚合酶混合物25 μL,去离子水补足至50 μL,构建多重PCR反应体系;PCR程序: 94预变性℃ 5 min;94 ℃ 30 s,45~53 ℃ 退火30 s,72 ℃ 25 s,25个循环;最后72 ℃再延伸10 min。对多重PCR退火温度(45,47,49,51,53 ℃)和引物浓度(AIV、NDV、FAV-4引物浓度均设0.2,0.4,0.6,0.8,1.0 μmol/L 5个梯度)反应条件进行优化,对PCR产物进行1%核酸琼脂糖凝胶电泳,观察目的条带,选择最佳退火温度和引物浓度。
1.2.5 多重PCR特异性、灵敏性和重复性试验 采用优化后的条件,在反应体系中分别加入3种病毒的反转录产物以及3种反转录产物混合物作为模板,同时分别用IBV和IBDV的cDNA、FPV和MDV的DNA及灭菌双蒸水作为模板进行反应,对PCR产物进行1%琼脂糖凝胶电泳,观察目的条带,检验多重PCR方法的特异性。
取上述不同质量浓度的3种病毒的核酸,将其等体积混合后进行51~56倍比稀释后,采用优化的扩增条件进行多重PCR扩增,检测多重PCR反应的灵敏性。
应用建立的多重PCR方法,分别对AIV、NDV、FAV-4的核酸及3个病毒核酸混合阳性样品、IBV的cDNA、IBDV的cDNA、FPV的DNA、MDV的DNA及灭菌双蒸水样品各 2 份进行检测,重复3次,以检测建立的多重PCR方法的重复性。
1.2.6 临床样品检测 向1.5 mL离心管中加入临床样品研磨液200 μL,提取病原DNA/RNA,反转录(对病毒FAV-4 DNA无影响)后利用建立的多重PCR方法进行检测,以AIV、NDV、FAV-4核酸混合样品作为阳性对照,ddH2O作为阴性对照[2,6,9]。采用已经建立的单项PCR方法对临床样品进行检测,并将其结果与多重PCR方法结果进行比较。
2 结果与分析
2.1 NDA、FAV-4和AIV的单项PCR扩增
通过单项PCR检测,用琼脂糖凝胶电泳可观察到559 bp的NDVF基因、295 bp的FAV-4Hexon基因和229 bp的AIVM基因的条带,与预期结果相符,证明引物特异性良好(图1)。
2.2 AIV、NDV和FAV-4多重PCR方法中引物浓度的优化
图2表明,AIV、NDV、FAV-4引物浓度均为0.8~1.0 μmol/L时扩增效果较好。

M.DNA Marker DL2000;1.NDV F基因;2.FAV-4 Hexon基因;3.AIV M基因;4.ddH2OM.DNA Marker DL2000;1.NDV F gene;2.FAV-4 Hexon gene;3.AIV M gene;4.ddH2O图1 NDV F基因、FAV-4 Hexon基因和AIV M 基因的单项PCR扩增Fig.1 Single PCR amplification of NDV F gene,FAV-4 Hexon gene,AIV M gene
2.3 AIV、NDV和FAV-4多重PCR方法中退火温度的优化
在不同的退火温度(45,47,49,51,53 ℃)下进行多重PCR反应,琼脂糖凝胶电泳结果(图3)表明,在47 ℃时扩增效果较好,故最终选择47 ℃作为退火温度。
2.4 AIV、NDV和FAV-4多重PCR方法的特异性、灵敏性和重复性检验
图4表明,AIV、NDV、FAV-4均能扩增到相对应的目的条带,而IBV、IBDV、FPV、MDV及灭菌双蒸水的扩增结果均为阴性,说明建立的多重PCR方法特异性良好。

M.DNA Marker DL2000;1~5.退火温度 分别为45,47,49,51,53 ℃M.DNA Marker DL2000;1-5.Annealing temperatures were 45,47,49,51 and 53 ℃,respectively
AIV、NDV和FAV-4多重PCR灵敏性试验结果如图5所示。多重PCR灵敏性试验结果(图5)表明,在NDV、FAV-4和AIV的引物浓度为1.0 μmol/L时,建立的多重PCR方法能检测出NDV、FAV-4和AIV核酸的最大稀释倍数均为55倍,结合1.2.4节核酸质量浓度测定结果计算可知,该多重PCR方法能检测出的NDV、FAV-4和AIV最低核酸质量浓度分别为24.3,30.4 和28.0 pg/μL。
应用建立的多重PCR方法在不同时间对同一样品进行3次重复检测。结果表明,检测结果一致,说明该方法重复性良好。
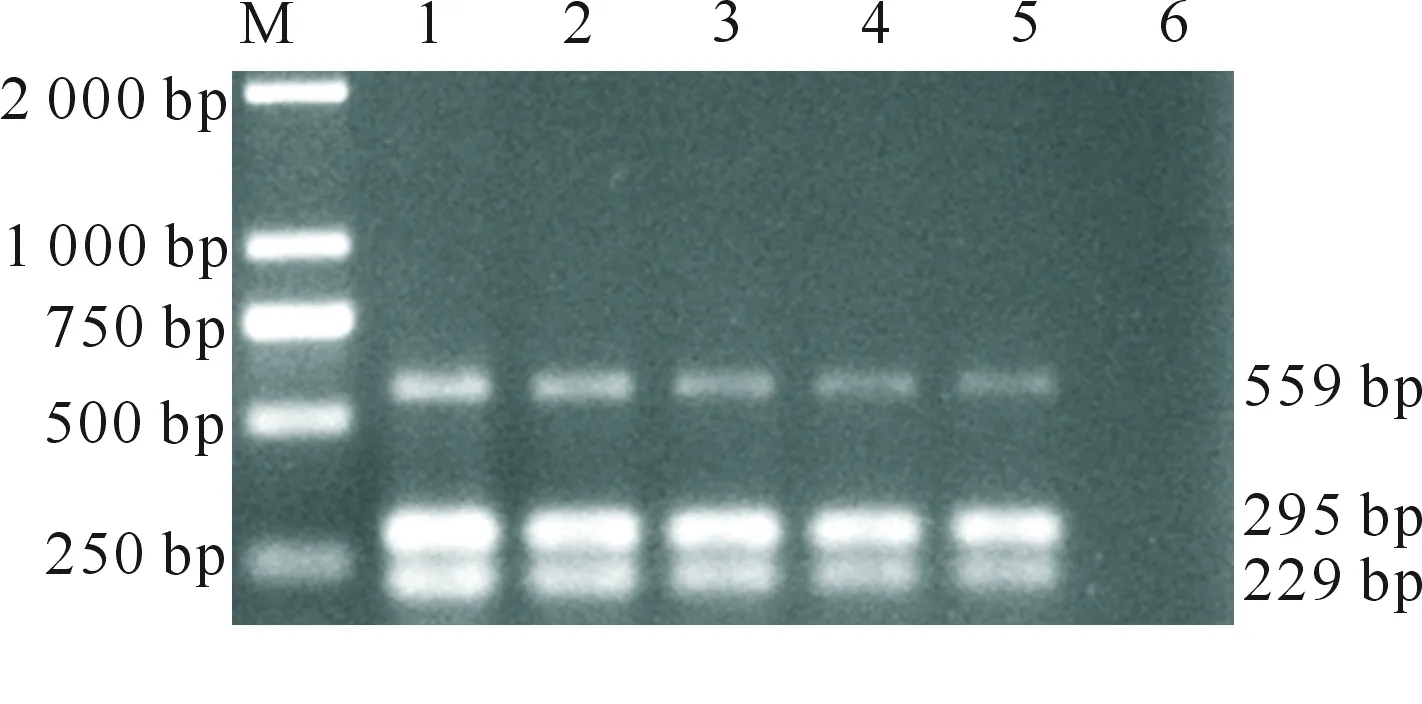
M.DNA Marker DL2000;1~6.依次为 51~56倍比稀释的病毒核酸混合物M.DNA Marker DL2000;1-6.Different dilutions of nucleic acid mixture from 51-56图5 AIV、NDV和FAV-4多重PCR灵敏性试验结果Fig.5 Sensitivity test of the multiplex PCR assay for detecting AIV,NDV and FAV-4
2.5 AIV、NDV和FAV-4多重PCR方法对临床样品的检测
应用建立的多重PCR方法,对67份采自某陕西不同地区鸡场的疑似禽流感、新城疫和安卡拉病鸡的鼻黏液、肺脏、心脏、肝脏和淋巴结等病料进行检测,对检测结果(图6)进行统计,结果(表2)表明,67份病料中NDV单纯感染的有17份,FAV-4单纯感染的有15份,AIV单纯感染的有5份,NDV和FAV-4混合感染的有4份,AIV和FAV-4混合感染的有2份,AIV和NDV混合感染的有1份,同时感染3种病毒的1份,阴性22份。将多重PCR结果和已经创建的单重PCR方法的检测结果进行比对,结果完全一致。
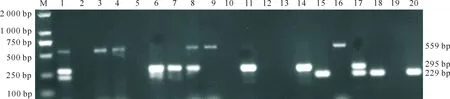
M.DNA Marker DL2000;1.阳性对照;2.阴性对照;3~20.临床样品M.DNA Marker DL2000;1.Positive control;2.Negative control (ddH2O);3-20.Clinical samples

病毒Virus样品数SampleNo.所占比率/%RateAIV57.46NDV1725.37FAV-41522.39AIV+FAV-422.99NDV+FAV-445.97AIV+NDV11.49AIV+NDV+FAV-411.49阴性Negative2232.84
3 讨 论
禽流感、新城疫和安卡拉病发病急,死亡率高,给鸡类养殖造成严重危害,而且在临床上易与产蛋下降综合征、禽多杀性巴氏杆菌病、传染性支气管炎、传染性法氏囊等病混淆[18-21],传统的临床诊断、病毒分离培养和血清学诊断等方法操作复杂耗时、结果不够准确,而且AIV和Ⅰ群FAV血清型较多,新的变异株也不断出现,而血清型特异性单抗制备困难,难以满足诊断的需要[20,22-23]。随着分子生物学技术的发展,使用PCR技术快速检测病原微生物的研究越来越多[2,6,9],与常规检测技术相比,这种方法不仅缩短了检测时间,而且节约了人力、物力,提高了工作效率,为疫情快速诊断提供了一个较好的方法,有利于及时制定应对紧急疫情的措施。用PCR方法检测NDV、AIV和FAV-4省时、结果特异、敏感性高,消除了常规血清学方法中非特异性因素的干扰及敏感性问题,可以直观地从分子水平检测到病毒核酸的存在[5-6,10]。
在多重PCR反应中,特异性引物的设计是关键,应尽量避免产生引物二聚体,防止因引物与不同模板之间的非特异性结合而造成非特异性扩增,干扰结果判定。本研究设计的引物是针对AIV的M基因、NDV的F基因和FAV-4型腺病毒的Hexon基因序列,经多次实践改进,最终选取了特异性最强的引物,避免了引物二聚体的产生,并且目的片段清晰,试验中扩增得到的目的产物经测序后比对,与NCBI上序列相似度均为100%。多重PCR的反应参数,尤其退火温度要适宜,因为多重PCR反应体系中有多对引物,退火温度过低往往会导致非特异性扩增产物出现,特异性不好;退火温度太高则难以扩增出目的条带,因此需要进行优化。另外循环次数不应过多,以利于检测扩增产物,循环次数增加会导致非特异性扩增的机率增大。本研究中的敏感性试验采用测定核酸质量浓度的方法对病毒进行定量,该法能更直观地表示所测病毒的含量而不是感染性。应用建立的多重PCR方法对67份鸡的病料进行检测,结果表明在临床上存在多种病毒混合感染的情况,并且近来FAV-4的感染率显著升高,需要对该病加强防范,防止其大流行而对禽类养殖造成严重危害。
本研究建立的多重PCR方法可直接检测收集的鸡组织病料样品,而不需对该病原进行分离培养和套式PCR反应,速度快、简便,这对快速诊断禽流感、新城疫和安卡拉病具有重要的临床应用价值。此外,本方法省去了既要提取DNA又要提取RNA的繁琐步骤,可一次性提取病毒的DNA/RNA,进行反转录(反转录过程对FAV-4的DNA无影响)和PCR,可以同时检测出RNA病毒(AIV和NDV)和DNA病毒(FAV-4),仅需4 h左右就可完成对临床样品的检测,特异性好,敏感性高,过程简单,检测方法高效可靠,因而该方法的建立对AIV、NDV、FAV-4的快速检测具有很高的使用价值和应用前景,对禽流感和新城疫和安卡拉病的快速鉴定及有效防治具有十分重要的意义。
[参考文献]
[1] 于 洋,李敬双,徐长顺,等.禽流感病毒和新城疫病毒二联RT-PCR检测方法的建立 [J].动物医学进展,2006,27(4):84-86.
Yu Y,Li J S,Xu C S,et al.Establishment of AIV and NDV by multiplex RT-PCR [J].Progress in Veterinary Medicine,2006,27(4):84-86.
[2] Xie Z,Pang Y S,Liu J,et al.A multiplex RT-PCR for detection of type A influenza virus and differentiation of avian H5,H7,and H9 hemagglutinin subtypes [J].Molecular & Cellular Probes,2006,20(3):245-249.
[3] Alexander D J.A review of avian influenza in different bird species [J].Veterinary Microbiology,2000,74(1/2):3-13.
[4] 王秀荣,刘丽玲,熊永忠,等.禽流感病毒几种RT-PCR诊断技术 [J].动物医学进展,2004,25(4):53-55.
Wang X R,Liu L L,Xiong Y Z,et al.The introduction of RT-PCR diagnostic technique for avian influenza virus [J].Progress in Veterinary Medicine,2004,25(4):53-55.
[5] Wang J,Chao T,Wang Q,et al.Apoptosis induction and release of inflammatory cytokines in the oviduct of egg-laying hens experimentally infected with H9N2 avian influenza virus [J].Veterinary Microbiology,2015,177(3/4):319-325.
[6] 龚振华,马育芳,蒋正军,等.用RT-PCR检测新城疫病毒的研究 [J].中国动物检疫,1998,15(2):5-8.
Gong Z H,Ma Y F,Jiang Z J,et al.Research on the detection of newcastle disease virus RT-PCR [J].Chinese Journal of Animal Quaranitine,1998,15(2):5-8.
[7] Nidzworski D,Smietanka K,Minta Z,et al.Detection of avian influenza virus and newcastle disease virus by duplex one step RT PCR [J].Open Life Sciences,2015,8(6):520-526.
[8] Zhang T,Jin Q,Ding P,et al.Molecular epidemiology of hydropericardium syndrome outbreak-associated serotype 4 fowl adenovirus isolates in central China [J].Virology Journal,2016,13(1):188-195.
[9] 常维山,王 涛.鸡心包积液综合征(安卡拉病)病原分离检测 [J].中国动物保健,2015(12):25-26.
Chang W S,Wang T.Isolation and detection of the pathogen of hydropericardium syndrome (Ankara disease) [J].China Animal Health,2015(12):25-26.
[10] 袁万哲,张 姗,陈 萍,等.禽腺病毒4型PCR检测方法的建立与应用 [J].中国动物检疫,2016,33(5):72-74.
Yuan W Z,Zhang S,Chen P,et al.Development and application of PCR assay for detection on Fowl Adenovirus 4 [J].China Animal Health Inspection,2016,33(5):72-74.
[11] Li H.Fowl adenovirus species C serotype 4 is attributed to the emergence of hepatitis-hydropericardium syndrome in chickens in China [J].Infection Genetics & Evolution,2016,45:230-241.
[12] Niu Y J,Sun W,Zhang G H,et al.Hydropericardium syndrome outbreak caused by fowl adenovirus serotype 4 in China in 2015 [J].Journal of General Virology,2016,97:2684-2690.
[13] Zhuang Q Y,Wang S C,Wu M L,et al.Epidemiological and risk analysis of the H7N9 subtype influenza outbreak in China at its early stage [J].Science Bulletin,2013,58(26):3183-3187.
[14] Ansari W K,Parvej M S,El Zowalaty M E,et al.Surveillance,epidemiological,and virological detection of highly pathogenic H5N1 avian influenza viruses in duck and poultry from Bangladesh [J].Veterinary Microbiology,2016,193:49-59.
[15] Li H.Fowl adenovirus species C serotype 4 is attributed to the emergence of hepatitis-hydropericardium syndrome in chickens in China [J].Infection Genetics & Evolution,2016,45:230-241.
[16] Zhang Y Y,Shao M Y,Yu X H,et al.Molecular characterization of chicken-derived genotype VIId newcastle disease virus isolates in China during 2005-2012 reveals a new length in hemagglutinin-neuraminidase [J].Infection Genetics & Evolution Journal of Molecular Epidemiology & Evolutionary Genetics in Infectious Diseases,2014,21:359-366.
[17] Panus A.Newcastle disease virus infection study on duck and chicken in Subang district [J].Jurnal Ilmu Ternak Dan Veteriner,2015,20(2):134-147.
[18] Kim J N,Byun S H,Min J K,et al.Outbreaks of hydropericardium syndrome and molecular characterization of Korean fowl adenoviral isolates [J].Avian Diseases,2008,52(3):526-530.
[19] Asthana M,Singh V K,Kumar R,et al.Isolation,cloning and in silico study ofhexongene of fowl adenovirus 4 (fav4) isolates associated withhydropericardium syndrome in domestic fowl [J].Journal of Proteomics & Bioinformatics,2011,4(9):190-195.
[20] 朱迪国,宋建德,黄保续.当前全球禽流感流行概况及特点分析 [J].中国动物检疫,2015,22(3):41-47.
Zhu D G,Song J D,Huang B X.Analysis on the current situation global of avian inlfuenza prevalence [J].Chinese Journal of Animal Health Inspection,2015,22(3):41-47.
[21] Fernandes C C,Varani A M,Lemos E G M,et al.Molecular and phylogenetic characterization based on the complete genome of a virulent pathotype of newcastle disease virus isolated in the 1970s in Brazil [J].Infection Genetics & Evolution Journal of Molecular Epidemiology & Evolutionary Genetics in Infectious Diseases,2014,26:160-167.
[22] 袁万哲,李玉保,王建昌,等.鸡心包积液-肝炎综合征的初步研究 [J].中国兽医科学,2016(2):157-160.
Yuan W Z,Li Y B,Wang J C,et al.Preliminary studies on chicken pericardial effusion and hepatitis syndrome [J].Chinese Veterinary Science,2016(2):157-160.
[23] Park H S,Lim I S,Kim S K,et al.Molecular analysis of the hexon,penton base,and fiber-2 genes of Korean fowl adenovirus serotype 4 isolates from hydropericardium syndrome-affected chickens [J].Virus Genes,2016,53:111-116.
