帕金森病患者康复训练后步态改善及其与疼痛的相关性分析
2018-05-07吴晓强张晓玲官俏兵王琰萍徐从英
吴晓强,张晓玲,官俏兵,王琰萍,徐从英
帕金森病(Parkinson's disease,PD)是运动症状和非运动症状并存的神经退行性疾病,运动症状以步态障碍为主,可表现为跌倒、步态冻结等,加速并发症出现。疼痛作为非运动症状之一,发病率高,发作形式及程度多样,现已备受关注,而临床中缺乏针对性治疗。康复训练作为非药物治疗手段对改善帕金森症亦起到一定作用[1]。正确合理的康复训练可明显改善运动障碍和平衡能力,减少跌倒及并发症发生,同时可减少药物使用[2]。本研究在基础药物治疗上,探讨强化康复训练对PD患者步态的影响,同时分析步态与PD疼痛的相关性。
1 资料与方法
1.1 一般资料 选取2015年6月~2016年12月期间入住我院神经内科及康复科的PD伴相关疼痛患者57例,患者入组标准:PD诊断由主治及以上医师根据患者的临床症状及辅助检查作出,符合2014年中国帕金森病临床诊断标准"[3],采用统一PD评定量表在入组患者研究前后1天中症状最轻时进行评估;PD患者Hoehn.Yahr分期<3期;年龄50~75岁;病程≥1年;简易精神量表(minimental status examination,MMSE)及蒙特利尔认知评估量表(Montreal cognitive assessment,MoCA)筛查无认知功能障碍;患者自愿同意参加该项研究,并签署知情同意书。排除标准:PD患者分期≥3期;帕金森综合征患者,包括外伤性、肿瘤性、药源性、中毒性、血管性及脑积水等所致的;患有其它系统严重疾病者;病程<1年;患者有明显认知障碍;任何原因未完成完整疗程者;类风湿性关节炎、腰肌劳损、颈椎病、带状疱疹、脑血管病及其他躯体疾病引起的疼痛。采用随机数据表法分为对照组28例和康复训练组29例,2人康复训练中退出,共55例,①训练组27例:男12例,女15例;年龄(61.80±7.91)岁; 病程(3.40±1.65)年;体重指数(24.2±2.89)kg/m2;MoCA评分(18.93±5.61)分;MMSE评分(26.31±3.52);HAMD评分(7.59±4.67)分;H-Y分期(2.35±0.52)级。②对照组28例:男15例,女13例;年龄(63.47±10.62)岁; 病程(3.77±2.38)年;体重指数(25.8±3.26)kg/m2;MoCA评分(27.62±2.95)分; MMSE评分(27.62±2.95);HAMD评分(6.67±3.83)分;H-Y分期(2.20±0.41)级。2组一般资料比较差异无统计学意义。
1.2 方法 2组患者均给予常规美多芭类制剂药物治疗,根据病情适度调整,且康复训练均避开PD关期。训练组加用康复训练干预,康复训练包括:①床边康复训练:四肢大关节活动度训练,尽量完成关节活动范围内主被动活动;四肢及躯干肌肉等长牵伸,以伸肌为主;康复治疗师空心掌垂直敲击四肢伸屈肌,以小腿后组肌群和大腿前组肌群为主,频率及轻重适度,患者无疼痛等不适感为宜;每日1次,40min。共2周。②室内平衡及步态训练:视听刺激,起步时给予视觉刺激,即地毯上刻度线,起步后予以口令有节奏的行走;坐位训练,患者坐于垫子上,以肩部配合臀部“向前”或“向后”行走,并保持躯干平衡;卧位训练,仰卧时,双手持健身棒同时向左右旋转,躯干配合旋转;俯卧位伸髋,往复快速伸屈膝关节进行两足往复运动;手足交互训练,患者坐于椅子上,肩部及躯干的配合下,抬起上肢和对侧下肢,使手尽可能触到下肢远端,再重心转移至对侧,做镜像动作,即手足反向互动训练;双臂交叉胸前,重心前移,做坐立往复运动,并保持身体平衡。以上训练均在康复治疗师保护下进行,每日1次,每次1~2h,共4周。
1.3 评定标准 ①步态及分析方法:采用GW-02型步态分析仪,安静环境中,测定前均进行系统标定,标定后在受试对象体表定点,要求每位对象以最大能力安全步行,分析系统测试长度在12m步道上完成,收集受试对象的运动信息后经分析软件自动建立三维坐标,经系统数据处理后记录患者步频、步长、步速、关节活动角度、支撑相等步态指标,步行过程在康复治疗师的保护下进行,共测试3次,取均值。②步态稳定性:采用Berg平衡量表(Berg balance scale,BBS),分为14项,每项5级,最高得分4分,最低得分0分,分数越高表示平衡能力越好。③疼痛强度评估:采用视觉模拟评分法(visual analogue scale,VAS)进行疼痛强度评估,评分范围为1~100分,分值大者,疼痛强度越重。涉及帕金森疼痛类型,依据Ford分类法主要为:肌肉骨骼痛;神经根性痛;肌张力障碍相关疼痛;中枢性疼痛,本研究针对前3种疼痛。入组患者均未行相关疼痛治疗,且采用汉密尔顿抑郁量表(hamilton depression scale,HAMD)排除抑郁者。

2 结果
2周床边训练及4周室内步态平衡训练后,训练组患者步速、步长、髋关节屈曲最高角度、双支撑相、UPDRSIII评分、BBS评分及VAS评分与治疗前比较均存在统计学意义(均P<0.05);训练组患者在步速、髋关节屈曲最大角度、双支撑相、BBS评分及VAS评分与对照组比较存在统计学意义(均P<0.05);对照组治疗前后各项指标比较差异无统计学意义。见表1。
训练组不同疼痛类型比率为肌肉骨骼痛(65.5%),神经根性痛(26.8%),肌张力障碍相关疼痛(40.1%),中枢性疼痛(11.1%);对照组肌肉骨骼痛(60.7%),神经根性痛(17.8%),肌张力障碍相关疼痛(32.1%),中枢性疼痛(7.1%),部分患者存在两种及以上疼痛。2组间4种疼痛比率差异无统计学意义。
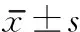

组别n时间步速(m/s)步长(cm)髋关节屈曲最大角度(°)双支撑相(%)UPDRSIII(分)BBS(分)VAS(分)训练组27治疗前0.59±0.1234.64±11.1222.32±3.7528.14±3.3026.31±12.9138.63±3.2562.33±21.65治疗后0.70±0.08ab38.70±9.54a28.15±4.11ab22.72±5.61ab22.06±9.25a47.24±4.78ab53.12±19.80ab对照组28治疗前0.61±0.0935.52±9.8623.48±4.0427.56±4.4625.06±10.3239.56±4.5960.73±23.77治疗后0.63±0.1135.08±10.9722.62±3.7326.48±3.9625.42±11.1039.71±3.4758.52±24.55
与治疗前比较,aP<0.05;与对照组治疗后比较,bP<0.05
训练组治疗后,经相关性分析,患者髋关节屈曲最大角度与VAS疼痛评分、平衡能力存在相关性(r=-0.61、0.53,均P<0.01);步速与VAS疼痛评分、平衡能力存在相关性(r=-0.48、0.69,P<0.05;P<0.01);双支撑相与平衡能力存在相关性(r=-0.71,P<0.01);双支撑相与VAS疼痛评分之间未发现明显相关性(r=0.37,P>0.05)。
3 讨论
PD是以运动缓慢、步态姿势异常为主要特征的神经系统疾病,早期PD患者即出现一系列的异常步态姿势,如步长及步速的下降[4],双下肢支撑相延长,双侧运动协调性改变等[5]。目前临床中多数PD患者仅采用药物治疗多项运动障碍,但步态协调及姿势平衡对多巴胺替代并不敏感[6],康复训练可以通过调节神经营养因子、血管再生、突触分化,基础代谢,免疫炎症等延长独立生活时间[7-8],减少并发症,延缓病情发展[8]。Li等[9]研究发现,一定强度的太极拳锻炼可以增强PD患者平衡能力、姿势控制能力、下肢肌肉力量及稳定性等各项身体功能。但目前国际上并没有统一的康复训练方法和标准。
本研究是在日常生活及药物治疗基础上,针对步态及姿势控制系统障碍引入运动干预方法,即综合静态床边训练及动态室内训练。床边训练参照Bobath易化牵拉技术,对异常的痉挛姿势和运动模式采用反射性抑制手法,抑制异常姿势和肌力作用,松弛已增高的肌张力,缓解因肌张力增高或痉挛所引起的疼痛,同时增大关节的活动范围。另外,肢带肌局部叩击可以松弛肌肉,消耗蓄积的乳酸,改善患者震颤及僵硬[10],减少早期患者的紧张情绪及不适感。室内训练主要以平衡训练和步态训练为主,可有效地提高老年人的本体感觉的敏感性及神经系统对感觉刺激的综合处理能力[11],常用的平衡训练有坐站起、左右的重心转移等。我们设计了从坐、卧、立、行等方面综合锻炼PD患者的重心转移及左右侧交互,6周的训练明显增加了手足的协调能力及正确的姿势步态。Brichetto等[12]联合视觉及听觉刺激,对帕金森病患者进行步态矫正,研究结果表明侧重对姿势平衡和重心移动的锻炼,可以有效提示步速及步距,明显改善患者的生活质量,Plotnik等[13]亦在听觉的提示下对“开期”帕金森病患者进行长达6周的康复,训练结束时发现步态障碍发生时间及次数减少,上述研究在康复训练中采用了视听觉刺激,这与患者可能存在高级中枢功能缺损及皮层及皮层下感知综合处理能力下降,如注意力下降[14],Knobl等[15]发现步态的不协调可依靠认识得到纠正,额外信息输入可用于调整步态距离和姿势平衡[5],故室内训练增加听觉及视觉提示,即语言或音乐指令、地面标识,有利于PD患者对周围环境空间结构信息等进行加工,利于做出动作的判断。但亦有研究者提出相反的观点,PD患者基底节区功能异常以及与额叶联络受阻,更以受外界干扰,视听觉提示在康复训练中具体机制及作用有待进一步研究和明确。
目前帕金森病相关疼痛的治疗未见大规模的随机对照研究。多巴胺是帕金森病特征性递质,在机体不同水平调节疼痛,包括脊髓、丘脑、中脑导水管周围灰质、基底节和扣带回[16],PD动物模型表明,运动可通过促进多巴胺突触传递,形成突触传递长时程增强[8],早期帕金森患者康复训练上调了基底节区多巴胺D2受体连接蛋白,从而改变突触可塑性[17],帕金森病患者影像学研究也表明平衡训练可诱导脑结构可塑性改变[18],研究中我们对VAS评分、平衡能力与髋关节最大屈曲角度、步速、双支撑相进行了相关性分析,髋关节屈曲最大角度与VAS疼痛评分、平衡能力存在相关性;步速与VAS疼痛评分、平衡能力存在相关性;双支撑相与平衡能力呈负相关性,说明疼痛程度减轻一定程度上取决于康复训练对患者髋关节屈度和步速的改善;康复训练对平衡的改善可以运用髋关节屈度和步速来综合评估。尽管双支撑相与疼痛之间未发现有相关性,可能由于样本不足或运动中外界视觉或听觉的干预作用存在,但康复训练不仅促进步态姿势恢复,亦减轻PD患者的疼痛,故有理由推测多巴胺可能是疼痛及步态姿势异常共同递质基础,这为临床帕金森疼痛治疗实践提供一参考依据。
总之,本研究结果,帕金森病药物治疗基础上配合有效的康复训练,可明显改善患者姿势及步态异常,同时有利于疼痛减轻,且该治疗依从性好,值得临床应用。
【参考文献】
[1] 刘燕平, 陈美云. Lokomat下肢康复机器人对改善帕金森病患者步行能力的疗效研究[J].中国康复,2017,32(1):30-32.
[2] 葛中林, 钱明月, 谭玉, 等. 运动疗法对帕金森病患者肌张力及步态的影响[J].蚌埠医学院学报,2015,12(3):336-338.
[3] 中华医学会神经病学分会帕金森病及运动障碍学组. 中国帕金森病治疗指南(第3版)[J]. 中华神经科杂志, 2014, 30(6): 428-433.
[4] Spildooren J, Vercruysse S, Desloovere K, et al. Freezing of gait in Parkinson's disease: the impact of dual-tasking and turning[J]. Mov Disord, 2010,25(15):2563-2570.
[5] Knobl P, Kielstra L, Almeida Q. The relationship between motor planning and freezing of gait in Parkinson's disease[J]. J Neurol Neurosurg Psychiatry, 2012,83(1):98-101.
[6] Boonstra TA, van der Kooij H, Munneke M, et al. Gait disorders and balance disturbances in Parkinson's disease: clinical update and pathophysiology[J]. Curr Opin Neurol, 2008,21(4):461-471.
[7] Frazzitta G, Balbi P, Maestri R, et al. The beneficial role of intensive exercise on Parkinson disease progression[J]. Am J Phys Med Rehabil, 2013,92(6):523-532.
[8] Petzinger GM, Fisher BE, McEwen S, et al. Exercise-enhanced neuroplasticity targeting motor and cognitive circuitry in Parkinson's disease[J]. Lancet Neurol, 2013,12(7):716-726.
[9] Li F, Harmer P, Fitzgerald K, et al. Tai chi and postural stability in patients with Parkinson's disease[J]. N Engl J Med, 2012,366(6):511-519.
[10] Haas CT, Turbanski S, Kessler K, et al. The effects of random whole-body-vibration on motor symptoms in Parkinson's disease[J]. NeuroRehabilitation, 2006,21(1):29-36.
[11] 孙彦, 李春玲, 李萍. 运动干预对老年步态障碍患者功能康复影响的研究进展[J].中国老年学杂志,2013,33(16):4079-4081.
[12] Brichetto G, Pelosin E, Marchese R, et al. Evaluation of physical therapy in parkinsonian patients with freezing of gait: a pilot study[J]. Clin Rehabil, 2006,20(1):31-35.
[13] Plotnik M, Shema S, Dorfman M, et al. A motor learning-based intervention to ameliorate freezing of gait in subjects with Parkinson's disease[J]. J Neurol, 2014,261(7):1329-1339.
[14] Amboni M, Cozzolino A, Longo K, et al. Freezing of gait and executive functions in patients with Parkinson's disease[J]. Mov Disord, 2008,23(3):395-400.
[15] Cubo E, Leurgans S, Goetz CG. Short-term and practice effects of metronome pacing in Parkinson's disease patients with gait freezing while in the 'on' state: randomized single blind evaluation[J]. Parkinsonism Relat Disord, 2004,10(8):507-510.
[16] Chaudhuri KR, Schapira AH. Non-motor symptoms of Parkinson's disease: dopaminergic pathophysiology and treatment[J]. Lancet Neurol, 2009,8(5):464-474.
[17] Fisher BE, Li Q, Nacca A, et al. Treadmill exercise elevates striatal dopamine D2 receptor binding potential in patients with early Parkinson's disease[J]. Neuroreport, 2013,24(10):509-514.
[18] Conde V, Vollmann H, Taubert M, et al. Reversed timing-dependent associative plasticity in the human brain through interhemispheric interactions[J]. J Neurophysiol, 2013,109(9):2260-2271.
