免疫磁珠分离技术联合流式细胞术检测ENU致大鼠体内Pig-a基因突变
2018-05-04秦美蓉郑丹丹黄泽愉王晓炜李俊鹏王平
秦美蓉,郑丹丹,黄泽愉,王晓炜,李俊鹏,王平
(深圳市药品检验研究院,深圳药品质量标准研究重点实验室,广东 深圳 518057)
Pig-a基因是机体合成糖化磷脂酰肌醇(glycosyl-phosphatidyl inositol,GPI)的关键基因,Pig-a基因突变导致细胞表面CD59、CD55、CD48等GPI锚连蛋白缺失[1-2]。Pig-a基因存在于X染色体上,结构高度保守,人和不同动物种属的Pig-a基因具有同源性。通过流式细胞术检测大鼠外周血红细胞突变表型率(RETCD59-、RBCCD59-)可以检测大鼠Pig-a基因突变情况,根据这个原理,近年来国外建立了一种新的基因突变试验,即体内Pig-a基因突变试验,用于化学品的遗传毒性评价[3-4]。由于大鼠外周血红细胞Pig-a基因突变率很低,直接分析法需要检测大量的外周血细胞(1×106以上),样本检测时间很长,并且容易出现检测结果为0的情况[5]。本研究旨在利用抗原抗体特异性结合原理和磁性吸附原理,参考Litro Labs网站[6]及Dertinger等[5]方法,运用免疫磁珠分离技术去除野生型RETs和RBCs,从而使突变型细胞得到富集,扩大目标细胞检测数量,缩短流式细胞仪的检测时间,进一步提高Pig-a基因突变试验方法的准确性和检测效率。
目前,Pig-a基因突变试验四个阶段的国际联合验证已经基本完成[7]。2014年,人用药品注册技术要求国际协调会议(International Council for Harmonization,ICH)M7指南将Pig-a基因突变试验纳入体外突变阳性结果的后续试验中[8]。2015年5月,该试验方法被批准开始经济合作与发展组织(Organization for Economic Co-operation and Development,OECD)指导原则起草工作,预计2020年完成OECD指导原则制定[9]。我国已于2017年5月正式加入ICH,积极开展遗传毒性新方法研究,有利于提高我们在ICH指导原则修订上的话语权。要将该方法引入到我国的标准体系,应用到药物、化妆品及食品的安全性评价中,需要根据我国国情,对方法进行转化及验证。张铭等[10]使用美国Litro实验室提供的标准化试剂盒及分析软件进行了该方法的高通量研究。本研究使用可以方便获得的试剂,运用Excel软件进行结果分析,拓宽了实验条件,降低了研究门槛,是对国际验证很好的补充,可以为国内实验室开展联合验证、推广及建立我国标准化检测方法提供数据支持。
1 材料与方法
1.1 材料
1.1.1 实验动物
20只SPF级雄性SD大鼠,7~8周龄,由广东省医学实验动物中心提供【SCXK(粤)2013-0002】。饲养于深圳市药品检验研究院屏障环境动物实验室【SYXK(粤)2015-0157】,饲养期间给予大鼠标准饲料(广东省医学实验动物中心提供)及灭菌城市生活用水。饲养室温度20~25℃,湿度40%~70%,12 h昼夜明暗交替。所有操作均符合实验动物伦理学要求。
1.1.2 受试物
N-乙基-N-亚硝基脲(N-ethyl-N-nitrosourea,ENU),CAS号:759-73-9,Sigma公司生产。
1.1.3 主要试剂和仪器
PE Mouse Anti-Rat CD59,BD公司;PE anti-rat CD61 Antibody, Biolegend公司;抗PE微珠,德国美天旎公司;绝对计数珠和SYTO13核酸染料,Invitrogen公司;哺乳动物淋巴细胞分离液,加拿大Cedarlane公司。其他试剂均为国产分析纯。FC500流式细胞仪,美国贝克曼库尔特公司;磁力分离器(QuadroMACSTMSeparator),德国美天旎公司。
1.2 实验方法
1.2.1 动物染毒
大鼠适应环境5 d后随机分为4组,分别为:溶剂对照组、ENU三个剂量组:20、40、80 mg/ (kg·bw),低、中、高剂量组分别灌胃不同浓度的ENU溶液,对照组灌胃灭菌水,灌胃体积10 mL/ (kg·bw)。每天灌胃1次,连续3 d。
1.2.2 溶液配制
用稀释液1(含2%胎牛血清的PBS)稀释抗体,制备含PE-Anti-CD59(终浓度10 μg/mL)和PE-Anti-CD61(终浓度0.25 μg /mL)的抗体溶液。用稀释液1将抗PE磁性微珠稀释5倍,制备磁珠分离液。用稀释液1制备含有核酸染料(终浓度稀释1000倍)和计数微球(终浓度稀释30倍)的混合染液。
1.2.3 血样采集及分离
于受试物灌胃前1 d和灌胃后第7、14、28天尾静脉采血,每只动物取120 μL 血液与肝素钠溶液混匀,加入至1.5 mL淋巴细胞分离液中,800 g离心20 min,吸去上清,按140 μL/样本加入预冷的PBS溶液,混匀后转移至1.5 mL稀释液1中,混匀,240 g离心10 min,去除上清,按140 μL /样本加入预冷的PBS溶液,混匀后2~8℃保存备用。
1.2.4 抗体标记
取160 μL分离好的血样加入到100 μL抗体溶液中,混匀,在2~8℃避光孵育30 min,转移到1.5 mL预冷的稀释液1中,340 g离心5 min,去除上清。
1.2.5 抗PE微珠孵育
往1.2.4制备的每个样品中加入100 μL磁珠分离液,吹匀,2~8℃避光孵育15 min,加入1.5 mL稀释液1,吹匀,340 g离心5 min,去除上清。
1.2.6 柱前样品染色
往1.2.5制备的样品中加入1.0 mL预冷的稀释液1,轻轻吹匀,取10 μL到990 μL混合染液中,37℃避光孵育15 min,用于柱前样本流式细胞检测。
1.2.7 免疫磁珠分离
安装免疫磁珠分离器,用3 mL预冷的稀释液1预湿分离柱,待稳定后,将1.2.6中剩余的柱前未染色样品重悬后,加入900 μL到分离柱中,加入5 mL稀释液1清洗柱子,收集洗脱液,800 g离心5 min,去除上清,得到柱后样品约50 μL,加入300 μL混合染液重悬,转移到流式管中,37℃避光孵育15 min,用于柱后样本流式细胞检测。
1.2.8 仪器校准标准品(instrument calibration standard,ICS)制备
取1.2.3中分离后得到的对照组样本20 μL,用200 μL稀释液1重悬,取5 μL到500 μL混合染液中,混匀,37℃避光孵育15 min,得A液,模拟突变细胞。1.2.6中孵育后的对照组样本为B液,模拟正常细胞。将A液和B液等体积混合,即为ICS。
1.2.9 流式细胞检测
使用ICS调节电压和荧光补偿,FITC通过FL1通道检测,PE通过FL2通道检测。对各组的柱前样本和柱后样本分别进行流式分析,检测样本中网织红细胞(reticulocytes,RET)、正染红细胞(Normochromatic Erythrocyte,NCE)、突变型网织红细胞(RETCD59-)和突变型成熟红细胞(NCECD59-)的数量。
1.2.10 数据计算
根据流式细胞仪检测结果,参考Litro Labs网站[6]及Dertinger等[5]的方法,计算样品中RET百分率(RET%)、RETCD59-和RBCCD59-的发生率,其中RBC为总红细胞,RBC=RET+NCE,Pig-a基因突变率以每1×106个细胞中发生突变的细胞数目表示。计算公式如下:
(1)样品体积及稀释数据
a=标记抗体的血液总体积(μL)
b=柱前血样体积(μL)
c=柱前染液体积(μL)
d=柱后剩余血样体积(μL)
e=柱后血样染液体积(μL)
f=细胞稀释因子=(b+ c) / b
g=细胞浓度因子=(a- b) / (d +e)
h=绝对计数珠稀释因子=(e×100) / (d + e)
(2)柱前数据
i=UL
j=UR
k=LL
l=LR
m=绝对计数珠
n=柱前RET: 绝对计数珠=(i + j)/m
o=柱前RBC: 绝对计数珠=(i + j + k + l)/m
p=% RET=(i + j) / (i + j + k + l)×100
(3)柱后数据
q=UL
r=LL
s=绝对计数珠
(4)基于柱前和柱后数据计算
t=总RET当量=n×s×f×g×100/h
u=总RBC当量=o×s×f×g×100/h
v=每106个总RETs中突变RETs数量=q / t×(106)
w=每106个总RBCs中突变RBCs数量=(q + r) / u×(106)
1.3 统计学分析
使用SPSS软件进行方差分析,P<0.05为差异有显著性。
2 结果
2.1 流式细胞检测方法的建立及优化
使用ICS调校流式细胞仪电压和荧光补偿,左下象限的Y轴荧光强度几何均值与右下象限差值<0.1,左上象限的X轴荧光强度几何均值与左下象限的差值<0.1,大鼠外周血中RET、NCE、RETCD59-和NCECD59-四种细胞群能明显区分,见图1A。样本经过免疫磁珠分离后,去除了大量的野生型细胞,流式细胞仪捕获到的突变细胞数RETCD59-和NCECD59-从柱前样本的102数量级增加到104数量级,大幅提高了检测方法的准确性。见图1B和图1C。
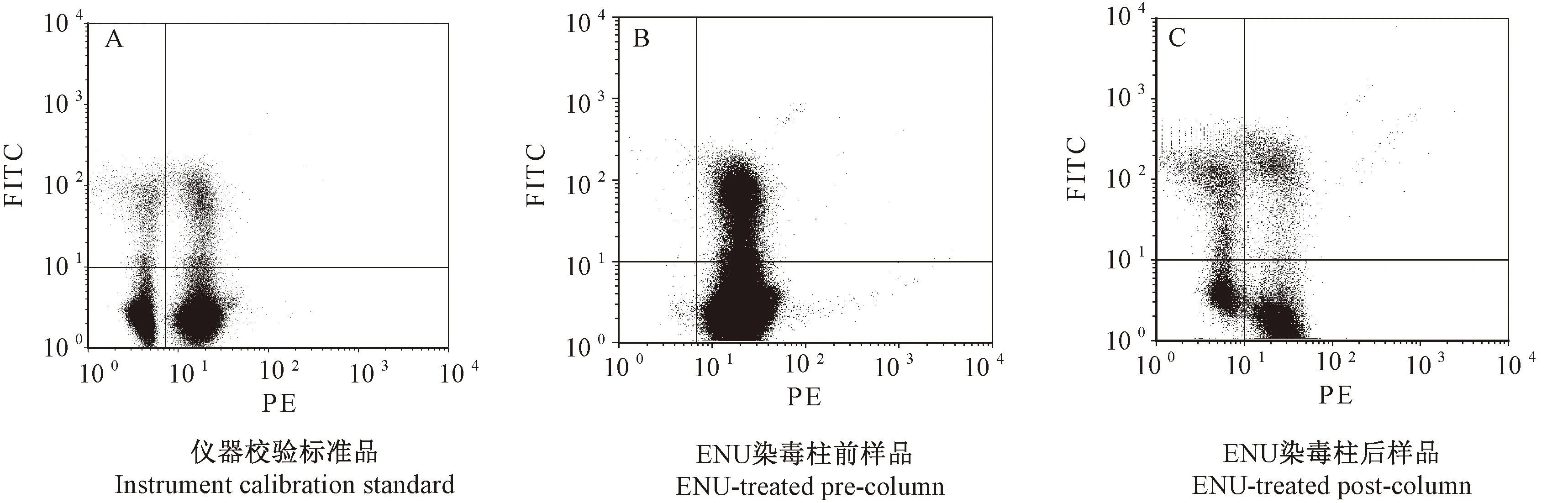
注:A: 使用含有标记及未标记PE-Anti-CD59的样本混合溶液作为仪器校验标准品,调节电压和荧光补偿,四种细胞得以明显区分开。B: 采集血样进行柱前分析,血样来自ENU中剂量组的大鼠,染毒后第14天采血,分析1×106个细胞,分析时间为8 min。C:采集与图B同一只大鼠的外周血,分析2×105个细胞,分析时间为3 min。图中四个象限分别代表:左上象限(UL)为RETCD59-;右上象限(UR)为RETCD59+;左下象限(LL)为NCECD59-;右下象限(LR)为NCECD59+。图1 FITC-PE通道的二维散点图Note. A. A mixture of PE-anti-CD59-labeled and -unlabeled cells was used as the instrument calibration standard (ICS) to calibrate the instrument, and to adjust the photomultiplier tube (PMT) voltage and fluorescence compensation, the four types of cells could be clearly distinguished. B. Blood samples of the ENU middle dose group were collected on the 14th day after treatment for pre-column analysis. The number of cells was 1×106 and the analysis time was 8 min. C: Blood sample from the same rat of the panel B was collected, and the post-column analysis of 2×105 cells was performed for 3 min. The four quadrants in the figure represent respectively: left upper quadrant (UL) is RETCD59-; right upper quadrant (UR) is RETCD59 +; left lower quadrant (LL) is NCECD59-; and right lower quadrant (LR) is NCECD59 +.Fig.1 Representative bivariate dot plots ilustrating the distribution of four FITC-PE fluorescent cell populations
2.2 大鼠外周血RET%检测结果
给予ENU后,各组大鼠RET%随时间延长而降低,与对照组相比差异均无显著性(P>0.05)。图2。
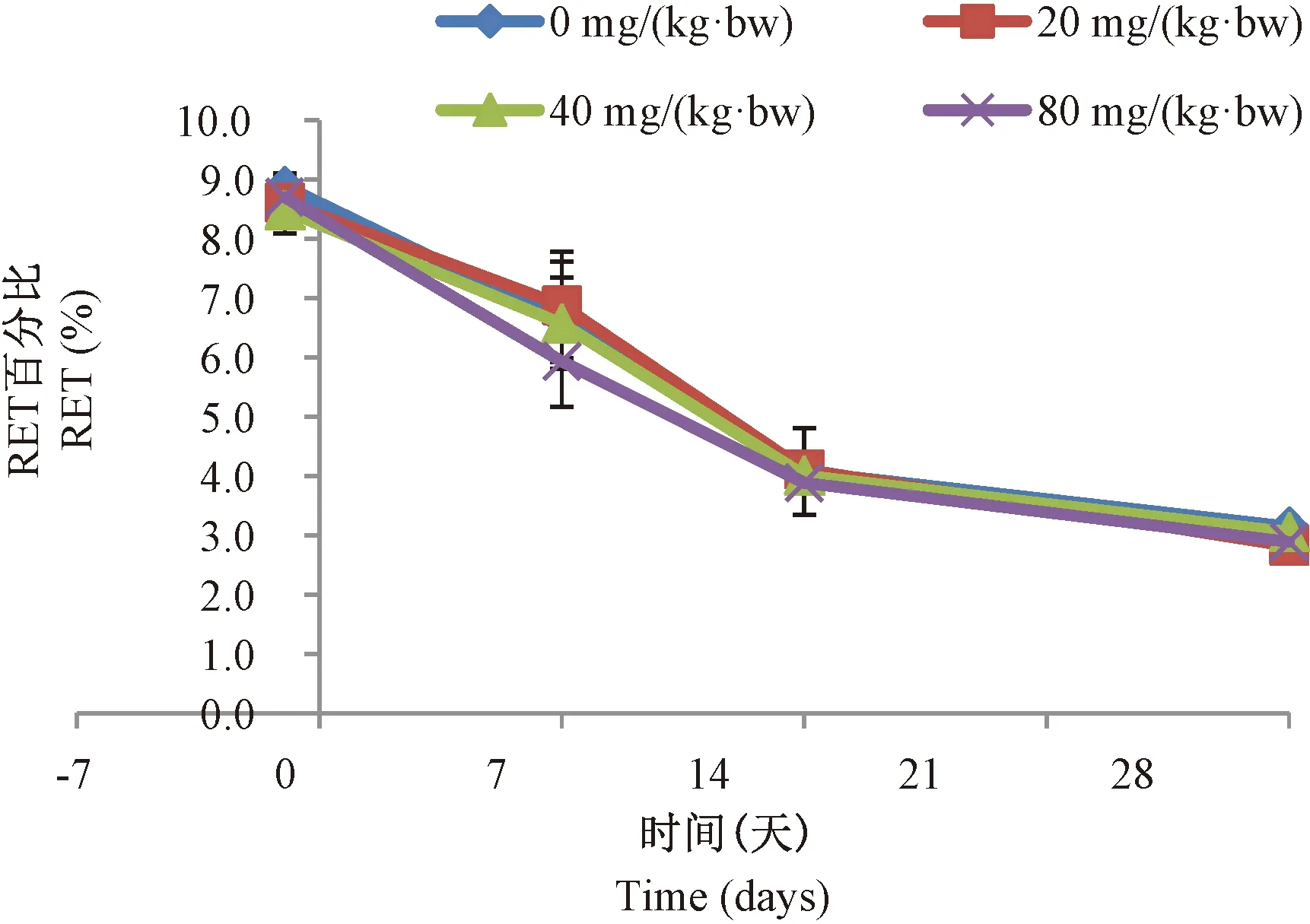
注:与溶剂对照组比较,*P<0.05,n=5。图2 大鼠外周血RET%随时间和剂量的变化Note.*P<0.05, compared with the control group, n=5.Fig.2 Changes of the percentage of Peripheral blood RET% with time and dose
2.3 大鼠外周血RETCD59-发生率检测结果
大鼠连续给予NEU 3 d后,除低剂量组第7 天外,ENU各剂量组大鼠在给药后各检测时点RETCD59-率均显著高于对照组(P<0.05)。各剂量组大鼠RETCD59-率在第14天达到最高值,分别为溶剂对照组的1.7倍、3.6倍、5.7倍,随后下降。图3。
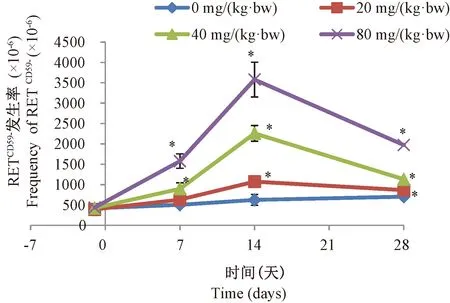
注:与溶剂对照组比较,*P <0.05,n=5。图3 大鼠外周血RETCD59-的发生率随时间和剂量的变化Note.*P<0.05, compared with the control group, n=5.Fig.3 Changes of the frequency of Peripheral blood RETCD59- with time and dose
2.4 大鼠外周血RBCCD59-发生率检测结果
大鼠连续给予NEU 3 d后, ENU各剂量组大鼠在给药后各检测时点外周血RBCCD59-率均显著高于对照组(P<0.05)。在第28天低、中、高剂量组大鼠RBCCD59-率测得值最高,分别为溶剂对照组的3.0倍、5.4倍、9.2倍。见图4。
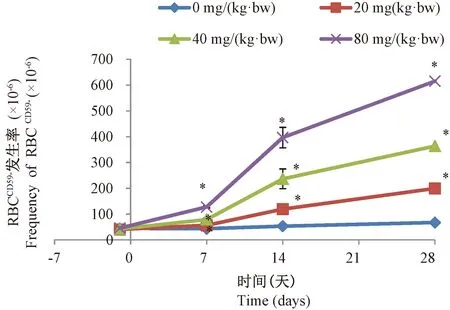
注:与溶剂对照组比较,*P<0.05,n=5。图4 大鼠外周血RBCCD59-的发生率随时间和剂量的变化Note.*P<0.05, compare with the control group, n=5.Fig.4 Change of the frequency of Peripheral blood RBCCD59- with time and dose
3 讨论
免疫磁珠分离技术是20世纪70年代发展起来的的一项与磁载体结合的免疫学技术,它同时具备了免疫学反应的高度专一性以及固相化试剂所特有的优点,对目标细胞进行富集,广泛应用于稀有细胞的检测[11-13]。本研究用PE-Anti-CD59抗体对野生型RET和RBC进行标记,将标记后的细胞与抗PE磁性微珠结合,通过磁场分选装置时,野生型RET和野生型RBC被截留,从而使突变型RBCCD59-和突变型RETCD59-的浓度大幅提高。柱后样本无法直接测出RET和RBC总数,本研究使用绝对计数微球,柱前样本和柱后样本中分别加入绝对计数微球后再进行流式细胞分析,根据柱前、柱后样本中RET和RBC与绝对计数微球的比例,计算出柱后样本RET和RBC当量,进而得出柱后样本RBCCD59-率和RETCD59-率。本研究利用免疫磁珠分离技术和流式细胞术相结合,检测的RET和RBC目标细胞数可达直接流式检测时的100倍,检测时间由原来的8 min缩短为3 min。优化后的方法提高了样本中Pig-a基因突变细胞的分析数量和结果的准确性,提高了检测效率和仪器使用寿命。此外,本研究采用淋巴细胞分离液去除了大部分的淋巴细胞,再用PE-Anti-CD61抗体标记样本,在免疫磁珠分离步骤中进一步去除血小板,排除非目标细胞粒子的影响,降低背景突变率。
ENU是一种较强的基因突变诱变剂,能导致多种生物随机、单碱基突变的发生,在短时间内诱导动物产生大量的随机突变表型[14],是致突变试验中常用的阳性诱变剂。本研究结果显示,ENU经口连续给予大鼠3 d后,RBCCD59-率在试验周期内呈现持续上升趋势,RETCD59-率在第14天可见明显下降。由此可见,Pig-a基因突变在RET细胞中较早发生,并且在较短时间内达到高峰,用RET作为目标检测细胞,可以缩短试验周期。Kimoto等[15]建立了PIGRET方法,利用免疫磁珠法富集大鼠外周血RET细胞,对突变型细胞进行流式检测,可以减少数据分析的工作量,缩短试验周期。日本MMS/JEMS(日本环境基因突变学会哺乳动物基因突变研究组)组织16个实验室对PIGRET方法进行了验证,验证结果认为PIGRET是一种很好的短期体内遗传毒性检测方法[16]。
新的ICH遗传毒性指导原则更加重视体内遗传毒性数据[17],将Pig-a基因突变试验整合到28 d重复给药实验中,采血量少,对动物伤害小,既与ICH的要求一致,又符合实验动物“3R”原则[18-19];本试验取样时间设计灵活,可以同时进行受试物体内遗传毒性剂量关系和时效关系的研究,与传统遗传毒性试验相比,可以获得更加全面的信息。在直接使用流式细胞仪分析Pig-a基因突变的基础上,采用免疫磁珠分离技术进行优化,解决了目标突变细胞数目少的问题,实现了大鼠外周血Pig-a基因突变快速、准确、简便的高通量分析目标[20]。本研究使用自主组合的试剂,利用仪器自带软件,建立了优化的Pig-a基因突变试验方法,拓宽了试验条件,有利于该方法在国内更好地推广。下一步我们拟使用该方法,对弱致突变剂的遗传毒性进行研究,以扩充试验数据库,为制定统一的标准实验方案和相关的指导原则提供更多的数据支持。
参考文献(References)
[1] Takahashi M, Takeda J, Hirose S, et al. Deficient biosynthesis of N-acetylglucosaminyl-phosphatidylinositol, the first intermediate of glycosyl phosphatidylinositol anchor biosynthesis,in cell lines established from patients with paroxysmal nocturnal hemoglobinuria [J]. J Exp Med, 1993, 177(2): 517-521.
[2] Kawagoe K, Takeda J, Endo Y, et al. Molecular cloning of murine pig-a, a gene for GPI-anchor biosynthesis, and demonstration of interspecies conservation of its structure function, and genetic locus [J]. Genomics, 1994, 23 (3): 566-574.
[3] Schuler M, Gollapudi BB, Thybaud V, et al.Need and potential value of the Pig-a in vivo mutation assay — a HESI perspective [J]. Environ Mol Mutagen, 2011, 52(9): 685-689.
[4] Miura D, Dobrovolsky VN, Kimoto T, et al. Accumulation and persistence of Pig-A mutant peripheral red blood cells following treatment of rats with single and split doses of N-ethyl-N-nitrosourea [J]. Mutat Res, 2009, 677(1-2): 86-92.
[5] Dertinger SD, Bryce SM, Phonethepswath S, et al. When pigs fly: immunomagnetic separation facilitates rapid determination of Pig-a mutant frequency by flow cytometric analysis [J]. Mutat Res, 2011, 721(2): 163-170.
[6] Rat Muta Flow PLUS Kit (Plate-Based Processing) http:// litronlabs. com/in_vivo_mutation_publications.html
[7] Revollo J, Pearce MG, Petibone DM, et al. Confirmation of Pig-a mutation in flow cytometry-identified CD48-deficient T-lymphocytes from F344 rats [J]. Mutagenesis, 2015, 30(3): 315-324.
[8] ICH Harmonised Tripartite Guideline M7. 2014. Assessment and Control of DNA Reactive (Mutagenic) Impurities in Pharmaceuticals to Limit Potential Carcinogenic Risk. Available at: http://www.ich.org/fileadmin/Public_Web_Site/ICH_Products/Guidelines/Multidisciplinary/M7/M7_R1_Addendum_Step_4_2017_0331.pdf
[9] 常艳,周长慧,张铭, 等. 体内Pig-a基因突变试验的研究进展 [C]. 中国毒理学会第七次全国毒理学大会暨第八届湖北科技论坛论文集. 2015:113-114.
Chang Y, Zhou CH, Zhang M, et al.Pig-amutation test:a review of recent studies [C]. Proceedings of the 7thNational Congress of Toxicology, Chinese Society of Toxicology and the 8thHubei Society and Technology Forum. 2015: 113-114.
[10] 张铭,周长慧,常艳,等. 体内Pig-a基因突变试验高通量方法联合验证研究 [J]. 癌变 畸变 突变, 2013, 25(5): 392-395.
Zhang M, Zhou CH, Chang Y, et al. Interlaboratory transferability study of thePig-amutation assay with immunomagnetic enrichment [J]. Carcinog Teratog Mutag, 2013, 25(5):392-395.
[11] Corchero JL, Villaverde A. Biomedical applications of distally controlled magnetic nanoparticles [J]. Trends Biotechnol, 2009, 27(8): 468-476.
[12] Wang GY, Li L, Yu YM, et al. Detection of disseminated tumor cells in bone marrow of gastric cancer using magnetic activated cell sorting and fluorescent activated cell sorting [J]. J Gastroenterol Hepatol, 2009, 24(2): 299-306.
[13] 邱林,杜娟,王海燕,等. 利用微流控免疫磁珠分选仪高效富集外周血循环肿瘤细胞[J]. 第三军医大学学报,2016,38(6): 634-637.
Qiu L, Du J, Wang HY, et al. Efficient enrichment of circulating tumor cells from peripheral blood by microfluidic immunomagnetic bead sorter [J]. Acta Acad Med Mil Tert, 2016, 38(6): 634-637.
[14] 孙岩松,杨晓. ENU 诱导点突变—大规模基因突变和功能研究 [J]. 生物工程学报,2011, 17(4): 365-370.
Sun YS, Yang X. ENU induced mutagenesis-large-scale study of gene mutagenesis and function [J]. Chin J Biotech, 2001, 17(4): 365-370.
[15] Kimoto T, Chikura S, Suzuki K, et al. Further development of the rat Pig-a mutation assay: measuring rat Pig-a mutant bone marrow erythroids and a high throughput assay for mutant peripheral blood reticulocytes [J]. Environ Mol Mutagen, 2011,52 (9): 774-783.
[16] Kimoto T, Horibata K, Miura D, et al. The PIGRET assay, a method for measuring Pig-a gene mutation in reticulocytes, is reliable as a short-term in vivo genotoxicity test: Summary of the MMS/JEMS-collaborative study across 16 laboratories using 24 chemicals [J]. Mutat Res, 2016, 811: 3-15.
[17] ICH. Guidance on genotoxicity testing and data interpretation for pharmaceuticals intended for human use [EB/OL]. [2011-11-09]. http://www.ich.org/products/guidelines/safety/article/safety- guidelines.html.
[18] Stankowski LF Jr, Aardema MJ, Lawlor TE, et al. Integration of Pig-a, micronucleus, chromosome aberration, and comet assay endpoints in a 28-day rodent toxicity study with urethane [J]. Mutagenesis, 2015, 30(3): 335-342.
[19] 施畅,马华智,王全军,等. 化学物(药物)毒性测试替代体系的建立及应用 [J].中国比较医学杂志,2017,27(5): 6-8.
Shi C, Ma HZ, Wang QJ, et al. Establishment and application of toxicity testing alternative system for chemicals (new drugs)[J]. Chin J Comp Med, 2017, 27(5): 6-8.
[20] Dertinger SD, Phonethepswath S, Avlasevich SL, et al. Efficient monitoring of in vivo Pig-a gene mutation and chromosomal damage: summary of 7 published studies and results from 11 new reference compounds [J]. Toxicol Sci, 2012, 130(2): 328-348.
